Как говорилось в прошлой лекции каждая технологическая операция является системой типовых процессов (физических, химических, биологических и др.), в ходе которых сырье или промежуточный продукт постепенно изменяют свои характеристики в тоже время каждый из этих типовых процессов можно рассматривать как совокупность (систему) взаимодействующих объектов (твердых тел, жидкостей, газов). Например, операция мойки сырья в моечной машине является системой следующих взаимодействий:
- взаимодействие сырья с рабочими органами и стенками машины
- взаимодействие отдельных частей сырья между собой
- взаимодействие сырья с водой (или другим моющим средством)
- взаимодействие воды с рабочими органами и стенками машины.
В более сложных операциях таких взаимодействий может быть намного больше. В зависимости от природы явлений, которые происходят при взаимодействии, различают:
- физические системы взаимодействующих тел, когда происходят чисто физические изменения
- химические системы, когда взаимодействие определяется химическими закономерностями
- физико-химические системы
- биологические (в т.ч. микробиологические) системы
- биохимические системы.
Согласно требованиям II закона термодинамики любая система взаимодействующих объектов пытается достичь такого состояния, когда запас ее внутренней энергии является минимальным, а энтропия максимальная. Таким состоянием для взаимодействующих систем является состояние равновесия, при котором влияние одних факторов компенсируется действием других.
Для технологических систем, как совокупности операций, состояние равновесия устанавливают, когда входные потоки сырья, поступающего на переработку, уравновешиваются выходными потоками готовой продукции и потоками потерь сырья и промежуточного продукта. Равновесное состояние присуще как отдельной операции, стадиям, так и всему технологическому процессу в целом.
Равновесие систем или их частей является динамическим состоянием, т.е. оно может устанавливаться лишь при определенных условиях. При изменении условий равновесие нарушается, а система изменяет свое состояние до тех пор, пока вновь не установится равновесие, но уже при новых измененных условиях существования системы. Для большинства физических, химических и др. систем взаимодействия возможность и условия равновесного состояния определяются законом равновесия (правилом фаз Гиббса):
S=k+n-Ф
где S – количество ступеней свободы системы (минимальное количество факторов, которые можно изменять независимо один от другого без нарушения системы);
k – количество независимых элементов системы;
n – количество внешних факторов, влияющих на состояние равновесия системы;
Ф – количество фаз в системе.
Системам, в которых может устанавливаться состояние равновесия (равновесные системы), присущи общие закономерности, среди которых для технологии имеют большое значение следующие:
1. Поведение равновесной системы обусловливается ее запасом внутренней энергии, который измеряется потенциалом и движущей силой системы. Потенциал – расстояние (удаление) системы в определенный момент времени от равновесного состояния. Движущая сила – разница потенциалов системы в начальном (или промежуточном) и равновесном состоянии.
Чем дальше отдалена система от состояния равновесия в начале процесса, тем больший потенциал и движущая сила, тем с большей скоростью система двигается к равновесному состоянию. Эта закономерность широко используется в технологии.
2. Система, находящаяся в состоянии равновесия, сама, без внешнего вмешательства, не может изменить это состояние и будет пребывать в нем долго.
3. Чтобы вывести систему из состояния равновесия, необходимо воздействовать на нее извне путем изменения параметров системы (температуры, давления, концентрации и др.).
Поскольку состояние равновесия является динамическим, в равновесной системе могут происходить два противоположных по направлению процесса. Один, направлен на достижение состояния равновесия, называют прямым, а второй – направлен на изменение равновесного состояния – обратным. Какой из этих процессов будет преобладать в определнный момент времени, определяется потенциалом системы.
Большинство физических процессов, какие имеют место в пищевых технологиях (измельчение, осаждение, фильтрование, прессование, посолка, копчение, сушка и др.) являются практически необратимыми т.к. при их проведении создаются такие условия (потенциал), при которых они могут двигаться только в одном направлении. Однако некоторые процессы даже при жестких технологических режимах не проходят до конца. Например, процессы кристаллизации, экстрагирования, конденсации, абсорбции являются обратимыми. Это является причиной существенных потерь или снижения выхода конечного продукта в некоторых пищевых технологиях. Также обратимыми является большинство химических процессов, поэтому задачей технолога является поиск и реализация таких режимов проведения процесса, которые б позволили сделать его максимально экономичным и эффективным.
Все обратимые физические и химико-технологические процессы имеют место при низком потенциале системы, т.е. вблизи состояния равновесия, при котором скорости протекания прямого и обратного процессов уравновешиваются, поэтому главным технологическим способом ускорения таких процессов является повышение потенциала и движущей силы.
Выбор параметров для воздействия на течение технологического процесса в равновесных гомо- и гетерогенных системах происходят на основании принципа Ле-Шателье.
Применительно к технологическим системам он формулируется так: «в системе, которая выведена из состояния равновесия воздействием внешнего фактора, происходят изменения, направленные на ослабление действия этого фактора» этот принцип является проявлением закона инерции и 2 закона термодинамики.
Для иллюстрации возможностей этого применения для управления течением процесса в равновесной системе рассмотрим пример модельной экзотермической реакции синтеза продукта Z из входных веществ X и Y, которая происходит в газовой фазе:
K1

 mX + nY pZ + Q (1)
mX + nY pZ + Q (1)
k2
Q – тепловой эффект процесса;
m, n, p – стехиометрические коэффициенты;
k1 и k2 – константы скоростей соответственно прямой и обратной реакций.
Известно, что основными факторами влияющими на химические процессы является температура и концентрация реагентов, а для реакций при участии газов еще и давление. Исходя из этого, для увеличения выхода конечного продукта реакции Z необходимо:
- снизить температуру в зоне реакции
- увеличить концентрацию одного или двух входных веществ
- уменьшить концентрацию продукта реакции, выводя его из зоны реакции
- повысить даление в зоне реакции.
Во всех представленных вариантах влияния согласно с принципом Ле-Шателье равновесие процесса будет уменьшаться в сторону прямой реакции. Если же целью процесса является более полное преобразование одного из входных веществ (X или Y), то этого достигают создавая излишнюю концентрацию другого входного вещества.
В технологической практике важным является не только знание влияния и направления протекания равновесных процессов, но и глубина протекания процесса, т.е. степени преобразования входных компонентов в готовый продукт. Для этого, надо знать на каком уровне от начала процесса устанавливается динамическое равновесие. Количественной мерой уровня равновесного состояния процесса является константа равновесия, равная отношению констант скоростей прямой и обратной реакции в момент равновесия.
Она может быть рассчитана теоретически, исходя из термодинамических характеристик процесса, или с помощью закона действующих масс. Согласно с законом скорость реакции в определенный момент времени прямо пропорциональна произведению концентраций реагирующих веществ в этот момент. Так, применительно приведенной модельной реакции (1)
скорость для прямой реакции будет: V1=k1[X]m × [Y ]n,
а для обратной – V2=k2[Z]p,
где [X], [Y ], [Z] – молярные концентрации (или парциальные давления) реагирующих веществ в определенный момент.
В состоянии равновесия V1=V2, а поэтому
k1[Xэ]m × [Yэ ]n = k2[Zэ]p
Отсюда: 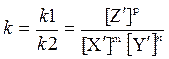 (2)
(2)
Где k – константа равновесия
[Xэ], [Yэ ], [Zэ] – молярные концентрации (или парциальные давления) реагирующих веществ в состоянии равновесия (равновесные концентрации).
Уравнение (2) применимо для расчета константы равновесия в том случае, когда известны равновесные концентрации участников процесса, что на практике не всегда возможно. Поэтому чаще константы равновесия определяют аналитически или экспериментально, исходя из известных начальных концентрациях. Для большинства технологических процессов эти константы определены и приведены в дополнительной литературе в виде таблиц, номограмм, графиков и т.д.
Таким образом, знание законов течения процессов дает возможность определить их направление, зависимость от факторов окружающей среды, подбирать способы влияния на процессы и рассчитывать их параметры.






