Опасная проба
Вот как описывает Карл Фогт (1817–1895) – химик, работавший вместе с Либихом, – один случай. Входит Либих, у него в руках склянка с притертой пробкой. «Ну-ка, обнажите руку», – говорит он Фогту и влажной пробкой прикасается к руке. «Не правда ли, жжет? – невозмутимо спрашивает Либих. – Я только что добыл безводную муравьиную кислоту». После этой пробы у Фогта остался белый шрам на руке: муравьиная, или метановая, кислота НСООН – самая сильная из всех карбоновых кислот.
Нерадивый гимназист
Юстус Либих был одним из неуспевающих учеников в Дармштадтской гимназии (Германия), где в то время почти не изучались естественные науки. После очередной
 неудовлетворительной оценки по латинскому языку директор гимназии спросил Либиха, что он думает делать в жизни.
неудовлетворительной оценки по латинскому языку директор гимназии спросил Либиха, что он думает делать в жизни.
— Я буду химиком, – гордо ответил Юстус Либих.
И директор, и весь класс разразились громким смехом.
— Да разве вообще существует такая профессия? Я слыхал, что таким термином обыкновенно обозначают обманщиков, мошенников, изобретателей изготовления золота, – сказал директор...
«Ценитель» вин
Либих до конца жизни не мог привыкнуть к вину и совершенно в нем не разбирался. Как-то случайно он стал обладателем партии отличного рейнвейна изготовления 1811 г. Либиху это вино показалось кисловатым, и он обработал его химическими веществами, после чего с восторгом отметил, что «вино приобрело мягкость, не потеряв ни одного из своих достоинств». Либих посылает ящик вина, обработанного реактивами, Вёлеру, чтобы тот мог
«насладиться его редкостью». В ответ он получил письмо: «Что касается подарка, то я благодарен тебе скорее за дружеские намерения, чем за само вино. Оно слишком старо и похоже по вкусу на лекарство. Я поменял его на красное вино».
Либих – судебный эксперт
В 1847 г. в доме графа Герлица в Дармштадте после пожара нашли обгорелый труп графини. Медицинские эксперты предположили, что тело графини самовоспламенилось от выпитого спиртного. Но по городу поползли слухи, что в смерти виновен ее муж. Тем временем был арестован медник – отец камердинера графини: у него обнаружили несколько драгоценностей, в том числе и кольцо в виде двух переплетенных змей желтого и белого цвета. Граф Герлиц потребовал нового расследования, утверждая, что такое кольцо было у графини более 20 лет. Однако медник заявил, что кольцо принадлежит ему сорок с лишним лет. На повторном суде Либих – лучший химик-аналитик Германии – выступал в качестве эксперта и доказал, что самовозгорание человеческого тела невозможно, а белая змея изготовлена из платины, а не из серебра, как утверждал медник. Платину же стали применять в ювелирном деле в самое последнее время, и, следовательно, медник лгал. Так удалось установить, что убийцей графини был ее камердинер, причем он попытался сжечь труп, чтобы скрыть преступление.
92. Кремний – Silicium, Si (14)
Третьим элементом, наиболее распространенным в природе, является кремний. Название этого элемента произошло от латинского «ляпис креманс», что значит – камень, дающий огонь. Так назывался твердый камень, дававший при ударе искру и долгое время служивший человеку вместо спичек для получения огня. После изобретения огнестрельного оружия кремень использовали для зажигания пороха в кремневых ружьях и пистолетах.
«Камень, дающий огонь», или кремень, как обычно называют его, – одно из многочисленных соединений кремния, часто входящее в состав большинства горных пород.
Кремень – по-латыни «силекс»; от этого слова происходит научное название элемента
– силициум.
Это песок морских берегов, рек, бескрайних пустынь, мощные отложения глин, песчаники и сланцы, граниты и гнейсы, горные хребты и земная кора на глубину до 20 км состоят, главным образом, из соединений кремния. На долю кремния приходится около 17% от общего числа атомов земной коры, или 30% от ее веса. И не случайно академик А.Е. Ферсман назвал кремний основой земной коры.
Самым распространенным в природе соединением кремния является кремнезем, или
кварц.
 Чистая и прозрачная разновидность кварца, называемая горным хрусталем, была известна уже древним грекам. Они считали горный хрусталь льдом, так сильно замерзшим, что он навсегда утратил способность таять. Греки называли горный хрусталь кристаллом –
Чистая и прозрачная разновидность кварца, называемая горным хрусталем, была известна уже древним грекам. Они считали горный хрусталь льдом, так сильно замерзшим, что он навсегда утратил способность таять. Греки называли горный хрусталь кристаллом –
«кристаллос», что значило лед. Впоследствии это слово вошло в минералогию и, получив широкое распространение, стало употребляться для обозначения твердых тел, имеющих форму правильных многогранников.
Кроме горного хрусталя, кристаллы которого достигают иной раз огромной величины (нескольких метров), кварц встречается в природе в виде окрашенных соединений. Среди них чистые и прозрачные разновидности, окрашенные в фиолетовый (аметисты) и в лимонно-желтый цвет (цитрины) относятся к числу драгоценных и полудрагоценных самоцветов. Общее число разновидностей кварца достигает двухсот, количество природных соединений, содержащих кварц, измеряется многими сотнями.
Из всех элементов периодической таблицы кремний является одним из немногих, соединения которого служат человеку очень давно и чрезвычайно разнообразно.
Первым соединением кремния, с которым первобытный человек «выходил в люди», был кремень – твердый камень. Используя способность кремня раскалываться на длинные прочные пластинки, первобытный человек, терпеливо отбивая от них осколки ударами другого камня, изготовлял ножи для обработки шкур, острия для копий, наконечники для стрел.
Но до того как кусок кремня, подобранный с земли первобытным дикарем, превратился с помощью его рук в каменный скребок или нож, прошел огромный период времени, в сравнении с которым известный нам исторический период является таким же малым, как жизнь одного человека в сравнении с этим историческим периодом.
Если в доисторический период важная роль принадлежала кремнию, то с первых дней исторического времени и до сих пор не менее важную роль в практической деятельности человека играет кварц. Кварц служит основным материалом для изготовления стекла. В популярных книгах и брошюрах, касающихся вопросов происхождения стекла, очень часто приводится рассказ римского ученого Плиния Старшего о случайном открытии стекла финикийскими купцами-мореплавателями. Застигнутые сильной бурей, они были вынуждены переждать ее в небольшой бухте. Не найдя на ее песчаных берегах каких-либо камней для очага, чтобы сварить пищу, они воспользовались глыбами соды, которой был нагружен корабль. Утром один из моряков, разгребая тлеющие остатки костра, нашел в золе водянисто-блестящие, твердые слитки, непохожие ни на одно известное в то время вещество. Это, по утверждению Плиния, и было стекло, получившееся в результате сплавления соды с морским песком.
В наши дни рассказ Плиния (погибшего, кстати говоря, при извержении Везувия в 79 г.) был проверен специалистами-стекловарами. На песчаном морском берегу из кусков соды они сложили очаг. В нем всю ночь пылало пламя. Однако опыт не увенчался успехом. Утром, когда пламя очага угасло, слитков стекла в золе не нашли. Очевидно температура, которую дает пламя костра, недостаточна для того, чтобы сода могла сплавиться с песком и превратиться в стекло.
Сейчас невозможно точно сказать, кто и когда изобрел стекло, так же как невозможно указать, кто и когда впервые обжег горшок, слепленный из глины. Известно лишь, что стекло является одним из древнейших изобретений человечества. Так, ожерелье, найденное на шее мумии египетской царицы Хатшепсут, состоящее из зеленовато-черных стеклянных бусин, насчитывает 3400 лет. Еще старше возраст стеклянной бусины из могилы города Фив, насчитывающей 5500 лет.
 Высокого совершенства в стеклоделии достигли мастера древнего Рима. О большом искусстве получения цветных стекол свидетельствует мозаичный пол с изображением цепной собаки. Эта мозаика была обнаружена в одном из домов при раскопках Помпеи. Еще более оригинальна мозаика в вилле римского императора Адриана, известная в искусстве под названием «Неподметенный пол». Выложенная на полу столовой, она изображает его неподметенным: на полу разбросаны кости от съеденной дичи, хлебные крошки, различный мусор.
Высокого совершенства в стеклоделии достигли мастера древнего Рима. О большом искусстве получения цветных стекол свидетельствует мозаичный пол с изображением цепной собаки. Эта мозаика была обнаружена в одном из домов при раскопках Помпеи. Еще более оригинальна мозаика в вилле римского императора Адриана, известная в искусстве под названием «Неподметенный пол». Выложенная на полу столовой, она изображает его неподметенным: на полу разбросаны кости от съеденной дичи, хлебные крошки, различный мусор.
Римские стеклоделы были также большими мастерами производства различных изделий из стекла. Они делали кувшины для воды, масла и вина; чаши и кубки, вазы; специальные сосуды, так называемые труллы, служившие для омовения рук; слезницы – крошечные флакончики для духов. Некоторые из таких предметов дошли до наших дней; они бережно хранятся в музеях крупнейших городов Западной Европы. Среди образцов подлинного искусства особого упоминания заслуживает ваза Аюджио из дома богача Meлегера в Помпее. Это красивейший сосуд из темно-синего стекла, украшенный венком из винограда и плюща, сделанным из молочно-белого стекла. Подобным шедевром является и ваза, найденная в гробнице римского императора Александра Севера, из темно-голубого стекла, украшенная резными рисунками, изображающими греческий миф о Язоне и волшебнице Медее.
Изучение состава древнерусских стекол домонгольского времени показывает замечательную самобытность русских мастеров, сумевших создать совершенно оригинальную рецептуру. Наиболее типичными для древнерусского самобытного стеклоделия являются свинцово-кремнеземные, калиево-свинцово-кремнеземные стекла. Из них древнерусские умельцы изготовляли бусы, браслеты, мозаику, посуду, оконные стекла. Свинцово-кремнеземные стекла были обнаружены также в Польше. В других странах стекла такого состава еще не найдены.
Одно из самых древних изобретений – стекло – приобрело в жизни человека огромное значение. Стекло видно всюду, оно на каждом шагу – в повседневности нашего быта, в промышленности, в технике, в науке, в произведениях искусств. Оконное, бутылочное, ламповое, зеркальное стекло; стекло домашней, хозяйственной, лабораторной посуды и аппаратов; стекло оптическое – от стекол очков до сложных анастигматов фотокамер; линзы бесчисленных оптических приборов – от микроскопов, открывающих огромный, но для простого глаза невидимый мир, до телескопов, уносящих нас в бесконечные просторы мироздания. Трудно перечислить все области применения стекла и невозможно сосчитать различные предметы, сделанные из него.
Не случайно еще в 1752 г. основоположник научной химии М.В. Ломоносов, готовясь к открытию стекольного завода, в письме, написанном на имя И.И. Шувалова, в стихотворной форме о пользе стекла, заканчивая перечисление предметов, изготовляемых из стекла, подчеркивает его достоинства словами:
«Далече до конца Стеклу достойных хвал, На кои целый год едва бы мне достал».
Большой вклад в развитие художественного стеклоделия в России был внесен Ломоносовым. В созданной им в 1748 г. химической лаборатории было проведено около 4000 опытов по варке цветного стекла, для которых Ломоносов «не токмо рецепты сочинял, но и материалы... своими руками по большей части развешивал и в печь ставил...».
На основе рецептов, разработанных Ломоносовым, стекольный завод, также созданный его усилиями в Усть-Рудице в 1753 г., начал изготовлять стекло: «разноцветное прозрачное для выделки бисера, стекляруса, посуды и прочих «галантерейных изделий»; и непрозрачное, так называемая смальта, для мозаики». Из смальты Ломоносов выполнил
 несколько мозаичных картин, среди которых «Полтавская баталия» получила наибольшую известность и сохранилась до наших дней.
несколько мозаичных картин, среди которых «Полтавская баталия» получила наибольшую известность и сохранилась до наших дней.
Успехи современной химии в области изучения свойств стекла сделали его материалом, из которого изготовляются несгораемые ткани, театральные занавеси, декорации, ковры, изоляционные ленты, вата, войлок и многие другие предметы техники и быта.
Ценные свойства кварца (пропускает ультрафиолетовые лучи, малый коэффициент расширения, химическая инертность, тугоплавкость и др.) обеспечили ему широкое применение в различных областях науки и техники.
Тончайшие, исключительно прочные, нити, получаемые из кварца, расплавленного в пламени гремучего газа, применяются в точных электроизмерительных приборах и инструментах для подвешивания деталей (стрелок, указателей, рычагов и т.д.). Из тугоплавкого кварцевого стекла изготовляют термометры для измерения высоких температур. Малый коэффициент расширения позволяет употреблять кварц для изготовления сосудов, трубок, лабораторной посуды и разнообразной химической аппаратуры применяемой в условиях резких колебаний температуры. Оптические свойства кварца обеспечивают его применение в производстве всевозможных оптических приборов, в изготовлении ламп «горного солнца», в устройстве закрытых соляриев и т.д.
Есть еще много других минералов, содержащих соединения кремния, которые также находят разнообразное применение в технике. Одни из них за прочность и красивый вид (гранит, порфир, лабрадор и др.) используются как строительный и отделочный материалы; другие, обладая исключительной твердостью, применяются в качестве так называемых точных камней в разнообразных измерительных приборах, от часовых механизмов до аналитических весов и аппаратов специального назначения; третьи – цементы, обладая способностью в смеси с другими веществами связывать воедино щебень, камни, кирпичи, широко применяются в строительстве; четвертые – за безукоризненную прозрачность, чистоту и блеск ценятся как самоцветы и, наконец, пятые, обладающие пестрой, яркой, необычной окраской (яшмы, нефрит, халцедоны), употребляются в художественных изделиях, которые украшают дворцы и музеи.
Важнейшее соединение кремния – кремнезем – необходим для жизни растений и животных. В растениях кремнезем накапливается в стеблях, что значительно повышает их механическую прочность. Как бы ни были сильны порывы бури и удары водяных струй грозового ливня, тонкие колосья хлебных злаков выдерживают их, гнутся иной раз до самой земли, но не ломаются. Кремнезем входит в состав не только крупных растений, но и мельчайших из них – диатомовых водорослей. Кремний нужен и животным. Птицы без кремнезема не создают прочной скорлупы яиц. Некоторые виды губок строят опорные образования своего тела также из кремнезема. Нежные комочки живой материи, известные под названием радиолярий, создают непревзойденные по своей красоте скелеты из кремнезема. Кремнезем есть и в организме человека. Больше всего содержится кремнезема в стекловидном теле глаза, где количество его достигает до 0,06% по весу. Однако биологическая роль кремнезема в человеческом организме до сих пор еще недостаточно ясна.
Кремний – это мелкий бурый порошок или серые, твердые, но довольно хрупкие кристаллы (плотность 2,4). В кристаллическом состоянии кремний хорошо проводит тепло, обладает металлическим блеском. Однако электропроводность, столь характерная для металлов, у кремния весьма мала и составляет 0,001 электропроводности ртути.
Кремний тугоплавок (он плавится при 1415°С), кипит же при 2360°С. При комнатной температуре кремний инертен, но при нагревании выше 500°С становится
реакционноспособным и соединяется с кислородом, серой, хлором, бромом и другими элементами. Хорошо растворяясь в расплавленных металлах, кремний образует с некоторыми из них (железом, медью, платиной и др.) силициды.
Кремний – простое вещество
Рисунок 185.
Кристаллический кремний
Рисунок 186.
Монокристалл кремния
Рисунок 187.
Изделия из кремния
В технике применяют сплав кремния с железом – ферросилиций. Ферросилиций непосредственно используется для изготовления кислотоупорных изделий. В металлургии ферросилиций применяется для введения кремния в различные сорта специальных сталей.
Новейшие достижения химии по получению чистейшего кремния открывают широкую дорогу в области полупроводниковой техники. Создание кремниевых выпрямителей следует считать одним из величайших достижений современной науки. С помощью кремния, в некоторой мере, была осуществлена мечта о непосредственном преобразовании солнечной энергии в электрическую. Искусственные спутники Земли получали электричество от солнечных кремниевых батарей. Она не только обеспечивала энергией всю аппаратуру спутника, но и заряжала их аккумуляторы, вступавшие в строй при переходе спутника в область земной тени. Успехи химии высокомолекулярных соединений ввели в круг интересов химиков-синтетиков и кремний.
Способность кремния соединяться с кислородом, образуя цепные структуры (так называемые силоксановые группировки), дает возможность получать большое число различных соединений. Среди них – смазочные масла, сохраняющие присущие им свойства в интервале температур от –60°С до +200°С; антипенные жидкости, предупреждающие вскипание смазочных масел в механизмах; соединения, обладающие водоотталкивающими свойствами; изоляционные материалы; пластмассы и многие другие вещества.
Соединения кремния
 Рисунок 188. Кристалл кварца SiO2
Рисунок 188. Кристалл кварца SiO2
Рисунок 189. Разновидность кварца – аметист
Рисунок 190. Аэрогель на основе SiO2

§30. Плотность и относительная плотность газов

Плотность веществ
Из курса физики вам известно, что плотность вещества – это отношение массы вещества к его объему. Символ, которым обозначают плотность – греческая буква r (ро):


С учетом того, что плотность рассчитывается путем деления массы на объем, несложно понять, что единица измерения этой величины – г/мл. Плотность можно измерять также в г/л, кг/л и т.п.
Для газообразных веществ плотность можно рассчитать и при помощи молярной массы путем деления ее на молярный объем газа, то есть на 22,4 л/моль:

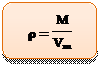
Так, например, плотность углекислого газа будет рассчитываться как:
 M(CO2) = 44 г/моль
M(CO2) = 44 г/моль
 r(СО2) =
r(СО2) =
M = 44 г/моль V m 22,4 л/моль
= 1,96 г/л






