С этого момента слава алюминия как драгоценного металла меркнет. Он перестает быть предметом внимания капризной моды. И благодаря ценным свойствам – легкости, хорошей ковкости, способности прокатываться в листы, вытягиваться в проволоку, хорошо заполнять форму при отливке, стойкости к воздуху, воде и разбавленным органическим кислотам (уксусной, лимонной и др.) – начинает применяться в технике.
 Алюминий конкурирует с медью в электротехнической промышленности, сплавы алюминия с другими металлами находят широкое применение в автомобильной и военной промышленности, строительстве, авиа- и ракетостроении. Алюминий, который совсем недавно считался драгоценным металлом, используется для придания жаропрочности и коррозионной устойчивости поверхностям чугунных отливок, для изготовления цистерн, в которых перевозят и хранят концентрированную перекись водорода и другие опасные вещества.
Алюминий конкурирует с медью в электротехнической промышленности, сплавы алюминия с другими металлами находят широкое применение в автомобильной и военной промышленности, строительстве, авиа- и ракетостроении. Алюминий, который совсем недавно считался драгоценным металлом, используется для придания жаропрочности и коррозионной устойчивости поверхностям чугунных отливок, для изготовления цистерн, в которых перевозят и хранят концентрированную перекись водорода и другие опасные вещества.
При 100–150°С алюминий настолько пластичен, что из него может быть получена фольга тоньше 0,01 мм. Подобная фольга широко применяется для изготовления электрических конденсаторов и упаковки продуктов.
Тончайший порошок алюминия применяется для составления горючих и взрывчатых смесей, для изготовления серебристой краски, состоящей из мельчайших чешуек алюминия, весьма устойчивой против атмосферных воздействий. Грубозернистый порошок алюминия используется в алюминотермии. Алюминотермией называется (открытый в 1859 г.) способ восстановления металлов из их окисей порошкообразным алюминием. Алюминотермию часто используют для получения высоких температур при сваривании металлических деталей. Исходная в этом случае смесь – «термит» – состоит из смеси порошков алюминия и окислов железа. Подожженная с помощью специального запала, она нагревается при горении до 3500°С.
Термитный брикет весом всего в 50 г за несколько секунд проплавляет железный лист толщиной в 2 мм. Бетон и кирпич от термитного порошка, горящего с брызгами, но без пламени, растрескиваются.
| |||||||
В состав известных всем точильных камней входит окись алюминия, или глинозем. Природный минерал, содержащий окись алюминия, называется корундом. Обычно загрязненный окисью железа природный корунд вследствие своей очень большой твердости применяется для изготовления шлифовальных кругов, брусков и т.п. В мелкораздробленном виде он под названием наждака служит для очистки металлических поверхностей и для
изготовления наждачной бумаги. Для тех же целей часто пользуются окисью алюминия, полученной оплавлением боксита (техническое название – алунд).
Прозрачные кристаллы корунда, окрашенные соединениями хрома в красивый кроваво-красный цвет, представляют драгоценный камень – рубин. Кристаллы рубина в настоящее время получают искусственным путем. Замечательные свойства кристаллов синтетического рубина, а именно способность испускать порции (кванты) света красного цвета при облучении их ксеноновой лампой, легли в основу устройства мощного оптического излучателя – лазера.
При соответствующем устройстве лазер испускает красный луч строго определенной частоты, в миллион раз превышающей яркость такой же площади поверхности солнца и обладающий огромным световым давлением (миллионы атмосфер).
Рисунок 146. Необработанный и обработанный рубин
Рисунок 147. Необработанный и обработанный сапфир
 Рисунок 148. Действие рубинового лазера
Рисунок 148. Действие рубинового лазера
Век алюминия сменил век железа…
Рисунок 149. Рубиновый стержень – основной элемент рубинового лазера
§23. Водород

Водород как химический элемент
Водород – первый химический элемент Периодической Системы химических элементов Д.И. Менделеева. Химический элемент водород расположен в первой группе, главной подгруппе, первом периоде Периодической Системы.

 Относительная атомная масса водорода 1.
Относительная атомная масса водорода 1.
Водород имеет наиболее простое строение атома, он состоит из единственного электрона,
который находится в околоядерном пространстве. Ядро атома водорода состоит из одного протона.

 Атом водорода, в химических реакциях может как отдавать, так и присоединять электрон, образуя два вида ионов:
Атом водорода, в химических реакциях может как отдавать, так и присоединять электрон, образуя два вида ионов:
H0 + 1ē → H1−; H0 – 1ē → H1+.
Водород – самый распространённый элемент во Вселенной. На его долю приходится около 88,6% всех атомов (около 11,3% составляют атомы гелия, доля всех остальных вместе взятых элементов – порядка 0,1%). Таким образом, водород – основная составная часть звёзд и межзвёздного газа. В межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Массовая доля водорода в земной коре составляет 1%. Это девятый по распространённости элемент. Значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках.
Физические свойства водорода
Простое вещество, образованное химическим элементом водородом, имеет молекулярное строение. Его состав отвечает формуле Н2. Как и химический элемент, простое вещество также называют водородом.
Водород – бесцветный газ без запаха и вкуса, практически нерастворим в воде. При комнатной температуре и нормальном атмосферном давлении растворимость составляет 18,8 мл газа на 1 л воды.

 Водород – самый легкий газ, его плотность составляет 0,08987 г/л. Для сравнения: плотность воздуха равна 1,3 г/л.
Водород – самый легкий газ, его плотность составляет 0,08987 г/л. Для сравнения: плотность воздуха равна 1,3 г/л.
Водород способен растворяться в металлах, так например, в одном объеме палладия может раствориться до 850 объемов водорода. Из-за крайне малого размера молекул водород способен к диффузии через многие материалы.
Подобно другим газам водород при низких температурах конденсируется в бесцветную прозрачную жидкость, это происходит при температуре –252,8°С. При достижении температуры –259,2°С водород кристаллизуется в виде белых кристаллов, похожих на снег.
В отличие от кислорода, для водорода не характерна аллотропия.
Применение водорода
Водород используют в различных отраслях промышленности. Много водорода уходит на производство аммиака (NH3). Из аммиака получают азотные удобрения, синтетические волокна и пластмассы, лекарства.
В пищевой промышленности водород используют при производстве маргарина, в состав которого входят твердые жиры. Чтобы их получить из жидких жиров, через них пропускают водород.
Когда водород горит в кислороде, то температура пламени составляет около 2500°C. При такой температуре можно плавить и сваривать тугоплавкие металлы. Таким образом, водород используется при сварке.
Смесь жидких водорода и кислорода применяют как ракетное топливо.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт – вода, а не углекислый газ, вызывающий парниковый эффект.
Ученые предполагают, что в середине XXI века должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
 В конце XIX – начале ХХ веков, на заре эры воздухоплавания, водородом заполняли воздушные шары, дирижабли и аэростаты, так как он намного легче воздуха. Однако эпоха дирижаблей начала стремительно уходить в прошлое после катастрофы, случившейся с дирижаблем Гинденбург. 6 мая 1937 года дирижабль, заполненный водородом, загорелся, что повлекло за собой гибель десятков его пассажиров.
В конце XIX – начале ХХ веков, на заре эры воздухоплавания, водородом заполняли воздушные шары, дирижабли и аэростаты, так как он намного легче воздуха. Однако эпоха дирижаблей начала стремительно уходить в прошлое после катастрофы, случившейся с дирижаблем Гинденбург. 6 мая 1937 года дирижабль, заполненный водородом, загорелся, что повлекло за собой гибель десятков его пассажиров.
Водород крайне взрывоопасен в определенной пропорции с кислородом. Несоблюдение правил техники
Рисунок 150. Катастрофа
дирижабля Гинденбург (1937)
безопасности и привело к воспламенению и взрыву дирижабля.
Подведем итоги

Вопросы, упражнения и задачи
Охарактеризуйте водород как химический элемент.
Перечислите физические свойства водорода.
Выберите, какие из физических свойств относятся к водороду: газ, жидкий, бесцветный, голубой, хорошо растворим в воде, малорастворим в воде, легче воздуха, имеет запах, тяжелее воздуха, без вкуса.
Выберите, какие из физических свойств относятся к водороду: кислый, твердый, без запаха, в 14,5 раз легче воздуха, электропроводен, сжижается при очень низкой температуре, неэлектропроводен.
Два воздушных шара наполнены газами. Первый – водородом, второй – кислородом. Как определить, где какой газ?
Как называется и каково устройство сосуда, при помощи которого можно хранить жидкий водород?
Выберите характеристики химического элемента водорода: а) находится в I периоде, главной подгруппе I или VII группы;
б) относительная молекулярная масса 2; в) порядковый номер 1;
г) химическая формула Н2;
д) относительная атомная масса 1; е) валентность I;
ж) газ.
Выберите характеристики простого вещества водорода: а) молекулярная масса 2 г/моль;
б) заряд ядра +1; в) валентность I;
г) бесцветный газ;
д) химическая формула Н2. е) не имеет запаха.
Вставьте пропущенные слова «химический элемент» или «простое вещество»: а) на земле... водород встречается редко;
б)... водород входит в состав воды, природного газа, всех органических веществ;
в)... водород занимает 9-е место по распространенности в земной коре (1% по массе); г)... водород мало растворим в воде, бесцветный газ без вкуса и запаха;
д) содержание... водорода в организме человека – 10%.
Составьте два предложения, в одном из которых о водороде говорится как о химическом элементе, в другом – как о простом веществе.
Определите, в каком случае речь идет о водороде как химическом элементе, а в каком как о простом веществе:
а) водород входит в состав многих неорганических веществ, например кислот и оснований; б) водород – самый легкий газ;
в) на долю водорода приходится 1% (по массе) Земли; г) водород – это главная составная часть многих звезд.
На долю водорода приходится около 88,6% всех атомов Вселенной. Около 11,3% составляют атомы гелия. Определите соотношение атомов водорода и гелия.
При очень высокой температуре треть молекул водорода разложилась на атомы. Каково соотношение количества молекул и атомов в образовавшейся смеси?
Определите элемент, если его высшая валентность в соединении с кислородом равна VII, а относительная молекулярная масса соединения с водородом – 128.
Вычислите массовую долю водорода в дигидрофосфате аммония NH4H2PO4 – веществе, которое используется как удобрение.
Относительная молекулярная масса соединения элемента Х с водородом равна 32, а соединения элемента Y с водородом – 78. Назовите элементы X и Y, и приведите формулы этих соединений.
Сколько граммов воды разложилось при действии электрического тока, если получилось 2 г водорода?
Объясните, на каком свойстве основано:
а) использование водорода для наполнения им шаров-зондов; б) заполнение сосуда водородом способом вытеснения воды.
Объясните, как собрать водород способом вытеснения воздуха. Можно ли точно также собрать кислород? Почему?
Почему водород содержится только в верхних слоях атмосферы, причем в малых количествах?
 Блокнот эрудита
Блокнот эрудита
71. ГЕНРИ КАВЕНДИШ (1731–1810)
Английский физик и химик Генри Кавендиш родился в Ницце; второй сын лорда Чарлза Кавендиша, герцога Девонширского. В 1749–1753 гг. обучался в Кембриджском университете, где заинтересовался естественными науками (надо отметить, что отец Кавендиша довольно успешно занимался метеорологией). В 1860 г. Кавендиш стал членом Лондонского королевского общества, а в 1802 г. был избран в Парижскую академию наук. Унаследовав в 1773 г. от своего дяди крупное состояние, Кавендиш тратил почти все доходы на проведение экспериментов; в своем доме в Лондоне он устроил лабораторию, где собрал лучшие приборы и инструменты того времени. Один из
Рисунок 151. Генри
Кавендиш (1731–1810)
биографов Кавендиша, французский физик Жан Батист Био, назвал его самым учёным среди и богачей и самым богатым среди
учёных. В то же время Кавендиш вёл очень скромный и уединённый образ жизни. В частной жизни Кавендиш слыл чудаком и оригиналом; со своими домашними он объяснялся исключительно знаками, раз навсегда выработанными, дабы не терять напрасно времени и слов, и охотно беседовал только с коллегами по науке.
Кавендиш проявлял полное равнодушие к богатству и славе; кроме того, он был женоненавистником. Его отличали крайняя застенчивость и сдержанность. У него не было друзей, а число знакомых не превышало трех-четырех человек.
Гэмфри Дэви писал о нем: «Голос его похож был на какой-то писк, обращение его было нервное. Он пугался чужих людей и когда смущался, то ему трудно было говорить». Постоянным обеденным блюдом его была баранья нога. Однажды, когда неожиданно у него собралось к обеду пятеро гостей и экономка усомнилась, что одной бараньей ноги будет достаточно, сэр Генри велел ей «в таком случае купить две».
Библиотека его была доступна для всех. Сам Кавендиш брал книги из собственной библиотеки под расписку. Свою лабораторию он устроил в конюшне, и в течение всей жизни вел в ней исследования. Каждый день, включая и воскресенья, он проводил за работой, но результаты своих исследований публиковал неохотно. Работы Кавендиша отличались величайшей точностью и изяществом, а выводы он делал с большой осторожностью.
 Основные труды Кавендиша относятся к химии газов и различным разделам экспериментальной физики. В 1766 г. Кавендиш опубликовал первую важную работу по химии – «Искусственный воздух», где сообщалось об открытии «горючего воздуха» (водорода). Он разработал методику собирания, очистки и изучения газов, с помощью которой в 1766 г. ему удалось получить в чистом виде водород и углекислый газ, установить их удельный вес и другие свойства. В 1781 г. Кавендиш определил состав воздуха, а в 1784 г., сжигая водород, установил химический состав воды, опровергнув представления об её элементарности. Оставаясь твёрдым приверженцем теории флогистона, он тем не менее не оспаривал взгляды своего современника Антуана Лавуазье, допуская, что его кислородная теория имеет право на существование.
Основные труды Кавендиша относятся к химии газов и различным разделам экспериментальной физики. В 1766 г. Кавендиш опубликовал первую важную работу по химии – «Искусственный воздух», где сообщалось об открытии «горючего воздуха» (водорода). Он разработал методику собирания, очистки и изучения газов, с помощью которой в 1766 г. ему удалось получить в чистом виде водород и углекислый газ, установить их удельный вес и другие свойства. В 1781 г. Кавендиш определил состав воздуха, а в 1784 г., сжигая водород, установил химический состав воды, опровергнув представления об её элементарности. Оставаясь твёрдым приверженцем теории флогистона, он тем не менее не оспаривал взгляды своего современника Антуана Лавуазье, допуская, что его кислородная теория имеет право на существование.
В 1772 г. одновременно с Даниилом Резерфордом Кавендиш открыл азот, однако опубликовал свои результаты с большим опозданием. В 1785 г. с помощью электрической искры он получил оксиды азота и исследовал их свойства. Он показал, что при пропускании электрического разряда через воздух над поверхностью воды азот реагирует с кислородом с образованием азотной кислоты. При этом Кавендиш обратил внимание на то, что 1/120 часть первоначального объема воздуха не вступает в реакцию. Вследствие несовершенства методов анализа и приборов Кавендиш не смог обнаружить в непрореагировавшем остатке новый элемент – аргон, который был открыт в 1894 г. Уильямом Рамзаем.
Большинство работ Кавендиша в области теплоты и электричества были опубликованы лишь через много лет после его смерти. Кавендиш ввёл в науку понятие электрического потенциала, исследовал зависимость ёмкости электрического конденсатора от среды, изучал взаимодействие электрических зарядов, предвосхитив закон Ш. Кулона. Он впервые сформулировал понятие теплоёмкости. В 1790 г. Кавендиш сконструировал крутильные весы и измерил с их помощью силу притяжения двух сфер, подтвердив закон всемирного тяготения, а также определил гравитационную постоянную, массу и среднюю плотность Земли. Именем Кавендиша названа организованная Максвеллом в 1874 г. физическая лаборатория в Кембриджском университете.
Кавендиш жил и умер в одиночестве. Его девиз гласил: «Все определяется мерой, числом и весом».
72. Три водорода
В природе водород встречается в виде трех разновидностей атомов – изотопов: обычный водород, тяжелый и сверхтяжелый водород. Они отличаются составом ядра атома: в обычном водороде (протии) ядро состоит из одного протона, у тяжелого водорода ядро состоит из одного протона и одного нейтрона, у сверхтяжелого – из одного протона и двух нейтронов.
Тяжелый водород содержится в обычном водороде в небольших количествах. На 6 тыс. атомов обычного водорода приходится 1 атом тяжелого. От греческого слова «деутерос», что
 значит второй, тяжелый водород, как второй изотоп водорода, называется дейтерием. По аналогии с протоном ядро этого атома получило название дейтон; часто его называют дейтерон.
значит второй, тяжелый водород, как второй изотоп водорода, называется дейтерием. По аналогии с протоном ядро этого атома получило название дейтон; часто его называют дейтерон.
Обозначают дейтерий или латинской буквой D, или сохраняют химическое обозначение водорода и, указывая цифрой 2 его массовое число, пишут Н2.
Ядро дейтерия состоит из протона и нейтрона, поэтому масла атома дейтерия в два раза больше массы атома обычного водорода. Такое резкое расхождение в массах изотопов одного и того же химического элемента является единственным случаем среди известных изотопов различных элементов.
Вода, в которой протий заменен дейтерием, называется тяжелой. Она отличается от обычной своими свойствами. Так, тяжелая вода замерзает не при 0°С, как обычная, а при
+3,8°С, кипит не при 100°С, а при 101,4°С, имеет большую плотность (1,1056), чем обычная; в тяжелой воде невозможна жизнь. В обычной воде всегда содержится примесь тяжелой. Количество ее невелико и составляет 0,02% от общей массы. Однако собранная со всего земного шара, она могла бы наполнить водоем, равный по величине объему Черного моря.
Тяжелая вода используется при получении атомной энергии в ядерных реакторах в качестве вещества, замедляющего нейтроны.
Получение тяжелой воды в чистом виде – длительный и дорогой процесс, основанный на электролизе (разложении электрическим током) воды, при котором в первую очередь разлагаются молекулы «обыкновенной» воды, тогда как тяжелая накапливается в остатке. В Европе производство тяжелой воды в промышленном масштабе было впервые осуществлено немцами в годы второй мировой войны на территории оккупированной Норвегии, располагавшей дешевой энергией гидроэлектростанций. Тяжелая вода предназначалась для создания нового вида оружия (атомной бомбы), на которое командование фашистских армий возлагало последние надежды. 28 февраля 1943 г. норвежские патриоты совместно с английскими парашютистами взорвали цех тяжелой воды. Начавшиеся вслед за этим налеты на завод английской авиации вынудили фашистское командование перевезти оборудование и накопленный запас воды в Германию. Норвежские бойцы из армии сопротивления 20 февраля 1945 г. взорвали пароход, уничтожив вместе с оборудованием и 16 м 3 тяжелой воды.
Стоимость тяжелой воды все еще высока. Один кубический метр тяжелой воды стоит не менее 300 тыс. долларов.
Известен и третий «сверхтяжелый» изотоп. Тритий – называют этот изотоп от латинского слова «тритиум» – третий. Он может быть получен искусственным путем в результате ядерных реакций, например, при «стрельбе» нейтронами в атомы легкого металла лития. В ядрах атомов трития имеется два нейтрона и один протон. В природе распространенность трития ничтожно мала. Один атом трития приходится на миллиард миллиардов атомов обычного водорода. Тритий является радиоактивным изотопом водорода. Он излучает b-частицы и превращается в изотоп гелия с атомной массой 3. Период полураспада трития около 12,5 лет.
§24. Получение водорода

История открытия водорода
История водорода начинается с XVI века, когда было замечено, что при действии кислот на железо и другие металлы выделяется некий неизвестный газ. Первоначально его назвали «горючим воздухом». Такое название газ получил из-за способности гореть.
Во второй половине XVIII века английский ученый Генри Кавендиш получил водород при действии соляной кислоты HCl на цинк:
Zn + 2HCl = ZnCl2 + H2.
Что же такое кислота с точки зрения химии? Кислота – это сложное вещество, в состав которого всегда входят атомы водорода. В формулах кислот атомы водорода принято писать на первом месте. Атомы, следующие в формуле за водородом, называют кислотным остатком. Так, в соляной кислоте HCl кислотный остаток – Cl. Например, в серной кислоте H2SO4, кислотный остаток – SO4.


Генри Кавендиш изучил свойства «горючего воздуха». Он установил, что этот газ намного легче воздуха, а при сгорании на воздухе образует прозрачные капли жидкости. Этой жидкостью оказалась вода. Генри Кавендиша считают первооткрывателем водорода.
Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 году французским химиком Антуаном Лораном Лавуазье.
Антуан Лоран Лавуазье дал этому веществу латинское название (Hydrogenium), которое происходило от греческих слов «хюдор» – вода и «геннао» – рождаю.
В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у просто вещества H2. Русское слово водород – это точный перевод латинского названия Hydrogenium.
Получение водорода в лаборатории
Современный лабораторный способ получения водорода не отличается от того, которым его получал Генри Кавендиш. Это реакции металлов с кислотами.
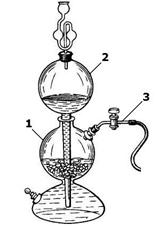 В лаборатории водород получают в аппарате Киппа (рисунок 152). Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
В лаборатории водород получают в аппарате Киппа (рисунок 152). Аппарат Киппа изготовляется из стекла и состоит из нескольких частей:
1. реакционная колба с резервуаром;
2. воронка с длинной трубкой;
3. газоотводная трубка.
Реакционная колба имеет верхнюю шарообразную часть с отверстием, в которое вставляется газоотводная трубка, снабженная краном или зажимом, и нижний резервуар в виде полусферы. Нижний резервуар и реакционная колба разделены резиновой или пластиковой прокладкой с отверстием, через которое проходит в нижний резервуар длинная трубка воронки, доходящая почти до дна. На прокладку через боковое отверстие шпателем насыпают
твёрдые вещества (мрамор, цинк). Отверстие закрывается пробкой с газоотводной трубкой. Затем при открытом кране или зажиме в
Рисунок 152.
Аппарат Киппа
верхнюю воронку заливается раствор кислоты. Когда уровень жидкости достигает вещества на прокладке, начинается химическая реакция с выделением газа.
При закрытии крана давление выделяющегося газа выдавливает жидкость из реактора в верхнюю часть воронки. Реакция прекращается. Открытие крана приводит к возобновлению реакции.
Поместим в реакционную колбу кусочки цинка. В качестве кислоты воспользуемся серной кислотой. При контакте цинка и серной кислоты протекает реакция:
Zn + H2SO4 = ZnSO4 + H2.
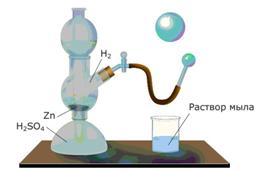 Водородом можно заполнить мыльный пузырь. Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода.
Водородом можно заполнить мыльный пузырь. Для этого необходимо опустить газоотводную трубку в мыльный раствор. На конце трубки начнется формирование мыльного пузыря, заполненного водородом; со временем пузырь отрывается и улетает вверх, что доказывает легкость водорода.
Соберем выделяющийся водород. С учетом того, что водород намного легче воздуха, для сбора водорода
сосуд, в котором собирается газ, необходимо располагать вверх дном, или производить собирание методом вытеснения воды.
Рисунок 153. Заполнение водородом мыльных пузырей
Как обнаружить водород? Заполним пробирку водородом, держа ее вверх дном, по отношению к газоотводной трубке. Поднесем пробирку отверстием к пламени спиртовки – слышится характерный хлопок. Хлопок – это признак того, что в пробирке содержится водород. При поднесении пробирки к пламени водород вступает в реакцию с кислородом, содержащимся в воздухе. При малых количествах реакция кислорода и водорода сопровождается хлопком. Более подробно об этой реакции будет рассказано в следующем параграфе.
Получение водорода в промышленности

 Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
Одним из промышленных способов получения водорода является реакция разложения воды под действием электрического тока:
эл.ток
2H2O → 2H2 + O2.
Данный метод позволяет получить чистый
 водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.
водород и кислород. Процесс превращения химических веществ в другие вещества под действием электричества называется электролизом.


Проведем электролиз воды. В стакан наполненный водой, опустим металлические электроды. Поверх электродов опустим в стакан пробирки, заполненные водой. Подсоединим электроды к
Рисунок 154. Электролиз воды
источнику тока – батарейке. В пробирках наблюдается выделение газов – водорода и кислорода, которые вытесняют воду.
Наблюдая за процессом электролиза, можно заметить, что в одной из пробирок газа собирается в два раза больше, чем в другой. Проанализировав уравнение реакции электролиза воды, можно сделать вывод, в какой пробирке выделяется водород, а в какой – кислород. Попробуйте это сделать самостоятельно.
Существуют и другие способы получения водорода.
Железо-паровой метод долгое время широко применялся в промышленности. Через электрическую трубчатую печь проходит трубка из нержавеющей стали, заполненная
железными стружками. Через трубку с железными стружками пропускают водяной пар. При температуре около 800°С пары воды взаимодействуют с железом, образуя оксид Fe3O4 (железную окалину) и газообразный водород:
3Fe + 4Н2О = 4Н2 + Fe3O4.
Можно получить Н2, пропуская Н2О через слой раскаленного угля. При этом образуется смесь двух газов – СО и Н2 (водяной газ):
Н2О + С = CO + Н2.
В настоящее время водород получают взаимодействием углеводородов (в основном метана, СН4) с водяным паром или неполным окислением метана кислородом:






