1) Н2 ® НСl ® Н2; 3) Н2 ® Н2O ® Н2;
2) Сu ® СuО ® Сu; 4) H2SO4 ® Н2 ® НВr.
Объясните, почему водород считают экологически чистым топливом. Ответ подтвердите уравнением реакции.
Можно ли водород использовать в газовых плитах вместо природного газа? Аргументируйте свой ответ.
Приведите примеры кислот, молекулы которых обменивают на металл лишь один из своих атомов водорода.
Напишите уравнение реакции горения водорода в оксиде азота (IV), учитывая, что из шести молекул взятой смеси газов получается, не считая паров воды, одна молекула нового газа.
Найдите формулы кислот, имеющих следующий элементный состав: 1) Н – 2,1%, N – 29,8%, О – 68,1%;
2) Н – 2,4%, S – 39,1%, О – 58,5%;
3) Н – 3,7%, Р – 37,8%, О – 58,5%.
Летучее водородное соединение H2 X содержит 2,47% водорода по массе. Определите элемент Х.
Гидрид некоторого одновалентного металла содержит 1,16% водорода по массе. Установите формулу гидрида.
В каком случае выделится по массе больше водорода при взаимодействии с избытком разбавленной серной кислоты (H2SO4): а) 1 г железа; б) 1 г магния; в) 1 г цинка?
В каком случае получится больше водорода: при действии на избыток разбавленного раствора серной кислоты 30 г цинка или 20 г железа?
Сколько водорода по массе и объему образуется при разложении 100 г воды электрическим током; сколько граммов кислорода получится при этом?
В прежнее время водород получали на небольших установках при взаимодействии паров воды с раскаленным железом. Составьте уравнение реакции и вычислите, сколько килограммов оксида Fe3O4 получается при образовании 100 кг водорода.
Весьма выгодными промышленными способами получения водорода являются неполное сжигание природного газа метана СН4 или его взаимодействие с парами воды при высокой температуре. Расставьте коэффициенты в схемах реакций и определите, какой из процессов дает больше водорода на единицу массы исходного сырья – метана:
СН4 + O2 ® СО + Н2, CH4 + H2O ® CO + H2
Какая масса водорода требуется для получения 1 кг вольфрама из оксида вольфрама WO3?
Сколько граммов воды разложилось при действии электрического тока, если получилось: а) 2 г водорода; б) 2 г кислорода?
Какая масса воды образуется при взрыве смеси 2 г водорода и 12 г кислорода?
Какая масса водорода выделится при реакции с водой а) 39 г кальция; б) 40 г кальция?
 Блокнот эрудита
Блокнот эрудита
78. «Водородная чума» железа
Французский химик Сент-Клер-Девилль после многолетних наблюдений сделал в 1863 г. вывод о том, что железо и сталь «не держат водород, а становятся при определенных условиях проницаемыми для этого легчайшего элемента». Неожиданные разрывы стволов артиллерийских орудий, аварии химического оборудования для процесса синтеза аммиака NH3, где используется водород; наконец, некоторые авиационные катастрофы – все это следствия «водородной чумы» железа. Причина в том, что водород, особенно атомарный, активно реагирует с карбидами железа – в частности, с цементитом, упрочняющим стальные изделия:
Fe3C + 4Н0 = 3Fe + CH4.
При этом структура металла изменяется, а его прочность резко падает.
Другое объяснение этого явления заключается в том, что водород – вещество чрезвычайно агрессивное, особенно когда его атомы отщепляют свой единственный электрон и превращаются в положительно заряженные ионы – протоны Н+. В сто тысяч раз меньшие по размерам, чем любые другие катионы, протоны легко проникают в мельчайшие, едва зарождающиеся трещины и, соединяясь со свободными электронами, переходят снова в молекулярное состояние. Образовавшийся водород Н2 расширяет трещины подобно клиньям.
Надежное средство борьбы с этим вредным явлением найдено лишь в 30-х годах ХХ века: предложено легировать стали, работающие в контакте с водородом и его
соединениями, такими металлами, как титан Ti, ванадий V и молибден Мо. В этом случае в

§26. Практическая работа 5.
Взаимодействие водорода с оксидом меди (II)

Подготовка к практической работе
При выполнении практической работы строго выполняйте только те опыты, которые прописаны в инструкции или оговорены учителем. Обратите внимание, что данная работа предусматривает работу с хрупкой стеклянной посудой, нагревательными приборами. Перед началом работы повторите правила работы со стеклянной посудой и нагревательными приборами. Работу необходимо выполнять в застегнутом халате или фартуке.
Внимательно прослушайте инструктаж учителя о последовательности получения водорода и проверки его на чистоту!
Получение водорода и проверка его на чистоту

Рисунок 162. Прибор для получения газов
В прибор для получения газов на резиновую прокладку поместите несколько гранул цинка или алюминия. Прилейте раствор соляной или серной кислоты так, чтобы жидкость покрывала поверхность гранул металла. Соблюдайте особую осторожность при работе с кислотами! Что наблюдаете? Составьте уравнение реакции.
После начала выделения водорода наденьте на газоотводную трубку пробирку вверх дном и подождите несколько минут. Поднесите пробирку отверстием к пламени спиртовки. Если слышится звонкий хлопок, значит, еще не весь воздух вытеснен из прибора. Повторите
проверку на чистоту через 1–2 минуты. Если при поднесении отверстия пробирки к пламени хлопок слабый – значит водород чистый, его можно применять для дальнейшего эксперимента.
Взаимодействие водорода с оксидом меди (II)
Насыпьте в пробирку немного порошка оксида меди (II). Пробирку необходимо закрепить в лапке штатива так, чтобы ее отверстие было немного наклонено вниз (рисунок 161, параграф 25). Для чего это делается?
Поместите газоотводную трубку, по которой выходит водород, так, чтобы она была в непосредственной близости к порошку CuO. Нагревайте пробирку при помощи спиртовки. Что наблюдаете? Составьте уравнение реакции.
 Составьте отчет о проделанной работе по форме, указанной учителем. После проведения опытов приведите в порядок рабочее место.
Составьте отчет о проделанной работе по форме, указанной учителем. После проведения опытов приведите в порядок рабочее место.
Подведем итоги Вопросы, упражнения и задачи
Почему в работе с водородом необходимо соблюдать особую осторожность?
Можно ли поджигать водород, выделяющийся из газоотводной трубки, без проверки его на чистоту?
Можно ли собрать водород методом вытеснения воды?
В двух колбах, одинаковых по объему, находится водород и кислород. Колбы стоят на весах. В сторону какой колбы отклонится стрелка весов?
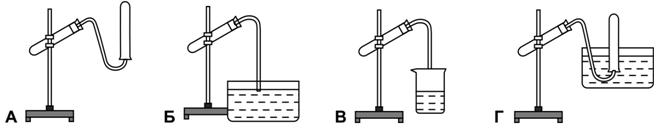
Рисунок 163. Различные способы собирания газов
 26.5. На рисунке 163 изображены различные способы собирания газов. Укажите, при помощи какого способа можно собрать водород, а при помощи какого – кислород.
26.5. На рисунке 163 изображены различные способы собирания газов. Укажите, при помощи какого способа можно собрать водород, а при помощи какого – кислород.
В трех колбах находятся кислород, водород и углекислый газ. Предложите способы распознавания этих газов.
В лаборатории получили водород и заполнили им фарфоровый сосуд. Сосуд плотно закупорили. Через некоторое время оказалось, что в сосуде водорода нет. Каким образом водород улетучился из сосуда?
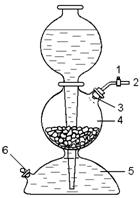
А) Какой прибор изображен на рисунке 164? С какой целью
он используется? Назовите детали 1 – 6 и объясните принцип Рисунок 164.
действия прибора.
Б) Какие вещества используются для работы с данным прибором? В) Как прибор заряжают, разряжают и как из него отбирают газ?
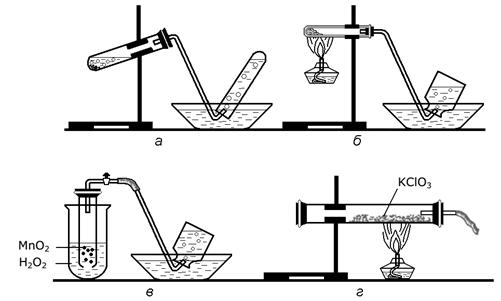
Рисунок 165.
А) Какие известные вам вещества можно получить, воспользовавшись приборами, изображенными на рисунке 165?
Б) Укажите исходные вещества, которые необходимо использовать в каждом отдельном случае. Приведите уравнения соответствующих реакций.
В) Назовите изображенный на рисунке прибор автоматического действия. Г) В каких из приведенных случаев а, б, в, г, получают бесцветный газ?
Д) Что будет происходить в каждой части прибора в, если экспериментатор перекроет кран?
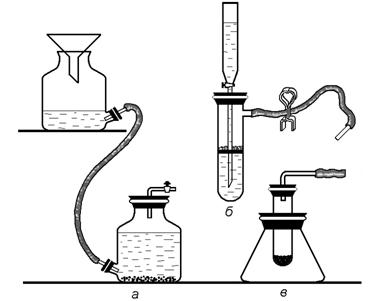
Рисунок 166.
А) Какие вещества можно получить, воспользовавшись приборами а, б, в, изображенными на рисунке 166? Напишите уравнения возможных реакций.
Б) Какие исходные вещества могут быть использованы в каждом отдельном случае? Напишите уравнения реакций между ними.
В) Каков принцип действия приборов а, б, в?
Г) Одинаков ли принцип действия приборов а, б, в? Опишите правила обращения с каждым из этих приборов.
Напишите уравнения следующих реакций:
1) Вольфрам получают действием водорода на оксид вольфрама (VI).
2) Гидрид лития реагирует с водой с образованием LiOH.
3) Магний реагирует с соляной кислотой с образованием MgCl2.
4) Водород реагирует с хлором Cl2.
5) Пероксид водорода разлагается с течением времени.
Относительная молекулярная масса соединения азота с водородом равна 32. Определите формулу этого соединения, если массовая доля азота в нем составляет 87,5%.
Относительная молекулярная масса соединения азота с водородом равна 43. Определите формулу этого соединения, если массовая доля азота в нем составляет 97,67%.
Выведите формулы кислот, воспользовавшись следующими данными об их составе: 1) 1,03% Н, 82,47% Br, 16,49% O 3) 0,77% Н, 62,01% Br, 37,21% O
2) 0,88% Н, 70,8% Br, 28,32% O 4) 0,69% Н, 55,17% Br, 44,14% O
Молекулярная масса оксида металлического элемента больше молекулярной массы его гидрида: а) в 3,75 раза; б) в 3,4 раза. Определите элемент, запишите формулы его оксида и гидрида, если валентность элемента в оксиде и гидриде одна и та же.
Во время разложения 9 г воды под действием электрического тока выделилось 8 г кислорода. Исходя из закона сохранения массы веществ, вычислите массу образовавшегося водорода.
Зная, что масса водорода, взятого объемом 1 л, равна 0,0892 г, рассчитайте объем водорода, который получится при разложении воды массой 72 г.
Какую массу водорода можно получить при взаимодействии 4,8 г магния с серной кислотой?
По схеме
| 33,6 г | х г | |||||
| Fe | + | Н2O | ® | Fe3O4 | + | Н2 |
составьте и решите задачу.
По схеме
| 48 кг | х кг | |||
| СН4 | ® | С | + | Н2 |

 конечно, смешан с воздухом, и произошел взрыв! Розье впоследствии писал: «Я думал, что у меня вылетят все зубы вместе с корнями». Тем не менее, он остался доволен результатами опыта, который едва не стоил ему жизни.
конечно, смешан с воздухом, и произошел взрыв! Розье впоследствии писал: «Я думал, что у меня вылетят все зубы вместе с корнями». Тем не менее, он остался доволен результатами опыта, который едва не стоил ему жизни.
82. Восстановление водородом оксидов металлов
Водород относится к числу слабых восстановителей. Однако, применяя избыток водорода и удаляя током водорода один из продуктов реакции – пары воды, можно восстановить даже довольно прочные оксиды.
При восстановлении прочных оксидов, например вольфрама, молибдена и особенно хрома, водород используется при восстановлении только частично и для получения металлов нужно пропускать над оксидом большие количества водорода. При восстановлении прочных оксидов нужно применять тщательно осушенный водород.
Такие прочные оксиды, как оксиды алюминия, кальция, марганца и т.д., практически восстановлению не поддаются. Как показывают расчеты, для получения 1 г указанных металлов над оксидом нужно пропустить миллиарды литров абсолютно сухого водорода.
Восстановление окислов многовалентных металлов проходит ступенчато. Например, двуокись марганца сначала легко восстанавливается до Мn2О3, затем до Мn3О4 и, наконец, до закиси МnО. Поскольку последний оксид весьма прочен, восстановление на этом и заканчивается.
Оксиды щелочных металлов, за исключением лития, также восстанавливаются водородом. Но получающиеся металлы возгоняются и при охлаждении частично окисляются парами воды, образующимися за счет восстановления оксидов.
В промышленности методом водородотермии (нагревания с водородом при нагревании) получают молибден, вольфрам, германий, галлий и индий. Восстановление проводят в трубчатых печах. Для получения металлов в чистом виде необходимо применять чистый водород и чистые оксиды, так как загрязнения обычно переходят в металл.
§27. Количество вещества

Что такое моль?
Характеристики физических тел, химических веществ описываются при помощи определенных параметров, которые имеют единицы измерения. Так, например, масса любого вещества в системе СИ измеряется в килограммах, а объем в литрах.
При составлении химических уравнений мы рассматриваем качественный состав химической реакции, то есть определяем, какие вещества вступают в химическую реакцию, и какие образуются. Например, реакция магния с серой описывается следующим химическим уравнением:
Mg + S = MgS.
Из уравнения реакции следует, что при взаимодействии одного атома магния с одним атомом серы образуется одна формульная единица сульфида магния MgS. Естественно, невозможно взвесить один или два атома. Это и не нужно, так как для определения количества
частиц, вступающих и образующихся в результате химических реакций, используется физическая величина – количество вещества.

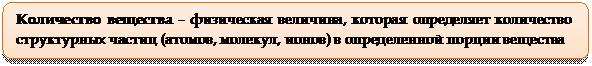
В системе СИ количество вещества допускается обозначать двумя символами: «n» (эн) и
«n» (ню). В химии более распространен второй символ, это греческая буква ню.
Любая физическая величина имеет единицу измерения. Единицей измерения количества вещества является моль. Сколько же частиц составляет 1 моль?


Термин «моль» происходит от латинского слова moles – количество, масса, счётное множество.
Слово «моль» не склоняется, если перед ним есть число, но склоняется, если числа нет.
Например: взято 2 моль водорода, определение моля.
Путем измерений было установлено, что в 12 г углерода, содержится 6,02 ·10 23 атомов углерода.
Следовательно, 1 моль любого вещества содержит одинаковое количество структурных частиц, а именно 6,02 · 10 23. Вода количеством вещества 1 моль содержит 6,02·1023 молекул воды. Железо количеством вещества 1 моль содержит 6,02∙1023 атомов железа и так далее.
Количество структурных частиц, содержащихся в 1 моль любого вещества, – величина постоянная, и названа в честь итальянского ученого Амадео Авогадро – постоянной (числом) Авогадро. Постоянную Авогадро обозначают символом N A.
При помощи современных методов исследований значение числа Авогадро периодически пересчитывается и корректируется. Так, например, последнее уточнение числа производилось в 2014 году. Полученное значение выглядит так: N A = 6,022 140 857·1023. В расчетах, как правило, используется округленное значение постоянной Авогадро, до сотых.
Какова единица измерения постоянной Авогадро? Данная величина показывает

 количество частиц N, содержащихся в 1 моль 𝜈. Можем записать:
количество частиц N, содержащихся в 1 моль 𝜈. Можем записать:
�
|
 Из формулы можно определить единицу измерения постоянной Авогадро: частиц
Из формулы можно определить единицу измерения постоянной Авогадро: частиц
Выразим из этой формулы количество структурных частиц N:
моль

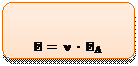
Количество вещества n измеряется в моль, а постоянная Авогадро имеет единицу
измерения
частиц

моль
частиц
 . Следовательно, моль×
. Следовательно, моль×
моль
= частиц. Так как моли при перемножении
сокращаются, следовательно, единица измерения количества частиц – частицы.

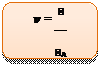
Выразим значение количества вещества:
 Подтвердим, что единица измерения количества вещества – моль. Разделим количество частиц, измеряемое в частицах, на постоянную Авогадро, измеряемую в частиц
Подтвердим, что единица измерения количества вещества – моль. Разделим количество частиц, измеряемое в частицах, на постоянную Авогадро, измеряемую в частиц
моль
 частицы частицы/моль
частицы частицы/моль
Частицы при делении сократились.
= моль.
Примеры решения задач
Рассмотрим примеры задач, в которых используются понятия моль, количество частиц, постоянная Авогадро.
Задача 1. Определите количество атомов, содержащихся в 2 моль фосфора.
 Дано:
Дано:
n(Р) = 2 моль N(P) –?
Решение:
Для нахождения количества частиц, в данном случае атомов фосфора, мы должны применить формулу:
N = n·NA
 N(P) = 2 моль·6,02·1023 атомов =
N(P) = 2 моль·6,02·1023 атомов =
моль
= 12,04·1023 атомов = 1,204·1024 атомов
Ответ: 1,204·1024 атомов фосфора
Дано:
Задача 2. Сколько атомов кислорода и водорода содержится в 3 моль воды?
 Решение:
Решение:
n(H2O) = 3 моль N(H) –?
N(O) –?
Из условия известно количество вещества воды. Найдем количество молекул N воды, содержащееся в 3 моль ее. Для этого воспользуемся формулой:
N = nNA
молекул
N(H2O) = 3 моль·6,02·1023 =
моль
= 18,06·1023 молекул = 1,806·1024 молекул
Каждая молекула воды состоит из двух атомов водорода и одного атомакислорода, следовательно, чтобы определить количество атомов водорода, нужно количество молекул воды умножить на два:
N(H) = 2·1,806·1024 = 3,612∙1024 атомов
Для определения количества атомов кислорода, количество молекул воды умножаем на единицу:
N(О) = 1·1,806·1024 = 1,806·1024 атомов
Ответ: N(Н) = 3,612·1024 атомов, N(О) = 1,806·1024 атомов.
Насколько велик 1 моль?
Число Авогадро, с точки зрения математики, – гигантское число! Но с точки зрения химии 1 моль какого либо вещества – это не так уж и много. Например, в обычном стеклянном стакане, в который помещается 200 г воды, содержится около 11 моль воды. Только вообразите, какое огромное число молекул содержится в одном стакане!
Существует масса способов, при помощи которых можно показать, насколько число Авогадро огромное! Вот некоторые из них:
·  в пустыне Сахара содержится менее трёх молей самых мелких песчинок;
в пустыне Сахара содержится менее трёх молей самых мелких песчинок;
· если футбольный мяч увеличить в N A раз по объёму, то в нём поместится земной шар;
· если же в N A раз увеличить диаметр мяча, то в нём поместится самая большая галактика, включающая сотни миллиардов звёзд;
· во Вселенной содержится примерно N A звёзд;
· если взять 1 моль красителя, пометить каким-либо способом все его молекулы, вылить в море и подождать, пока он равномерно распределится по всем морям и океанам до самого дна, то, зачерпнув в любом месте земного шара стакан воды, обязательно обнаружим в нём не один десяток «меченых» молекул.
Подведем итоги

Вопросы, упражнения и задачи
Рассчитайте количество вещества углекислого газа (СO2), если число его молекул равно 1) 1,204·1024; 2) 6,02·1022; 3) 3,01·1023; 4) 2,408·1023; 5) 7,214·1023.
Вычислите количество вещества кислорода (O2), если число его молекул равно 1) 1,505·1022; 2) 6,02·1024; 3) 2,107·1023; 4) 2,408·1022; 5) 4,816·1023.
Рассчитайте, сколько атомов углерода, водорода и кислорода содержится в
1) 1 моль глюкозы (C6H12O6);
2) 3 моль сахарозы (C12H22O11);
3) 2 моль уксусной кислоты (СН3СООН).
Вычислите число молекул в указанных ниже веществах, если их количество вещества равно:
1) 5 моль кислорода O2; 6) 0,25 моль бромоводорода HBr;
2) 2 моль серы S8; 7) 10 моль азота N2;
3) 1,5 моль аммиака NН3; 8) 0,7 моль озона О3;
4) 4 моль серной кислоты H2SO4; 9) 3 моль иодаI2;
5) 10 моль оксида углерода (II); 10) 2,25 моль глюкозыC6H12O6.
Рассчитайте, каково общее число атомов, содержащихся в
1) 1 моль оксида углерода (IV); 6) 0,05 моль воды;
2) 5 моль воды; 7) 0,42 моль глюкозы C6H12O6;
3) 2 моль оксида серы (VI); 8) 0,75 моль серной кислоты H2SO4;
4) 10 моль оксида бора (III); 9) смеси 1 моль воды и 1 моль аммиака NН3;
5) 2,5 моль оксида азота (V); 10) смеси 1 моль кислорода и 2 моль водорода.
Сколько молекул углекислого газа содержится в следующих порциях углекислого газа: 1) 0,25 моль; 2) 0,75 моль; 3) 1,25 моль; 4) 0,3 моль; 5) 1,2 моль?
Какое количество вещества составит:
1) 1,204·1022атомов меди; 6) 6,02·1024 атомов железа;
2) 3,01·1023 молекул водорода; 7) 2,107·1022молекул метана СН4;
3) 2,408∙1024 атомов цинка; 8) 4,816·1021 атомов азота;
4) 1,505∙1023 атомов углерода; 9) 3,01·1022 атомов фосфора;
5) 3,01·1022молекул озона; 10) 7,214·1023молекул воды.
Сколько атомов кислорода и фосфора содержится в
1) 0,5 моль его оксида, формула которого P4O10;
2) 0,1 моль его оксида, формула которого P4O6;
3) 1,5 моль ортофосфорной кислоты, формула которойН3PO4.
Вычислите количество атомов, если количество молекул:
1) 6,02·1024 молекул воды;
2) 1,803·1024 молекул азота (N2);
3) 1,204·1023 молекул серной кислоты (H2SO4);
4) 2,408·1023 молекул кислорода;
5) 3,01·1021молекул глюкозы C6H12O6.
Имеют ли смысл выражения: а) 1/5 моль; б) 1/5 молекулы; в) 1/5 массы молекулы?
Рассчитайте количество вещества NaCl, которое содержит столько же атомов натрия, сколько их содержится в Na2SO4 количеством 5 моль.
Выберите правильные утверждения. В порции аммиака NH3 количеством 2 моль содержатся: а) 12,04 1023 молекул аммиака; б) 12,04 1023 атомов азота; в) 6,02 1023 атомов азота; г) 12,04 1023 атомов водорода; д) 36,12 1023 атомов водорода.
В каком соотношении масс необходимо взять чистые вещества кремний и кислород, чтобы они прореагировали без остатка с образованием оксида кремния (IV)?
Вычислите количество вещества меди, которую можно восстановить водородом из оксида меди (II) массой 320 г.
Рассчитайте количество вещества и массу хлороводорода, полученного при взаимодействии водорода массой 20 кг с хлором.
Вычислите массу водорода, необходимого для полного восстановления железа из оксида железа (III), взятого массой 320 г. Определите объем водорода, если его плотность 0,0892 г/л.
Рассчитайте, какое количество вещества свинца можно восстановить водородом из оксида свинца (II) массой 446 г. Вычислите количество молекул воды, которая при этом образуется.
Для сжигания 1 моль метана требуется 2 моль кислорода. Какая масса кислорода и какая масса воздуха необходимы для осуществления этой реакции?
Определите, какое количество вещества оксида углерода (II) будет весить столько же, сколько весит 1 моль метана.
Водород, полученный в результате реакции цинка с соляной кислотой, использовали для восстановления 40 г оксида меди (II). Вычислите массу цинка, с помощью которого был получен водород.

1654 гг. Иностранцам было продано в тот период 520 бочек поташа (около 418 т). Поташ – карбонат калия K2СO3.
84. Каломель и сулема
Эти два вещества стали известны за 500–300 лет до н.э. Название «каломель» происходит от греческих слов «калон» и
«мелас» и означает «прекрасный черный». Действительно, если подействовать на белую блестящую массу кристалликов каломели, малорастворимых в воде, водным раствором аммиака, то она приобретает глубокий черный цвет из-за выделения мельчайших капелек ртути. Название «сулема», видимо, связано со словом «сублимация» (возгонка). В старину это вещество действительно получали, нагревая смесь сульфата ртути с поваренной солью, причем сулема возгонялась – переходила в газообразное состояние без плавления, а при охлаждении паров
Рисунок 168. Гэмфри Дэви (1778–1829)
 образовывала бесцветные прозрачные кристаллы лучистой формы. В воде сулема растворима, но практически не распадается на ионы. Сулема – один из сильнейших ядов, но издавна применялась как лекарство-антисептик. В 1733 г. во время правления в России императрицы Анны Иоанновны был издан приказ, запрещающий торговать сулемой «в рядах, лавках и торжках».
образовывала бесцветные прозрачные кристаллы лучистой формы. В воде сулема растворима, но практически не распадается на ионы. Сулема – один из сильнейших ядов, но издавна применялась как лекарство-антисептик. В 1733 г. во время правления в России императрицы Анны Иоанновны был издан приказ, запрещающий торговать сулемой «в рядах, лавках и торжках».
Каломель – это дихлорид диртути Hg2Cl2. При действии аммиака на это соединение протекает реакция:
Hg2Cl2 + 2NH3 = Hg(NH2)Cl¯ + Hg¯ + NH4Cl.
Сулема – дихлорид ртути HgCl2, раньше ее получали по реакции:
HgSO4 + 2NaCl = HgCl2¯ + Na2SO4.
85. ГЭМФРИ ДЭВИ (1778–1829)
Английский физик и химик Гемфри Дэви родился в городке Пензанс на юго-западе Англии (графство Корнуолл) в семье резчика по дереву. Уже в детстве Дэви удивил всех своими необычайными способностями. После смерти отца он стал учеником аптекаря; в аптеке он начал занятия химией. Дэви составил обширный план самообразования и упорно следовал ему. Уже в 17 лет он сделал свое первое открытие, обнаружив, что трение двух кусков льда друг о друга вызывает их плавление, на основании чего предположил, что теплота – это особый вид движения.






