Образец вещества массой 66 г содержит 9,03·1023 молекул. Вычислите его молярную массу и определите, какое это вещество: а) вода; б) углекислый газ; в) метан (СН4); г) оксид кальция (СаО).
Какие из утверждений являются правильными:
а) 1 моль железа и 1 моль алюминия содержат одинаковое количество атомов;
б) 1 моль водорода содержит столько молекул, сколько атомов содержится в 1 моль золота; в) 1 моль цинка и 1 моль кислорода содержат одинаковое количество атомов;
г) 1 моль водорода и 1 моль гелия имеют одинаковую массу;
д) 1 моль кислорода О2 и 1 моль озона O3 имеют одинаковую массу; е) 1 моль кремния и 1 моль азота имеют одинаковую массу?
Рассчитайте, масса какого из веществ – кислорода O2 или азота N2 – больше, если количество вещества одинаково и равно 3 моль.
В каком веществе содержится больше атомов: а) в 1 г углерода или 1 г фосфора; б) в 15 г серы или 10 г кислорода; в) в 16 г метана СН4 или 16 г кислорода?
Что имеет большую массу – 1000 молекул кислорода или 500 молекул углекислого газа?
Вычислить массу: а) 1 иона Вr⎺; б) 2 ионов NO2⎺; в) 3 ионов S2O32−.
Вычислить массу: а) 6,02·1022 формульных единиц СаСO3; б) 1,505·1020 формульных
единиц ВаСl2·2Н2O; в) 3,01·1010 формульных единиц CuSO4·5H2O.
Можно ли набрать в чайную ложку 6,02·1024 молекул воды?
Поместится ли в столовой ложке 6,02·1021 формульных единиц хлорида натрия?
Поместится ли в стакане объемом 250 см3 6,02·1022 молекул сахара С12Н22O11?
В какой массе оксида серы (IV) содержится столько молекул, сколько атомов содержится в 320 г меди?

 изучил химию и физику, овладел русским, английским, французским и итальянским языками. За всю свою жизнь Нобель получил около 350 патентов на изобретения – преимущественно взрывчатых веществ, порохов и детонаторов; в большинстве случаев изобретения были реализованы на созданных им заводах. В одной только Германии Нобель построил 23 динамитных завода.
изучил химию и физику, овладел русским, английским, французским и итальянским языками. За всю свою жизнь Нобель получил около 350 патентов на изобретения – преимущественно взрывчатых веществ, порохов и детонаторов; в большинстве случаев изобретения были реализованы на созданных им заводах. В одной только Германии Нобель построил 23 динамитных завода.
В 1864 г. на Геленборгском заводе недалеко от Стокгольма погиб от взрыва нитроглицерина младший брат Альфреда Эмиль-Оскар. Но это не остановило Нобеля: он продолжал строить нитроглицериновые заводы в разных местах Европы. С 1890 г. Нобель жил на вилле «Мое гнездо» в Сан-Ремо (Италия), где была оборудована прекрасная химическая лаборатория по синтезу и изучению взрывчатых веществ. К тому времени уже 93 завода производили нитроглицерин, динамит, бездымные пороха и другие виды взрывчатки.
Весь бухгалтерский учет в своей «динамитной империи» Нобель вел сам, что приводило к постоянным его переездам. Поэтому он и слыл «европейским бродягой».
Альфред Нобель был угрюмым и нелюдимым циником. В нем сочетались, казалось бы, несовместимые черты характера: удивительная удачливость коммерсанта и человеческая беспомощность, страсть к наживе и безразличие к почестям и наградам, миролюбие и воинственность, подавленность, меланхолия и яростная увлеченность научными исследованиями. Сам он писал о себе так: «Главные достоинства: всегда держит ногти в чистоте и никому никогда не бывал в тягость. Главные недостатки: не имеет семьи, обладает плохим характером, слабым здоровьем и пищеварением». А. Нобель умер в 1896 г. в своей лаборатории в Сан-Ремо и весь свой капитал – более 33 млн. шведских крон, или 9 млн. долларов, – завещал всему человечеству таким образом:
«Я, нижеподписавшийся, Альфред-Бернард Нобель, после размышлений настоящим объявляю мое окончательное завещание относительно имущества, которое я нажил к моменту моей смерти.
Все мое остающееся реализуемое имущество необходимо распределить следующим образом: капитал мои душеприказчики должны превратить в ценные бумаги и создать фонд, проценты с которого будут ежегодно распределяться в виде премий тем, кто в течение прошедшего года принес наибольшую пользу человечеству. Указанные проценты необходимо разделить на пять равных частей, которые предназначаются: одна часть тому, кто сделает наиболее важное открытие или изобретение в области физики; другая – тому, кто сделает наиболее важное открытие или усовершенствование в области химии; третья – тому, кто сделает наиболее важное открытие в области физиологии или медицины; четвертая – тому, кто создаст наиболее выдающееся произведение идеалистического направления; пятая – тому, кто внес наиболее существенный вклад в сплочение наций, уничтожение рабства или снижение численности существующих армий и содействие проведению мирных конгрессов. Премии физикам и химикам будут присуждаться Шведской академией наук, по физиологии или медицине – Королевским институтом в Стокгольме, по литературе – Академией в Стокгольме, борцам за мир – комитетом из пяти человек, избираемым норвежским Стортингом. Мое особое желание заключается в том, чтобы при присуждении премий не принималась во внимание национальность кандидатов, чтобы премию получали наиболее достойные, независимо от того, скандинавы они или нет.
Это завещание является последним и окончательным, оно имеет законную силу и отвергает все мои предыдущие завещания, если таковые обнаружатся после моей смерти.
Наконец, последнее мое настоятельное желание состоит в том, чтобы после моей кончины компетентный врач твердо установил факт смерти, и лишь после этого труп должен быть сожжен.
Париж, 27 ноября 1895 г. Альфред-Бернард Нобель».
88.  Нобелевская премия и ее лауреаты-химики
Нобелевская премия и ее лауреаты-химики
Нобелевские премии по химии были введены в 1901 г. по завещанию Альфреда Нобеля, который весь свой капитал в виде процентов с него завещал распределять «как премии тем, кто в течение прошедшего года принес наибольшую пользу человечеству». Если в 1901 г. первые нобелевские лауреаты получали чек на сумму 150800 шведских крон (42 тыс. долларов), то в 1974 г. – уже около 600000 шведских крон (167 тыс. долларов), а в 2016 г. – 1,1 млн. долларов.
Не были удостоены Нобелевской премии Менделеев, Бертло, Гиббс, Ле-Шателье, Канниццаро, Зелинский. Формальной причиной было то, что, согласно Уставу о Нобелевских премиях, ими награждаются только работы, выполненные и получившие признание в году присуждения премии, или старые работы, важность которых доказана в текущем году. Открытия перечисленных химиков были сделаны и оценены учеными задолго до 1901 г.
Сообщения о новых лауреатах публикуются обычно 21 октября – в день рождения Нобеля, а официальная церемония вручения премии происходит 10 декабря, в день его смерти. Этот день отмечается в Швеции как День Нобеля. В среднем возраст нобелевских лауреатов по химии составляет примерно 39 лет.
Первым лауреатом Нобелевской премии по химии в 1901 году стал Якоб Вант-Гофф. С тех пор 162 человека получили 163 премии по химии.
89. Свинец – Plumbum, Pb (82)
Свинец – металл, который, подобно меди, сурьме и олову, известен с глубокой древности.
Как ни странно, но впервые широкое применение свинец нашел там, где ныне он совершенно не употребляется, – при изготовлении водопроводных труб. Один из наиболее мягких металлов, хорошо прокатывающийся в листы, свинец уже в древности использовался для устройства водопроводных труб.
Трубы римского водопровода, выстроенного рабами, были свинцовыми. Очевидно, поэтому такой короткой и была средняя продолжительность жизни римлян. Все растворимые соединения свинца являются ядовитыми. На устойчивость свинца к воде оказывает большое влияние содержащийся в ней углекислый газ. При малых количествах он образует на поверхности свинца соединение, не растворимое в воде (углекислый свинец), и тем способствует устойчивости свинца. Если же содержание углекислого газа в воде сравнительно велико, а так именно было с водой, питавшей древний Рим, то углекислый газ, реагируя со свинцом, образует кислый углекислый свинец, который хорошо растворяется в воде. Поступая в организм в малых порциях, свинец задерживается в нем и, постепенно замещая кальций, входящий в состав костей, вызывает хроническое отравление.
В чистом виде свинец представляет синевато-серый, тяжелый (плотность 11,3), мягкий металл, способный под давлением (200 кг на 1 см2) течь сквозь тонкие отверстия. Известность свинца с глубокой древности сделала его материалом, нашедшим многочисленное применение в различных областях человеческой деятельности. В средневековье большие количества свинца расходовались в Европе для покрытия крыш замков, дворцов и храмов. Между прочим, известная в Венеции тюрьма для «государственных преступников», соединенная «Мостом вздохов» (замечательным произведением раннего средневековья – Дворцом дожей, имела на чердаке камеры под свинцовой крышей. Зимой под этой крышей
«преступники» стыли от холода, летом – изнывали от жары. С изобретением огнестрельного оружия большие количества свинца стали расходоваться на изготовление пуль для ружей и пистолетов, картечи для артиллерии.
В настоящее время можно перечислить очень много областей применения свинца: производство аккумуляторов, освинцовка внутренней поверхности химической аппаратуры, трубы для перекачки кислот, сточные трубы химических лабораторий, военная техника, производство электрических кабелей, свинцового стекла – хрусталя, глазурей – все это требует много чистого свинца.
Книги, журналы, газеты изготовляются руками людей, которым приходится работать с типографским металлом, содержащим свинец. Свинцовая пыль ядовита. Вот почему в нашей стране производства, где употребляются свинец или его соединения, являются объектом пристального внимания врачей-гигиенистов. Максимальное содержание свинца в воздухе на промышленных предприятиях не должно превышать 0,00001 мг на литр. Там, где человек имеет дело со свинцом, применяются специальные меры предосторожности и действует очень строгое законодательство по охране труда.
Металлический свинец – очень хорошая защита от всех видов радиоактивного излучения и рентгеновских лучей. Попробуйте взвесить фартук врача-рентгенолога или его перчатки, и вас поразит их тяжесть. В резину фартука и защитных рукавиц введен свинец, он задерживает рентгеновские лучи и предохраняет организм рентгенологов от их губительного действия.
Металлический свинец
Рисунок 178. Слитки свинца Рисунок 179. Древняя
свинцовая печать
Рисунок 180. Свинцовые пули
 Защищает от радиоактивного излучения и стекло, содержащее окислы свинца. Подобное свинцовое стекло позволяет управлять обработкой радиоактивных материалов с помощью «механической руки» – манипулятора. Иллюминатор из свинцового стекла на атомном центре в Бухаресте имеет толщину одного метра и весит более полутора тонн.
Защищает от радиоактивного излучения и стекло, содержащее окислы свинца. Подобное свинцовое стекло позволяет управлять обработкой радиоактивных материалов с помощью «механической руки» – манипулятора. Иллюминатор из свинцового стекла на атомном центре в Бухаресте имеет толщину одного метра и весит более полутора тонн.
В природе свинца сравнительно немного – 0,0001% от общего числа атомов земной коры. Однако содержащие свинец минералы – галенит (свинцовый блеск или сернистый свинец), церрусит (углекислый свинец), англезит (сернокислый свинец) и др. – встречаются во многих странах. У нас месторождения свинца встречаются в Казахстане, на Урале, в Сибири и др. Свинец всегда находится в смеси с другими металлами.
Сравнительная легкость получения свинца из руд объясняется низкой температурой плавления свинца (всего 327°С). Из важнейшей его руды – галенита – свинец легко отделяется от серы. Достаточно галенит в смеси с углем обжечь на воздухе, чтобы выплавить чистый свинец.
Немаловажную роль играют и различные соединения свинца. Так, некоторые окислы свинца, а также его соли используются в качестве отличных красок для ускорения высыхания олифы. Растворимые соединения свинца применяются в медицине как вяжущие, болеутоляющие и противовоспалительные средства. Свинцовая примочка известна многим. Иногда ее называют «свинцовым сахаром» за сладковатый вкус. Не следует забывать о большой ядовитости свинцового сахара.

§29. Молярный объем газов

Закон Авогадро
В 1811 году итальянским ученым Амедео Авогадро была сформулирована гипотеза о том, что в равных объемах газов при одинаковых значениях давления и температуры содержится одинаковое число частиц.
Гипотеза была подтверждена множеством экспериментальных исследований. Впоследствии предположение Авогадро стало законом Авогадро. Закон Авогадро формулируется следующим образом:


Нормальными условиями считают температуру 0°С и нормальное атмосферное давление. В системе СИ единицей давления является паскаль (Па). Нормальное атмосферное давление равно 101,3 кПа. В тексте нормальные условия принято обозначать сокращенно:
«н.у.».
Закон Авогадро имеет несколько следствий.
Первое следствие: при нормальных условиях 1 моль любого газа содержит одинаковое количество частиц, то есть имеет один и тот же объем.


Второе следствие: при н.у. 1 моль любого газа занимает объем 22,4 л.
Объем 1 моль любого газа при нормальных условиях, называют молярным объемом. Молярный объем газа обозначают символом V m. С учетом того, что 1 моль любого газа имеет объем 22,4 литра при н.у., то молярный объем газа определяется как отношение этих величин:

 V
V
V m =
Л
= 22,4
Моль
 Путем простейших арифметических действий выразим формулы для расчета объема газа и количества вещества:
Путем простейших арифметических действий выразим формулы для расчета объема газа и количества вещества:

Путем комбинирования формул, по которым можно рассчитать количество вещества, можно пользоваться не несколькими формулами, а одной. Это более логично, и требует меньше времени на расчеты. Например, если известна масса вещества, а необходимо рассчитать его объем, расчетные формулы можно скомбинировать следующим образом:
m m

 n = M; V = n ∙ V m ® V = M
n = M; V = n ∙ V m ® V = M
• V m.
Так же можно комбинировать расчетные формулы для нахождения количества
вещества по массе и объему:
M V

 n =; n = ®
n =; n = ®
M V m
M V

 = .
= .
M V m
Дано:
Примеры решения задач
Задача 1. Определите, какой объем кислорода займет его порция массой 9,8 г.
 Решение:
Решение:
m(O2) = 9,8 г V(O2) –?
Начнем решать задачу с конца. Определим формулу, по которой вычислим объем кислорода:
V = nVm
Отсюда нам известен только молярный объем Vm. Как найти количество вещества, если известна масса? Очевидно, по формуле:
m
 n =
n =
M
Определим молярную массу кислорода, для этого рассчитаем его
молекулярную массу: Mr(O2) = 2Ar(O) = 16·2 = 32
M(O2) = 32 г/моль
Подставим значение молярной массы и массы кислорода в формулу:
m 9,8 г

 ν(O2) = M = 32 г/моль = 0,3 моль
ν(O2) = M = 32 г/моль = 0,3 моль
Теперь рассчитаем объем:
л
 V(O2) = n∙Vm = 0,3 моль·22,4 моль = 6,72 л
V(O2) = n∙Vm = 0,3 моль·22,4 моль = 6,72 л
Задачу можно решить проще. Для этого необходимо скомбинировать
расчетные формулы:

 V = 9,8 г
V = 9,8 г
m
 M ∙ Vm
M ∙ Vm
л
Ответ: 6,72 л
V =
32 г/моль
∙ 22,4

моль
= 6,72 л
Дано:
Задача 2. Какой объем (при н.у.) займут 2,41·1025 молекул хлора?
 Решение:
Решение:
N(Cl2)= 2,41·1025 V(Cl2) –?
Для нахождения объема мы должны использовать формулу
V = nVm
Для нахождения количества вещества хлора воспользуемся формулой
 ν = N
ν = N
NA
Скомбинируем эти формулы. Подставим в первую формулу количество вещества из второй формулы
N

|
A
25
 V = 2,41·10
V = 2,41·10
молекул ·22,4 л
= 0,4·102 моль·22,4 л
= 896,7 л
 6,02·1023молекул
6,02·1023молекул
моль

моль

моль
Дано:
Ответ: 896,7 л
Задача 3. Определите молярную массу газа, 2,24 л которого (н.у.) имеют массу 1,6 г.
 Решение:
Решение:
V(газа) = 2,24 л
Для решения задачи воспользуемся комбинированием формул
m(газа) = 1,6 г
m V
n =; n =
mV
® =
 М(газа) –?
М(газа) –?
M Vm
M Vm
mV
=
M Vm
® M =
m∙Vm = V
1,6 г ·22,4 л/моль
2,24 л
= 16 г/моль
Ответ: 16 г/моль.
Подведем итоги

Вопросы, упражнения и задачи
Какой объем займут: а) 0,2 моль водорода; б) 0,25 моль азота; в) 0,225 моль фтора? Молекулы всех газов – двухатомны!
Жидкий кислород перевозят в больших стальных баллонах, вмещающих 3,2 т кислорода. Какой объем займет эта масса газообразного кислорода при нормальных условиях?
В мире производится около 30 млн. т водорода. Какой объем это составляет: а) в литрах; б) в м3?
Сколько молекул содержится в 0,75 л (н.у.) углекислого газа?
Знаменитый английский химик У. Рамзай в конце XIX века выделил из воздуха образец гелия объемом 20 см3. Определите массу данного образца гелия.
Резервуар объемом 50 м3 вмещает 25 т жидкого аммиака NH3. Во сколько раз больше должен быть объем резервуара, чтобы вмещать ту же массу аммиака при нормальных условиях?
В сосуде находится водород. Определите количество атомов водорода в сосуде, если объем водорода в сосуде в два раза меньше объема 4 моль кислорода.
Какой объем займет смесь газов следующего состава: 2,35 моль кислорода, 0,656 моль азота и 1,31 моль углекислого газа?
На чашках весов находятся колбы с хлором и углекислым газом объемом по 0,5 л. В сторону какой колбы отклонится стрелка весов при взвешивании?
Проведите необходимые расчеты и выберите верное утверждение. В пропане (С3Н8) объемом 3,36 л содержится столько молекул пропана, сколько:
а) молекул метана (СН4) в порции массой 3,36 г; б) молекул кислорода в 3,36 л кислорода;
в) атомов кислорода в 1,68 л кислорода.
Вычислите массу кислорода, взятого объемом 0,2 м3 (1 м3 = 1000 л).
Вычислите число молекул сероводорода, если его объем равен 112 л.
Рассчитайте, одинаковые ли объемы будут занимать 3 моль оксида углерода (II) и 3 моль оксида углерода (ІV) (н.у.).
Рассчитайте, одинаковые ли объемы будут занимать 2 моль пропана и 5,5 моль метана (н.у.).
В одном сосуде находится 5,6 л хлора и 33,6 л хлороводорода. Определите массу сосуда со смесью газов.
Вычислите объем смеси, содержащей оксид азота (IV) массой 23 г и кислород массой 4 г.
Масса газа объемом 4,48 л составляет 8,8 г. Определите молярную массу этого газа.
Определите молярную массу газа, если этот газ массой 110 г занимает объем 56 л (н.у.).
Заполните в таблице клеточки со знаками вопроса:
| № | Вещество | Vm, л/моль | М, г/моль | n, моль | V, л | m, г | N |
| 1. | Сl2 | ? | ? | ? | 6,72 л | ? | ? |
| 2. | СН4 | ? | ? | 5 моль | ? | ? | ? |
| 3. | SO2 | ? | ? | ? | ? | 12,8 г | ? |
| 4. | NH3 | ? | ? | ? | ? | ? | 0,6·1023 молекул |
| 5. | ? | ? | ? | ? | 112 л | 1,60 г | ? |
Какие из перечисленных веществ при одинаковых условиях в равных объемах содержат одинаковое число атомов: водород, водяной пар, кислород, оксид азота (IV), озон, сероводород, хлор?
Определите, сколько
1) атомов углерода и кислорода содержится в 2 л углекислого газа
2) молекул хлороводорода содержат 672 л этого газа (н.у.).
3) атомов хлора и кислорода содержится в 11,2 л паров оксида хлора (VII).
4) атомов азота и кислорода содержится в 67,2 л оксида азота (ІV) (н.у.).
5) атомов азота и водорода содержится в 44,8 л аммиака (н.у.).
Рассчитайте, в каких объемных отношениях находятся газы в смеси углекислого газа массой 11 г, кислорода массой 24 г и азота массой 14 г.
Составьте предложения по следующим записям:
1) Vm = 22,4 л/моль; 4) N(О2) = 7,8·1023 молекул;
2) V(SО2) = 78 л; 5) N(H) = 2,4·1023 атомов;
3) M(NH3) = 17 г/моль; 6) n(О2) = 5 моль.
Составьте и решите задачи по схемам:
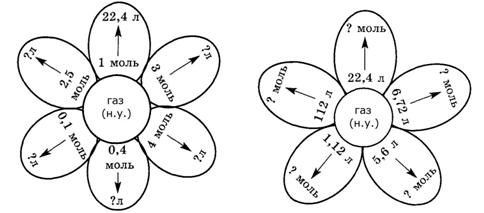
Составьте и решите задачи, если газ:
а) кислород; б) оксид серы (IV):

 Блокнот эрудита
Блокнот эрудита
90. «ХИМИЧЕСКАЯ ГРЕЛКА»
Известно несколько видов «обыкновенных химических грелок». Устройство их очень простое: обычно это два пакета (маленький и большой) из водонепроницаемого и химически стойкого материала (пленки, ткани). Внутри маленького пакета – вещество или смесь веществ. Чтобы грелка начала работать, сюда надо добавить немного воды и перемешать содержимое пакета. Потом пакет закрывают, вставляют в большой и еще раз тщательно закупоривают; теперь грелкой можно пользоваться. Одна из самых простых химических грелок содержит оксид кальция СаО (негашеную известь), который взаимодействует с водой с образованием гидроксида кальция:
СаО + Н2О = Са(ОН)2.
Реакция сопровождается тепловыделением. Температура грелки может достигать 70– 80°С. В химической грелке другого вида используют взаимодействие металлов (в виде стружки) и солей. Совершенно сухую смесь железной (Fe) или алюминиевой (Al) стружки с солями меди (например, CuCl2) можно хранить довольно долго, а при добавлении воды температура сразу же повышается почти до 100°С за счет реакции:
Fe + CuCl2 = FeCl2 + Сu.
При этом грелка, в которой хлорид меди CuCl2 превращается в хлорид железа FeCl2, сохраняет тепло около десяти часов.
91. ДВАЖДЫ КАВАЛЕР ОРДЕНА СВЯТОЙ АННЫ ЮСТУС ФОН ЛИБИХ
Юстус фон Либих (1803–1873), немецкий профессор органической химии, был выдающимся химиком своего времени. Большая часть его работ посвящена изучению вопросов питания растений и рациональному применению удобрений. За услуги, оказанные земледелию России, ему были вручены два ордена Святой Анны, а за повышение
урожайности сельскохозяйственных культур в Германии он получил звание барона, давшее ему право на приставку «фон». За работы Либиха по применению минеральных удобрений предлагались баснословные гонорары. Либих заложил основы химии пищевых продуктов. Он родоначальник технологии производства мясного экстракта, дожившего до наших дней под именем «бульонных кубиков». Либих выдвинул первую теорию катализа и теорию основности органических кислот, разработал методы анализа органических соединений.
Он родился в семье аптекаря в г. Дармштадте, столице Гессенского герцогства. Из семьи правителей этого герцогства происходила и российская императрица Мария Александровна, супруга Александра II, основательница российского «Красного креста».
В возрасте 21 года Либих был назначен профессором Гессенского университета по рекомендациям двух выдающихся ученых – Гей-Люссака и Александра-Фрейхерра-Вильгельма фон Гумбольдта (1769–1859) – немецкого физика, географа и путешественника.
Юстус Либих в возрасте 23 лет женился на
девятнадцатилетней Генриетте Мольденхауер, дочери
дармштадтского чиновника. Генриетта, или, по- домашнему, Йетхен, была очень красива, а главное –
Рисунок 184. Юстус фон Либих
(1803–1873)
 добра. Ей нравились галантные манеры молодого черноволосого профессора, его веселый характер и целеустремленная натура. Брак их оказался счастливым. У Генриетты и Юстуса родилось пятеро детей. В обращении с ними Либих был строг, редко позволял себе шутки, хотя и очень любил детей. Всю жизнь Либих относился к жене с неизменной любовью. Либих, по его собственному утверждению, никогда не читал стихов и не любил романы. Театры и концерты он посещал редко, но любил прогулки и путешествия.
добра. Ей нравились галантные манеры молодого черноволосого профессора, его веселый характер и целеустремленная натура. Брак их оказался счастливым. У Генриетты и Юстуса родилось пятеро детей. В обращении с ними Либих был строг, редко позволял себе шутки, хотя и очень любил детей. Всю жизнь Либих относился к жене с неизменной любовью. Либих, по его собственному утверждению, никогда не читал стихов и не любил романы. Театры и концерты он посещал редко, но любил прогулки и путешествия.
У Либиха был воинственный и надменный нрав. Это был человек, с которым, по немецкой поговорке, «вишни есть вместе не сядешь»: по-русски это означает примерно
«палец в рот не клади». Азартный полемист, Либих в пылу борьбы не разбирал, где друзья, где враги.
Неистовая научная работа и бескомпромиссная борьба с консерваторами от агрохимии привели к тому, что уже в 50 лет Либих был человеком с разрушенным здоровьем, страдавшим бессонницей и головными болями. Весной 1870 г. Либих серьезно заболел и даже заказал себе гроб, но, поправившись, велел спрятать его в чулан... В апреле 1873 г. во время отдыха в саду Либих простудился; простуда перешла в воспаление легких, и через две недели он скончался. Генриетта пережила своего супруга на восемь лет.






