ХИМИЧЕСКИХ РЕАКЦИЙ
При решении задач этого раздела см. табл. 5-7.
Направление, в котором самопроизвольно могут протекать реакции, определяется совместным действием двух тенденций:
1) стремлением системы к переходу в состояние с наименьшей энергией;
2) стремлением к наиболее вероятному состоянию.
Первая тенденция характеризуется величиной ∆Н, т.е. самопроизвольно протекают реакции, сопровождающиеся уменьшением энтальпии (∆Н < 0). Действительно, все экзотермические реакции протекают самопроизвольно.
Однако известно достаточно большое число самопроизвольных эндотермических реакций, протекание которых противоречит энергетическому принципу, и может быть обусловлено только стремлением к системы к наиболее вероятному состоянию. В термодинамике доказывается, что наиболее вероятным является наиболее неупорядоченное состояние, связанное с хаотичным движением частиц (молекул, ионов, атомов). Мерой наиболее вероятного (неупорядоченного) состояния системы является термодинамическая функция состояния энтропия S. В изолированных системах процессы протекают самопроизвольно в сторону увеличения энтропии.
Таким образом, с одной стороны, система стремится к уменьшению энтальпии, т.е. к упорядочению,с другой стороны, система стремится к росту энтропии, к беспорядку.
Энтропия возрастает при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное; при растворении веществ; при химических реакциях, приводящих к увеличению числа частиц, особенно в газообразном состоянии. Поскольку энтропия является функцией состояния, ее изменение (DS) зависит только от начального (S1) и конечного (S2) состояний и не зависит от пути процесса:
DS=S2-S1.
Если S2>S1, то DS > 0. Если S2<S1 то DS < 0.
Для химической реакции: DSхр = SS0прод - SS0исх.
Энтропия выражается в Дж/(моль.К).
Очевидно, что, характеризуя две противоположные тенденции процесса, энтальпия или энтропия, взятые по отдельности, не могут служить критерием его самопроизвольного протекания. Функцией состояния, учитывающей обе тенденции, является энергия Гиббса G:
∆ G = ∆ H – T ∆ S (1)
или ∆H = ∆G + T ∆S. (2)
Из уравнения (2) следует, что энтальпия химической реакции состоит из двух слагаемых. Первое - ∆ G – представляет собой ту часть энергии, которая может быть превращена в работу. Поэтому энергию Гиббса иногда называют свободной энергией.
Второе слагаемое – это та часть энергии, которую невозможно превратить в работу. Произведение T·∆S называют рассеянной или связанной энергией, она рассеивается в окружающую среду в виде теплоты.
Энергия Гиббса при постоянном давлении и температуре служит критерием самопроизвольного протекания любого процесса, в том числе и химической реакции. Самопроизвольно протекающие процессы идут в сторону уменьшения потенциала и, в частности, в сторону уменьшения DG. Если DG < 0, процесс принципиально осуществим; если DG > О, процесс самопроизвольно проходить не может. Чем меньше DG, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия, при котором DG = 0 и DH= T·DS.
Химическая реакция принципиально возможна, если энергия Гиббса уменьшается ∆ G<0. Если ∆G>0, реакция не может протекать самопроизвольно в прямом направлении. Это неравенство свидетельствует о термодинамической возможности самопроизвольного протекания обратной реакции.
Из соотношения (1) видно, что самопроизвольно могут протекать и процессы, для которых DH>0 (эндотермические). Это возможно, когда ΔS > 0, но│∆H │ < │ T∆S│, например, при высоких температурах, и тогда DG < 0.
С другой стороны, экзотермические реакции (DH<0) самопроизвольно не протекают, если при DS<0 │∆H│> │ T∆S │, следовательно DG>0. Эндотермические реакции, сопровождающиеся уменьшением энтропии, в принципе невозможны. Протекание экзотермических реакций с увеличением энтропии термодинамически возможно при любых температурах.
Энергия Гиббса является функцией состояния, поэтому изменение энергии Гиббса в результате протекания химической реакции при стандартных условиях вычисляется по формуле
DGхр.= SDG  - SDG
- SDG  , (3)
, (3)
а при любых других температурах – по уравнению (1).
Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
 СН4(г) + СО2 2СО(г) + 2H2(r)
СН4(г) + СО2 2СО(г) + 2H2(r)
Решение. Вычислим DG  прямой реакции. Значения DG
прямой реакции. Значения DG  соответствующих веществ приведены в табл. 6. Зная, что DG есть функция состояния и что DG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим DG
соответствующих веществ приведены в табл. 6. Зная, что DG есть функция состояния и что DG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим DG  процесса:
процесса:
DG  = 2(-137,27) + 2(0) - (-50,79 - 394,38) = + 170,63 кДж.
= 2(-137,27) + 2(0) - (-50,79 - 394,38) = + 170,63 кДж.
То, что DG  > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и Р = 1,013∙105 Па.
> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298 К и Р = 1,013∙105 Па.
Таблица 6. Стандартные энергии Гиббса образования DG некоторых веществ
| Вещество | Состояние | DG  ,кДж/моль ,кДж/моль
| Вещество | Состояние | DG  , кДж/моль , кДж/моль
|
| ВаСО3 | к | -1138,8 | ZnO | к | -318,2 |
| СаСОз | к | -1128,75 | FеО | к | -244,3 |
| Fе304 | к | -1014,2 | Н2О | ж | -237,19 |
| ВеСОз | к | -944,75 | Н2О | г | -228,59 |
| СаО | к | -604,2 | PbO2 | к | -219,0 |
| ВеО | к | -581,61 | СО | г | -137,27 |
| NaF | к | -541,0 | СH4 | г | -50,79 |
| ВаО | к | -528,4 | NO2 | г | +51,84 |
| СО2 | г | -394,38 | NO | г | +86,69 |
| NaCI | к | -384,03 | С2Н2 | г | +209,20 |
Таблица 7. Стандартные абсолютные энтропии DS0298
некоторых веществ
| Вещество | Состояние | DS  ,Дж/(моль.К) ,Дж/(моль.К)
| Вещество | Состояние | DS  ,Дж/(моль.К) ,Дж/(моль.К)
|
| С | Алмаз | 2,44 | H20 | г | 188,72 |
| С | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Ti | к | 30,7 | CO | г | 197,91 |
| S | Ромб. | 31,9 | С2Н2 | г | 200,82 |
| ТO2 | к | 50,3 | О2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2О | ж | 69,94 | NO | г | 210,20 |
| Fе2О3 | к | 89,96 | СO2 | г | 213,65 |
| NH4C1 | к | 94,5 | C2H4 | г | 219,45 |
| СНзОН | ж | 126,8 | Cl2 | г | 222,95 |
| H2 | г | 130,59 | NO2 | г | 240,46 |
| Fe3О4 | к | 146.4 | РС1з | г | 311,66 |
| СH4 | г | 186,19 | PCl5 | г | 352,71 |
| HC1 | г | 186,68 |
Пример З. На основании стандартных теплот образования (табл. 5) и абсолютных стандартных энтропий веществ (табл. 7) вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО(г) + Н2О(ж) = СОз(г) + Н2(г).
Решение. DG° = DH° - TDS°; DH и DS - функции состояния, поэтому
DH0х.р. = SDH0прод. - SDH0исх.;
DS0х.р. = SS0прод. - SS0исх..
DH0х.р. = (-393,51 + 0) - (-110,52 - 285,84) = +2,85 кДж;
DS0х.р. = (213,65+130,59) -(197,91+69,94) =+76,39 = 0,07639 кДж/(моль∙К);
DG0 = +2,85 – 298 - 0,07639 = -19,91 кДж.
Пример 4. Реакция восстановления Fе2О3 водородом протекает по уравнению
Fе2О3(к)+ ЗН2(г) = 2Fе(к) + ЗН2О(г); DH= +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии D S = 0,1387 кДж/(моль.К)? При какой температуре начнется восстановление Fе2Оз?
Решение. Вычисляем D G° реакции:
DG =DH-TDS= 96,61 - 298 . 0,1387 = +55,28 кДж.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG = 0:
DH = TDS; T= 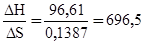 К.
К.
Следовательно, при температуре Т = 696,5 К (423,50С) начнется реакция восстановления Fе2О3. Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите DH0, DS0, DG0, - реакции, протекающей по уравнению
Fе2Оз(к) + З С = 2 Fe + З СО.
Возможна ли реакция восстановления Fе2Оз углеродом при 500 и 1000 К?
Решение. DH0х.р. и DS0х.р. находим из соотношений (1)и (2):
DH0х.р. = [3(-110,52) + 2.0] - [-822.10 + 30]= -331,56 + 822,10 = +490,54 кДж;
DS0х.р. = (2 ∙ 27,2 +3 ∙·197,91) - (89,96 + 3 ∙ 5,69) = 541,1 Дж / (моль∙К).
Энергию Гиббса при соответствующих температурах находим из соотношения
DG500 = 490,54 – 500  = +219,99 кДж;
= +219,99 кДж;
∆G1000 = 490,54 –1000  = -50,56 кДж.
= -50,56 кДж.
Так как DG500 > 0, а DG1000 < 0, то восстановление Fе2Оз возможно при 1000 К и невозможно при 500 К.
КОНТРОЛЬНЫЕ ВОПРОСЫ
81. Вычислите DG  для следующих реакций
для следующих реакций
а) 2 NaF(к) + Сl2(г) = 2 NaCl(к) + F2(г);
б) РЬО2(к) + 2 Zn(к) = РЬ(к) + 2 ZnO(к).
Можно ли получить фтор по реакции (а) и восстановить PbO2 цинком по реакции (б)?
Ответ: +313,94 кДж; -417,4 кДж.
82.  При какой температуре наступит равновесие системы
При какой температуре наступит равновесие системы
4 НС1(г) + О2(г) 2 Н2О(г) + 2 Сl2(г); DH = -114,42 кДж?
Хлор или кислород в этой системе является более сильным окислителем и при какой температуре?
Ответ: 891 К.
83. Восстановление Fе3О4 оксидом углерода идет по уравнению
Fе3О4(к) + СО(г) = З FеО(к) + CO2(r).
Вычислите DG  и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно DS0 298 в этом процессе?
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно DS0 298 в этом процессе?
Ответ: +24,1.9 кДж; +31,34 кДж/(моль·К).
84. Реакция горения ацетилена идет по уравнению
C2H2(г)+  O2(г) = 2 СO2(г) + Н2О(ж).
O2(г) = 2 СO2(г) + Н2О(ж).
Вычислите DG  и DS
и DS  . Объясните уменьшение энтропии в результате этой реакции.
. Объясните уменьшение энтропии в результате этой реакции.
Ответ: -1235,15 кДж; -216,15 Дж/(мольּК).
85. Уменьшается или увеличивается энтропия при переходах:
а) воды в пар; б) графита в алмаз? Почему? Вычислите DS  для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
Ответ: а) 118,78 Дж/(моль∙К); б) -3,25 Дж/(моль∙К).
86. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2(г) + СО2 (г) = CО(г) + Н2Ож); ∆H = -2,85 кДж.
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите DG  этой реакции.
этой реакции.
Ответ: +19,91 кДж.
87. 
 Прямая или обратная реакция будет протекать при стандартных условиях в системе
Прямая или обратная реакция будет протекать при стандартных условиях в системе
2 NO(r) + О2(г) 2 NO2 (r).
Ответ мотивируйте, вычислив DG  прямой реакции.
прямой реакции.
Ответ: -69,70 кДж.
88. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
NH3(г) + НС1(г) = NH4C1(к).
Может ли эта реакция при стандартных условиях идти самопроизвольно?
Ответ: - 92,08 кДж.
89.  При какой температуре наступит равновесие системы
При какой температуре наступит равновесие системы
СO(г) + 2 Н2(г) СНзОН(ж); DH= - 128,05 кДж?
Ответ: ≈ 385,5 К.
90. 
 При какой температуре наступит равновесие системы
При какой температуре наступит равновесие системы
СН4(г) + CO2(r) 2 СО(г) + 2 H2(r); DH= +247,37 кДж?
Ответ: ≈ 961,9К.
91. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
4 NH3(r) + 5 O2(г) = 4 NO(г) + 6 Н2O(г).
Возможна ли эта реакция при стандартных условиях?
Ответ: -957,77кДж.
92. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО2(г) + 4 Н2(г) = CH4(r) + 2 Н2О(ж).
Возможна ли эта реакция при стандартных условиях?
Ответ: -130,89 кДж.
93. Вычислите DH°, DS°, DG° реакции, протекающей по уравнению
Fе2Оз(к) + ЗН2(г) = 2Fе(к) + 2H2O(г).
Возможна ли реакция восстановления Fе2О3 водородом при 500 и 2000 К?
Ответ: +96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,05 кДж.
94. Какие из карбонатов: ВеСОз, СаСОз или ВаСОз — можно получить при взаимодействии соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив DG0298 реакций.
Ответ: +31,24кДж; -130,17 кДж; -216,02кДж.
95. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО(г) + 3 H2(r) = СН4(г) + Н2О(г).
Возможна ли эта реакция при стандартных условиях?
Ответ: -142,16кДж.
96. Вычислите DH0, DS0, DG0 реакции, протекающей по уравнению
ТiO2(к) + 2 С(к) = Ti(к) + 2 СО(г).
Возможна ли реакция восстановления TiO2 углеродом при 1000 и 3000 К?
Ответ: +722,86 кДж; 364,84 Дж/К; +358,02 кДж; -371,66кДж.
97. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DG  реакции, протекающей по уравнению
реакции, протекающей по уравнению
С2 H 4 (г) + 3 О2(г) = 2 СО2(г) +2 Н2О(ж).
Возможна ли эта реакция при стандартных условиях?
Ответ: -1331,21 кДж.
98. Определите, при какой температуре начнется реакция восстановления Fe3O4. протекающая по уравнению
Fе3О4(к) + СО(г) = З FеО(к) + СОз(г); DH= +34,55 кДж.
Ответ: 1102,4 К.
99. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению:
PCl5 (г) = РС13(г) + Сl2(г); DH= +92,59 кДж.
Ответ: 509 К.
100. Вычислите изменения энтропии для реакций, протекающих по уравнениям
2 СН4(г) = C2H2(г) + З Н2(г)
N2(г) + 3 H2(г) = 2 NH3(г)
С(графит) + О2(г) = СО2(г)
Почему в этих реакциях 0 >DS  ≥ 0?
≥ 0?
Ответ: 220,21 Дж/К;-198,26 Дж/К; 2,93 Дж/К.






