Тиким образом, состояние живых клеток полностью зависит от редокс-статуса их внутренней среды. Многие внутриклеточные процессы чувствительны даже к небольшим изменениям редокс-окружения, что используется клеткой для инициации многих сигнальных каскадов. В основе редокс-сигналинга лежат изменения электрохимического потенциала определенных редокс-пар. Термин редокс- пара обозначает существование в клетке определенного соединения одновременно в окисленном и восстановленном состояниях, причем переход из одного состояния в другое обратим. Важным клеточным редокс-показателем является соотношение окисленной и восстановленной форм подобного соединения. Некоторые из редокс-пар являются универсальными, поскольку выступают связующими звеньями во многих разных клеточных редокс- процессах. В таблице (см. слайды) представлены главные редокс-пары клетки. Редокс-состояние этих пар отражает общее редокс-состояние клетки.
GSSG/2GSH
Главным тиол-дисульфидным редокс-буфером клетки является глутатион, также образующий активную редокс-пару GSSG/2GSH. Глутатион является ключевой молекулой окислительно-восстановительных реакций, связанных с тиол-дисульфидным обменом. Соединение представляет собой трипептид L-γ-глутамил-L-цитенилглицин (таблица на слайде). В клетке глутатион находится преимущественно в восстановленном состоянии, он служит субстратом для ферментов тиол-дисульфидного обмена, которые поддерживают тиолы клетки в восстано-ленном состоянии.
Концентрация восстановленного глутатиона (GSH) в клетках может составлять от 0.1 до 15 мМ в зависимости от типа клеток или клеточного ком- партмента. Клеточное соотношение GSSG/2GSH в среднем составляет примерно 1/100 и может изменяться при окислительном стрессе и апоптозе. S-Глутатионилирование является часто встречаемой посттрансляционной модификацией в белках. В норме регуляция функций многих клеточных белков осуществляется благодаря обратимому глутатионилированию. Степень глутатионилирования многих белков значительно возрастает при патологических состояниях, сопровождающихся масштабным окислительным стрессом. Независимый пул глутатиона в митохондриях защищает белки и липиды матрикса от окислительного повреждения.
Реакции тиол-дисульфидного обмена in vivo катализируются специализированными белками глутаредоксинами (Grx). Grx относят к суперсемейству тиоредоксинов, они найдены практически во всех таксономических группах. Восстановление клеточных дисульфидов благодаря Grx может протекать по монотиольному или дитиольному механизмам, в зависимости от того, участвует в активном центре белка один или два аминокислотных остатка цистеина. Существует несколько изоформ Grx. В клетках млекопитающих выделяют цитоплазматическую изоформу Grx1 и две митохондриальные — Grx2 и Grx5. Окисленный Grx восстанавливается без участия каких-либо ферментов, благодаря пулу GSH.
В свою очередь, для восстановления самого глутатиона и поддержания общего клеточного соотношения GSSG/2GSH на требуемом уровне необходим фермент глутатионредуктаза (GR). GR является FAD-содержащим ферментом, использующим восстановительные эквиваленты NADPH для восстановления GSSG. Схема работы глутаредоксинзависимой системы:

Рис. 1. Принцип работы глутаредоксинзависимой системы. Глутаредоксин (Grx) восстанавливает дисульфидную связь субстрата, окисляясь при этом. Восстановленный глутатион (GSH) неферментативным путем восстанавливает Grx. NADPH-зависимая глутатионредуктаза (GR) поддерживает восстановленный пул глутатиона.
Кроме поддержания общего редокс-статуса всех клеточных тиолов глутатион служит субстратом глутатионпероксидаз (GPx) и, таким образом, участвует в регуляции работы антиоксидантных систем клетки. Помимо Н2О2 GPx могут взаимодействовать и с другими пероксидами, встречающимися в клетках. Кроме реакций, опосредованных GPx, GSH напрямую или через другие ферментативные реакции участвует в нейтрализации свободных радикалов, в том числе АФК.
Глутатионпероксидазы катализируют реакции:
1. Восстановления глутатионом нестойких органических гидропероксидов, включая гидропероксиды полиненасыщенных жирных кислот, в стабильные соединения – окси-кислоты: 2GSH + ROOH ® GSSG + RОH + Н2О.
2. Расщепление Н2О2: 2GSH + Н2О2 ® GSSG + 2 Н2О.
3. Расщепление пероксинитрита: 2GSH + ONOO - ® GSSG + NO + H2O
Глутатионтрансфераза обеспечивает катализ восстановления гидроперекисей органических соединений, включая полиненасыщенные жирные кислоты. Эффективность данного фермента в отношении H2O2 чрезвычайно низка Глутатионтрансферазы - белки, использующие восстановленный глутатион для конъюгации с гидрофобными соединениями и восстановления органических пероксидов. Глутатионтрансферазы локализованы преимущественно в цитозоле клеток. Основная функция этих ферментов - защита клеток от ксенобиотиков и продуктов ПОЛ посредством их восстановления, присоединения к субстрату молекулы глутатиона или нуклеофильного замещения гидрофобных групп:
ROOH + 2GSH = ROH + GSSG + Н2О
R + GSH = HRSG
RX + GSH = RSG + HX.
TrxSS/Trx(SH)2
Тиоредоксины (Trx) формируют еще одну важную систему клетки, участвующую в тиол-дисульфидном обмене. Trx представляют собой семейство небольших по размеру белков, которые в окисленном (TrxSS) и восстановленном (Trx(SH)2) состояниях образуют редокс-пару, взаимодействующую с другой редокс-парой клетки — GSSG/2GSH. Процессы тиол-дисульфидного обмена с участием Trx осуществляются благодаря наличию двух остатков цистеина в активном центре этих белков. Уровень Trx в различных клетках примерно в 100—1000 раз ниже уровня глутатиона. Выделяют цитозольную изоформу Trx1, митохондриальную Trx2, секреторную Trx80 и SpTrx, которую обнаружили в сперматозоидах. Подобно глутатиону, белки семейства Trx также образуют независимо контролируемые пулы в разных клеточных компартментах.
В зависимости от типа и состояния клеток редокс-потенциал митохондриального Trx2 находится в диапазоне —360...—340 мВ. Для сравнения, редокс-потенциал цитоплазматического и ядерного Trx1 составляет —280.—300 мВ при рН 7.0.
Trx восстанавливают дисульфидные связи белков клетки, переходя в окисленную форму с образованием дисульфида в активном центре. Восстановление TrxSS осуществляют NADPH-зависимые тиоредоксинредуктазы TrxR. Принцип работы тиоредоксинзависимой системы представлен на рис. 2.
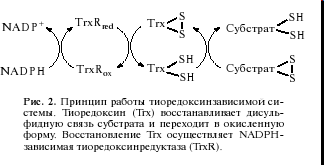
В клетках млекопитающих были выявлены цитоплазматическая изоформа TrxR1, митохондриальная TrxR2 и уникальный фермент, который был назван тиоредоксинглутатионредуктазой (TGR), поскольку он участвует в восстановлении Trx и GSSG одновременно.
Механизм: восстановительные эквиваленты транспортируются от NADPH через простетическую группу FAD на дисульфид активного центра TrxR, расположенного в А-концевом домене одной субъединицы. Далее перенос электронов осуществляется на селеноцистеинсодержащий активный центр другой субъединицы, а затем на субстрат.
Метионинсульфоксидредуктаза использует тиоредоксин в качестве восстановителя. Можно полагать, что такая система циклического окисления-восстановления остатков метионина является «встроенной» в молекулы белков отдельной антиоксидантной системой клетки, дезактивирующей опасное действие АФК.
Восстанавливая дисульфиды и защищая многие белки от последствий окисления, тиоредоксины играют важную роль во многих клеточных процессах. Trx участвуют в тонкой регуляции некоторых транскрипционных факторов и влияют на экспрессию генов. Trx выступают в роли доноров электронов для пероксиредоксинов, рибонуклеотидредуктаз, метионин-сульфоксидредуктаз. Являясь регуляторами важнейших клеточных функций, Trx имеют огромное значение для выживаемости клеток, в том числе при патологических состояниях.
NAD+/NADH
В клеточном дыхании одним из главных связующих звеньев является молекула никотинамидадениндинуклеотида (NAD). В клетке NAD одновременно пребывает в окисленном (NAD+) и восстановленном (NADH) состояниях, выступая, соответственно, акцептором и донором восстановительных эквивалентов в совершенно разных клеточных реакциях. NAD+ и NADH являются активной редокс-парой, от значения соотношения NAD+/NADH зависят многие важнейшие процессы клетки. Клеточное соотношение NAD+/NADH является ключевым параметром, который отражает общее редокс-состояние клеток. Благодаря NAD-зависимой регуляции многих белков (различные дегидрогеназы, mono (ADP-Rib)-трансферазы, ADP-рибозилциклазы, сиртуины и другие) от показателя соотношения NAD+/NADH зависят многие важные клеточные процессы, в том числе клеточная смерть, экспрессия некоторых генов и клеточный сигналинг. Поддержание величины соотношения NAD+/NADH на определенном уровне препятствует повреждению внутриклеточных структур от окисления. Также есть данные о том, что в течение жизни в тканях некоторых организмов соотношение NAD+/NADH меняется.
Молекула NAD представляет собой динуклеотид, составные нуклеотиды которого соединены друг с другом через остатки фосфорной кислоты (таблица). Азотистыми основаниями нуклеотидов NAD являются аденин и никотинамид. NAD+ принимает пару электронов от окисляемого субстрата в составе протона Н+ и гидрид-иона Н-. При этом Н+ высвобождается в окружающую среду. Оставшийся атом водорода присоединяется к четвертому углероду никотинамидного кольца, а электрон распределяется в его плоскости. Этот процесс обратим, и восстановленная молекула NADH в дальнейшем может передавать электроны на какой-либо субстрат.
Для большинства тканей общая концентрация NAD+ и NADH составляет примерно 10-5 М. Наиболее важным клеточным параметром является соотношение окисленной и восстановленной форм данного кофактора. В митохондриях соотношение NAD+/NADH меняется в пределах от 7—8 до 1, в то время как в цитоплазме этот параметр имеет более широкий диапазон значений — от 700 до 1.
Внутренняя мембрана митохондрий непроницаема для обеих форм NAD. Однако в клетке происходит постоянный обмен восстановительными эквивалентами между цитоплазмой и митохондриями, для этого существуют специализированные челночные механизмы. В зависимости от субстратной пары и типа клеток реализуется глицеролфосфатный или малатаспартатный механизмы. Есть результаты исследований, свидетельствующие о транспорте NAD через плазматическую мембрану клеток.
NAD+ и NADH являются ключевыми факторами энергетического метаболизма клеток, что подробно описано во многих классических учебниках по биохимии. NAD+ выступает в роли универсального акцептора восстановительных эквивалентов, которые образуются в процессе окисления различных субстратов с участием специфичных дегидрогеназ. В цитоплазме NADH может быть вновь окислен. Например, лактатдегидрогеназа осуществляет реакцию превращения пирувата в лактат с использованием NADH. Но главным клеточным потребителем NADH является ЭТЦ митохондрий на уровне комплекса I.
Понимание принципов регуляции энергетического обмена клетки постоянно расширяется благодаря открытию новых взаимосвязей между NAD и различными клеточными компонентами. Например, действие NAD+ на энергетический метаболизм клетки может быть опосредовано через регуляцию белков семейства сиртуинов, модулирующих, в свою очередь, гликолиз, синтез гликогена, а также активность ацетил-СоА-синтетазы. NAD+ и NADH участвуют в регуляции работы митохондрий не только на уровне ЦТК и ЭТЦ, но и на уровне регуляции проницаемости митохондриальной мембраны, определяющей активность всей органеллы в целом.
Установлено, что в регуляции теломеразной активности участвуют NAD+-зависимые ферменты танкиразы. Также у некоторых видов млекопитающих была обнаружена корреляция между активностью ферментов PARP в одноядерных кровяных клетках с продолжительностью их жизни, что может быть связано с участием PARP в процессах репарации ДНК, клеточная гибель осуществляется с участием PARP-1.
Соотношение NAD+/NADH вместе с фосфорилированной формой кофактора NADP+/NADPH задействовано в тонкой регуляции уровня такого важного вторичного мессенджера клетки, как Ca2+ (рис. 4 слайд). Главным образом эта регуляция осуществляется соединениями, предшественниками которых является молекула NAD+. К ним относятся ADP- Rib, сADP-Rib, О-ацетил-ADP-Rib, адениндинуклеотидфосфат никотиновой кислоты (NAADP).
Значение такого клеточного параметра, как соотношение NAD+/NADH, трудно переоценить. От этого показателя зависят энергетические процессы клетки и общее редокс-состояние клетки.
NADP+/NADPH
NADP+/NADPH — еще один пример редокс-пары, функции которой иногда перекрываются с функциями NAD+/NADH. NADPH служит источником электронов для многих биохимических реакций. β-никотинамидадениндинуклеотидфосфат (NADP) отличается от NAD наличием остатка фосфорной кислоты в положении 2' рибозы никотинового нуклеотида (см. таблицу). Этот кофермент встречается во всех типах клеток и также представлен в них в окисленной (NADP+) и восстановленной (NADPH) формах.
Внутриклеточная концентрация NADP в физиологических условиях значительно ниже по сравнению с концентрацией NAD. Однако общий пул NADP в клетке более восстановлен по сравнению с пулом NAD. Общее клеточное соотношение NADP+/NADPH составляет примерно 0.005.
Образование NADP+ в клетке происходит при фосфорилировании NAD+, реакцию катализируют NAD+-киназы (NADKs). Эти ферменты играют важнейшую роль в поддержании общего уровня NADP в клетке, их активность тщательнейшим образом контролируется. Восстановленная форма NADPH образуется в клетке в результате окислительно-восстановительных реакций, катализируемых различными дегидрогеназами. Кроме того, митохондриальная трансгидрогеназа, которая расположена на внутренней мембране митохондрий, осуществляет перенос восстановительных эквивалентов между пулом NAD и NADP. Благодаря этому ферменту восстановление NADP+ может происходить за счет NADH, что повышает эффективность антиоксидантной системы защиты митохондрий.
Таким образом, оба типа ферментов — и NADKs, и митохондриальная трансгидрогеназа осуществляют важнейшую роль в поддержании баланса между клеточными пулами NAD и NADP.
Пара NADP+/NADPH участвует в регуляции многих окислительно-восстановительных реакций клетки, в том числе реакций антиоксидантных систем. Ранее было отмечено, что глутатионзависимая и тиоредоксинзависимая системы используют в качестве восстановительных эквивалентов молекулы NADPH для восстановления глутатиона и тиоредоксина, соответственно. Для некоторых типов клеток характерно связывание большого количества NADPH каталазой — ферментом, осуществляющим деградацию Н2О2. NADH поставляет электроны в дыхательную цепь митохондрий.
Белки семейства NOX (nicotinamide adenine dinucleotide phosphate oxidases) являются трансмембранными NADPH-оксидазами. Используя NADPH в качестве донора, эти ферментные комплексы осуществляют перенос электронов через биологические мембраны. Кислород служит акцептором электронов, что приводит к образованию O2-, причем это один из главных путей его образования в клетках.
Фагоциты для уничтожения чужеродных клеток используют АФК, в связи с чем, при стимуляции их функционирования происходит резкий подъем дыхательной активности, сопровождающийся возрастанием потребления кислорода в 50 раз. При этом имеет место метаболизация глюкозы через пентозофосфатный путь, что приводит к образованию NADPH. Благодаря этому, фермент - мембраносвязанная NADPH-оксидаза плазмы, обеспечивает катализ одноэлектронного восстановления кислорода за счет переноса электронов от NADPH к FAD и затем к цитохрому b. Продуктом данной реакции являетсясупероксидный анионрадикал.
В фагоцитирующих клетках один из представителей семейства NOX является важнейшим компонентом борьбы с патогенами. NOX2, используя NADPH в качестве донора, осуществляет перенос электронов внутрь фагосомы с цитоплазматической стороны клетки. Это приводит к мощной генерации внутри фагосомы супероксида, быстро превращающегося в H2O2. В случае нейтрофилов, благодаря миелопероксидазе, с участием H2O2 образуется еще более реактивное соединение — хлорноватистая кислота (гипохлорид). Позднее генерация АФК была обнаружена и в других типах клеток, большинство из которых не имеют никакого отношения к фагоцитозу. Именно благодаря изучению сложных комплексов этих белков стало понятно, что роль АФК в разнообразных клетках очень велика и не ограничивается одним лишь повреждением клетки, как считалось ранее.
Поскольку пул NADP, как и пул NAD, вовлечен в различные окислительно-восстановительные реакции клетки, многие процессы метаболизма завиcят от соотношения окисленной и восстановленной форм данного кофактора, NADP+/NADPH. Пул NADPH служит главным ресурсом электронов в клетке, поэтому этот кофактор используется в реакциях биосинтеза важнейших молекул, например, жирных кислот, стероидов, аминокислот и других.
ФЛАВИНЫ
Флавинмононуклеотид (FMN) и флавинаде- ниндинуклеотид (FAD) — одни из самых универсальных клеточных редокс-активных кофакторов. Флавопротеины, содержащие FMN и FAD в качестве простетических групп, катализируют многие одно- и двухэлектронные редокс-реакции и являются ключевыми ферментами в таких процессах, как фотосинтез, цикл Кребса, β-окисление жирных кислот, аэробное дыхание и многих других. Важную роль флавопротеины играют в биосинтезе различных природных галогенпроизводных, в фоторепарации ДНК и апоптозе.
Около 16% флавопротеинов в качестве кофактора содержат FMN, остальные — FAD, при этом около 90% флавопротеинов связывают кофактор нековалентно. Большая часть флавопротеи нов специфична к одному из кофактров, однако было обнаружено несколько человеческих флавопротеинов, которые могут использовать и FAD, и FMN. Большая часть флавопротеинов человека, которых по последним данным описано около 276, относится к оксидоредуктазам, но встречаются они и среди трансфераз, лиаз, изомераз, лигаз.
В основе молекул FMN и FAD лежит изоаллоксазин — гетероциклическое соединение, построенное из бензольного, пиримидинового и пиразинового колец (см. таблицу). Изоаллоксазиновое ядро способно обратимо принимать и отдавать один или два электрона и может активироваться под действием кислорода. Благодаря этой особенности строения большинство флавинзависимых ферментов катализируют различные клеточные редокс-реакции.
Предшественником FMN и FAD является витамин В2 (рибофлавин). В человеческом геноме содержится около 90 генов, кодирующих флавинзависимые ферменты, 6 генов для поглощения рибофлавина и его последующего превращения в FMN и FAD, 2 гена для восстановления рибофлавина до дигидрорибофлавина. Мутации в этих генах часто связаны с патогенезом различных заболеваний. Так как большая часть функциональной активности флавопротеинов приходится на митохондрии, эти заболевания чаще всего связаны именно с митохондриальными дисфункциями. Реже нарушения затрагивают пероксисомы и эндоплазматический ретикулум.
Редокс-потенциал изоаллоксазинового кольца (—209 мВ) позволяет ему принимать участие в метаболизме многих молекул. Результатом таких реакций становятся обратимые взаимопревращения одинарных и двойных связей. Помимо этого, восстановленное изоаллоксазиновое кольцо может взаимодействовать с молекулярным кислородом, образуя пероксифлавин который, например, участвует в деградации ароматических метаболитов.
Флавины способны восстанавливаться и окисляться одноэлектронно с образованием радикальных форм. У многих ферментов это свойство флавинов используется при переносе двух электронов от субстратов-доноров на редокс-компоненты, способные принимать только один электрон (железо-серные центры, гемы цитохромов). Восстановленные флавины как в свободном состоянии, так и в составе белков, могут взаимодействовать с молекулярным кислородом и, в зависимости от белкового окружения, продуктами такой реакции оказываются либо O2, либо Н2О2, либо и то, и другое. На рис. 2 слайд в упрощённом виде приведена общепринятая схема окисления восстановленного флавина кислородом. Восстановленный флавин (FlH) отдает один электрон молекуле кислорода, в результате чего образуется радикальная пара (FlH’* O2) (стадия а). Гомолитический распад пары приводит к образованию супероксид-радикала и радикала флавина (реакция б), а гетеролитический - к образованию перекиси водорода и окисленного флавина, либо непосредственно (реакция в), либо через образование (С(4а)-(гидро)пероксифлавина, реакции г и д).
Резюмируя все сказанное, следует отметить, что соотношение NAD+/NADH является важнейшим клеточным параметром, определяющим регуляцию таких биологических процессов, как энергетический метаболизм, сигналинг, поддержание общего редокс-статуса клетки, экспрессия генов, старение и клеточная смерть. Общий пул NAD тесно связан с пулом другого редокс- активного соединения — NADP, образующего редокс-пару NADP+/NADPH. NAD+ это ключевая молекула для обоих пулов — NAD и NADP, поскольку синтезируется de novo и служит предшественником для NADH, NADP+ и NADPH. Наряду с этим NAD и NADP играют ведущую роль и в продукции АФК в клетках. NAD и NADP задействованы в тонко сбалансированной регуляции одновременно двух важнейших противоположных по своему значению процессов клетки: работе антиок- сидантньк систем и продукции АФК.
Глутатионзависимая и тиоредоксинзависимая системы клетки также используют восстановленный NADP, из-за его более отрицательного редокс-потенциала, для восстановления глутатиона и тиоредоксина — основных компонентов тиол-дисульфидного обмена клетки. От соотношения GSSG/2GSH зависят многие глобальные клеточные процессы, в том числе пролиферация, дифференциация и клеточная смерть.
В отличие от многих других клеточных метаболитов, которые также присутствуют в клетке одновременно в окисленном и восстановленном состояниях, вышеперечисленные редокс- пары участвуют в большом количестве разных реакций и поэтому универсальны. Следует отметить, что большинство биологических окислительновосстановительных реакций представляют собой двухэлектронные процессы, что позволяет избежать образования активных промежуточных продуктов, в том числе свободных радикалов.
Прооксиданты
Экзогенными прооксидантами ялюятся различные факторы окружающей среды, вызывающими избыточное образование АФК косвенным (различные ксенобиотки) или прямым (ионизирующее излучение) путем.
Собственно клеточная основная прооксидантная система – это ЭТЦ митохондрий (где генерация АФК – побочный процесс)+ ряд специализированных ферментов, которые целенаправленно продуцируют АФК.
NAD(P)H-оксидазы
NAD(P)H-оксидазы семейства NOX (МКФ 1.6.3-) - пожалуй единственная группа ферментов, для которых продукция АФК - главная функция. Это мембраносвязанные ферменты, которые переносят электроны от NAD(P)H на молекулярный кислород с образованием супероксида. Наиболее хорошо изучена NAD(P)H-оксидаза фагоцитов (NOX2), ответственная за так называемый «дыхательный взрыв» [60]. Атомная структура ни для одного представителя семейства NOX в настоящее время неизвестна. Секвенирование, анализ профиля гидро- фобности и иммунологический анализ свидетельствуют о том, что все NAD(P)H-оксидазы семейства NOX имеют сходную структуру. Это интегральные белки мембран, содержащие 6 трансмембранных спиралей и 5 петель, локализованных в водной фазе (три петли с одной стороны мембраны и две - с другой стороны) [60]. В С-концевом участке находятся NAD(P)H- и FAD-связывающие центры. Трансмембранные спирали связывают молекулы гема b. Внутримолекулярный перенос двух электронов протекает в следующей последовательности: NAD(P)H ^ FAD ^ гем b ^ гем b ^ молекула О2. В результате происходит трансмембранный перенос электронов, и образуются две молекулы супероксид-радикала. Следует отметить, что супероксид- радикал - истинный, а не побочный (как в случае множества других оксидоредуктаз) продукт реакции, катализируемой NOX.
При истощении резервов АТP или окислительном стрессе ксантиноксидаза цитозоля способна продуцировать О2". Так, доказано, что в процессе биосинтеза лейкотриенов и простаноидов липоксигеназа и циклооксигеназа способны генерировать синглетный кислород и О2". При биотрансформации лекарственных веществ имеет место активация микросомальных цитохром-Р-450 систем, что часто сопряжено с образованием активных метаболитов, в том числе с формированием АФК.
Карбонильные интермедиаты (глиоксаль, метилглиоксаль, 3- деоксиглюкозон) окисления белков обеспечивают окислительное гликирование белков, формируя конечные продукты неферментативного гликозилирования, которые связываясь с рецепторами на клеточной мембране, также могут вызывать прооксидантное состояние в клетках эндотелия, характеризующееся активацией пострецепторного сигнала, генерацией внутриклеточных суперок- сидных радикалов и активацией экспрессии генов.
Антиоксиданты
Ответом на чрезмерное образование АФК является активизация Антиоксидантная система (АОС) организма. Для нейтрализации избыточного количества АФК в клетках имеется многофункциональная система антиоксидантной защиты в виде разнообразных перехватчиков АФК, а также ферментных систем нейтрализации радикалов. Происходит активизации различных защитных и адаптационных клеточных механизмов для преодоления повреждающих последствий окислительного стресса и систем репарации повреждений ДНК.
Антиоксиданты имеют подвижный атом водорода и поэтому реагируют со СР и с инициаторами свободнорадикального окисления. Подвижность атома водорода обусловлена нестойкой связью с атомами углерода (С-Н) или серы (S-Н). В результате взаимодействия возникают малоактивные радикалы самого антиоксиданта, гидроперекиси разлагаются без диссоциации на активные радикалы, образуются комплексоны с металлами переменной валентности. Ряд антиоксидантов не обрывает, а замедляет продолжение цепи, т.е. обладает пролонгирующим действием.
Ферментативная АОС
Важнейшими ферментами антиоксидантной защиты считаются супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза. При этом общепризнано, что в состоянии окислительного стресса ключевым ферментом является каталаза. Именно она способна утилизировать пероксид водорода с высокой скоростью (около 6 миллионов молекул H2O2 в минуту, обеспечивая тем самым быструю реакцию клетки на опасность и препятствуя преобразованию пероксида водорода в гидроксильный радикал - один из сильнейших внутриклеточных окислителей.
Каталазы относятся к классу оксидоредуктаз и представляют собой целую группу протеинов, включающую различные по строению и действию молекулы.
Каталаза катализируют реакцию: 2Н2О2 = 2Н2О + О2.
Реакция преобразования пероксида водорода с помощью каталазы осуществляется в два этапа путем взаимодействия с гемовой группой фермента, содержащей Fe(III). В результате происходит поляризация и разрыв -О-О- связи в пероксиде водорода и образование промежуточного комплекса I, содержащего группу Fe(IV)=O, и воды. На втором этапе протон из другой молекулы пероксида водорода выступает в роли воостановителя фермента, давая выход молекулам воды и кислорода и возвращая каталазу в первоначальное состояние. В общем виде реакцию действия каталазы можно представить следующим образом:
1. H2O2 + Fe(Ш)-фермент = H2O + O=Fe(IV)-фермент
2. H2O2 + O=Fe(IV)-фермент = H2O + O2 + Fe(Ш)-фермент.
Таким образом, из двух молекул пероксида водорода образуется 2 молекулы воды и одна молекула кислорода.
Каталаза обеспечивает предохранение клетки от накопления пероксида водорода, который в присутствии ионов двухвалентного железа выступает в качестве источника гидроксильного радикала
Супероксиддисмутаза (СОД) - один из основных внутриклеточных ферментов АОС. Представляет собой группу металлоферментов, катализирующих реакцию дисмутации суперокида что обеспечивает поддержание их концентрации в клетке на низком уровне. Механизм функционирования СОД включает последовательное восстановление и окисление ионов металла переменной валентности в активном центре фермента. Способствует инактивации супероксид-анион радикала, переводя его в более стабильную перекись водорода. Существует несколько изоферментов СОД, отличающихся строением активного центра Cu-, Zn-, Mn-, Fe-СОД. Все изоформы СОД катализируют реакцию:
Ме+-СОД + ·О2- + 2Н+ ®Ме2+-СОД + Н2О2
Для каталитической активности фермента нужны ионы меди. Ионы цинка выполняют структурную роль, обеспечивая конформацию белка, необходимую для работы активного центра фермента. Mn-СОД локализована в митохондриях печени и миокарда эукариот, вблизи анионных каналов. Характерной особенностью Мn-СОД является ее индуцибельность. Железо-содержащая СОД обнаружена только у прокариот.
Экстрацеллюлярная СОД является главным изоэнзимом межклеточных жидкостей (плазмы, лимфы, синовиальной жидкости), и в небольших количествах (1-2% от общей СОД-активности) обнаруживается практически во всех тканях.
Активности каталазы и СОД коррелируют между собой, что может быть связано с переключением потока электронов с одной цепи транспорта на другую. В этих условиях СОД и каталаза действуют как звенья одной системы утилизации кислорода, размещенные в разных участках клетки. Совместно действие СОД и каталазы избавляют клетки живых организмы от двух наиболее опасных источников окислительных повреждений- супероксид-анион радикала и гидроксильных радикалов, образующихся при реакции Фентона.
Глутатионпероксидаза, рассмотренная ранее, инактивирует Н2О2 и органических гидроперекисей.
Другие антиоксиданты
Помимо фрментативного звене АОС антиоксидантную активность проявляет множество, в основном, низкомолекулярных других веществ, участвующих в бохимических процессах клетки. Антиоксиданты обладают способностью нейтрализовывать АФК еще до развития эффекта повреждения биомолекул. К антиоксидантам относят вещества, присутствие которых в среде, существенно задерживают либо ингибируют процесс окисления основного субстрата. По молекулярной массе выделяют группу низкомолекулярных антиоксидантов (глутатион, аскорбат, β-каротин, α-токоферол, мочевая кислота), которые легко проникают через клеточные мембраны, и высокомолекулярные, к которым относятся ферменты АОС. Выделяют антиоксиданты природного (биоантиоксиданты) и синтетического происхождения. По химической природе биоантиоксиданты представляют собой широкий класс соединений: фенолы и полифенолы (токоферолы, эвгенол, конидендрин, пирокатехин, производные галловой кислоты), флавоноиды (рутин, кверцетин), стероидные гормоны и многие другие соединения. В зависимости от растворимости различают жирорастворимые (витамины Е, А, К, стерины, убихинон) и водорастворимые (витамины С, В6, РР, серотонин, SH-содержащие соединения) биоантиоксиданты.
а-Токоферол - инактивирует радикалы жирных кислот. Около 50% клеточного токоферола локализовано в ядре, 30% - в мембранах митохондрий, 20% - в микросомальной мембране. Недостаток витамина Е способствует деструкции мембран и экскреции креатина с мочой. Витамин Е - мощный антимутаген, в физиологических концентрациях является регулятором тканевого дыхания.
Аскорбиновая кислота может выступать в качестве донора и акцептора ионов водорода благодаря наличию в структуре двух фенольных групп, ее антиоксидантные свойства характеризуются широким спектром инактивирующего действия на различные СР. Аскорбиновая кислота превосходит другие антиоксиданты плазмы крови в защите липидов.
Мочевая кислота, как и аскорбат, способна вступать в обменные реакции с АФК, ингибировать ПОЛ, оказывает выраженный протективный эффект по отношению к Fe- и рН-индуцированному окислению аскорбата в сыворотке крови.
в-Каротин - один из наиболее эффективных «тушителей» синглетного кислород. При взаимодействии с богатыми двойными связями в-каротиноидами 1O2 переходит в триплетное состояние. Одна молекула в-каротина способна инактивировать около 1000 молекул 1O2.
Таурин - аминокислота, непосредственно реагирует с АФК, образуя менее реакционноспособные соединения и защищая, тем самым, клетки от повреждения.
Эффективными “перехватчиками” радикалов являются фенольные антиоксиданты: простые фенолы, нафтолы и ок- сипроизводные других ароматических соединений, витамины Е и К, убихиноны, триптофан и фенилаланин, большинство растительных и животных пигментов (каротиноиды, флавоноиды, фенокарбоксильные кислоты).
Хелатные соединения, связывающие ионы металлов переменной валентности (сидерофилины; церулоплазмин; мочевая кислота) и тем самым препятствующие их вовлечению в реакции разложения перекисей, представляют собой важный компонент антиоксидантной защиты организма Соединения, хелатирующие ионы железа и других металлов с переменной валентностью, например, цитрат, интермедиат ЦТК. Антиоксидантные свойства определяются наличием у нее диссоциирующих карбоксильных групп.
Белки, связывающие железо. К этому классу относятся трансферрин, сывороточный трансферрин, лактоферрин, овотрансферрин, меланотрансферрин, дефероксамин, ферритин.
Церулоплазмин - главный медьсодержащий белок внеклеточных жидкостей млекопитающих, связывающий 90-95% сывороточной меди. Каждая молекула церулоплазмина содержит 6 прочно связанных атомов Си2+, способных высвобождаться только при низких значениях рН и в присутствии восстановителя. Церулоплазмин проявляет каталитическую активность в отношении большого числа субстратов, он эффективно окисляет ионы Fe2+, аскорбиновую кислоту, фенолы, амины, катехолы, являясь одновременно феррооксидазой, аскорбатоксидазой и аминооксидазой.
Эти белки относятся к высокомолекулярным соединениям, помимо них антиоксидантные свойства проявляют: альбумины, Cys-пероксиредоксин, металлотионин.
Дригие низкомолекулярные соединения: мелатонин, инозин, гуанозин, кофеин, флавоноиды и тд.






