Анализ результатов окислительного повреждения белков представляет собой более сложную задачу, нежели окислительных повреждений ДНК, поскольку по сравнению с одним сахаром и четырьмя основаниями ДНК белки содержат 20 разнообразных по структуре аминокислот, каждая из которых может быть атакована АФК разнообразными путями.
Количественно, белки более повреждаемая мишень, чем ДНК и липиды, они являются главной мишенью в клетках при воздействии наиболее реакционной формы АФК – гидроксильных радикалов, более чувствительной, чем ДНК и липиды. Окислительные повреждения белков приводят к существенным нарушениям в работе большинства клеточных систем и процессов. Данные повреждения проявляются в изменении функций рецепторов, ферментов, транспортных белков, ответственны за формирование антигенов, способных вызвать аутоиммунную реакцию и т.п. Следует отметить, что молекуле фермента обычно содержится несколько ароматических аминокислот, дисульфидных (-SS-) связей и сульфгидрильных групп (-SH) (АТФазы или дегидрогеназы) такие группы наиболее легко окисляются в результате свободнорадикальной атаки. Однако разрушение только некоторых из этих группировок в близи активного центра приводит к инактивации фермента.
Окисление белков различными АФК может приводить к образованию аминокислотных радикалов, которые, реагируя с кислородом, образуют пероксильные органические радикалы, которые в свою очередь способны к образованию многочисленных продуктов окисления.
Взаимодействие пептидов и белков с АФК состоит из следующих ключевых реакций:
RCHR1R2 + HO· ® RC·R1R2 + H2O
RC·R1R2 + O2 ® RC(·O2)R1R2
RC(·O2)R1R2 + HO2· ® RC(OOH)R1R2 + O2
RC·R1R2 + HO· ® RC(OH)R1R2
где R, R1, R2 – различные аминокислотные остатки
При рассмотрении окислительных повреждений белков, имеет смысл выделять два типа таких окислительных модификаций - окисление аминокислотных остатков и самой полипептидной цепи.
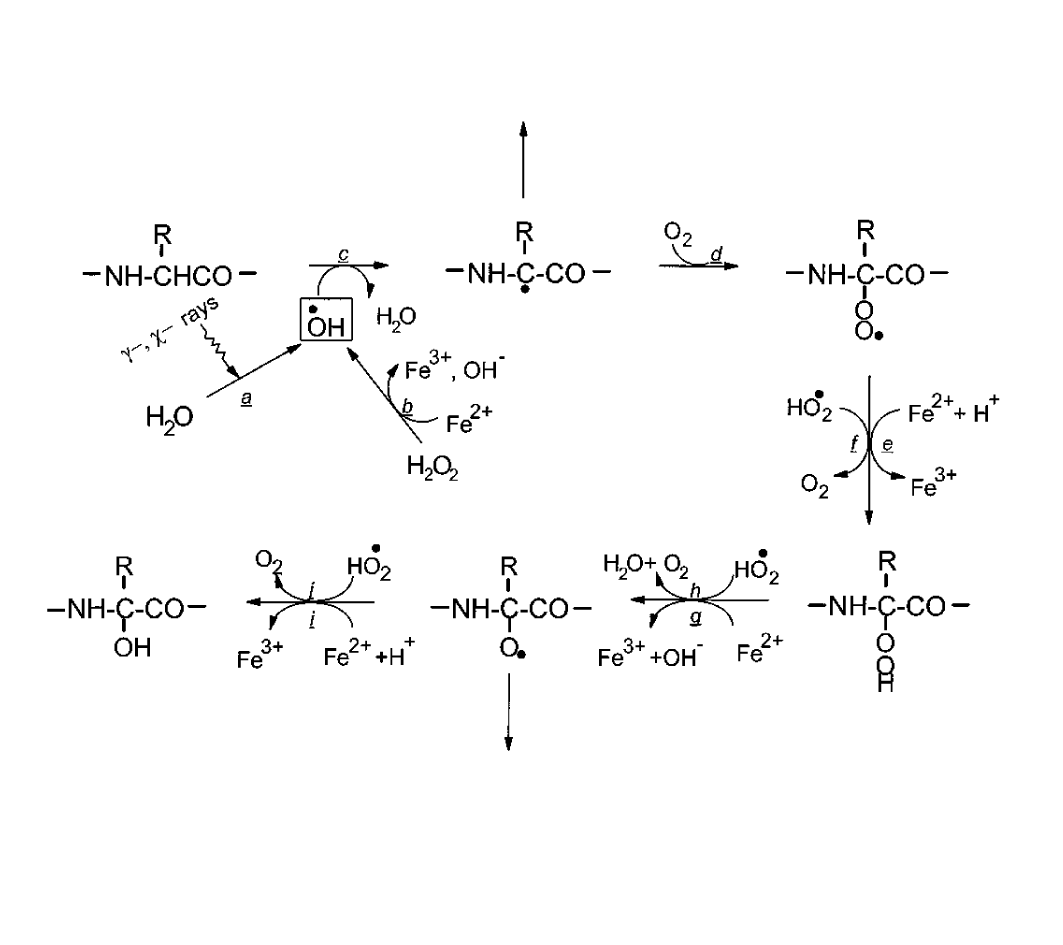
Рис. 1. Пути окисления белковых молекул, обусловленного АФК.
На рис. 1 показаны стадии окисления полипептидной цепи по двум наиболее распространенным путям. Если рассматривать окисление полипептидной цепи под действием гидроксильного радикала, что является наиболее типичным в случае воздействия ионизирующих излучений (реакция a), то этот процесс всегда начинается с отрыва атома водорода от альфа-углеродного атома одной из аминокислот. Остатки всех алифатических аминокислот являются потенциальными мишенями для АФК альфа-углеродные атомы аминокислотных остатков являются наиболее вероятной точкой атаки гидроксильных радикалов. При этом образуется альфа-углеродный алкильный радикал белка (с). Источником гидроксильного радикала может также служить распространенная в водных растворах реакция Фентона (b). Наиболее обычным для алкильного радикала процессом при нормальных условиях является присоединение молекулы растворенного в воде кислорода (d). При этом образуется алкилпероксильный радикал, который в присутствии гидратированного супероксид-анион радикала (НО2•) или ионов металлов переменной валентности способен восстанавливаться до алкилпероксида (e).
Подобные перекиси белков, так же в присутствии железа, меди или супероксида, переходят в форму алкоксильных радикалов (f) и далее - в гидроксипроизводное пептида (g).
a-углеродные радикалы, окси- и пероксирадикалы полипептидов могут далее реагировать с окружающими органическими структурами, окисляя их с образованием разнообразных «сшивок» и агрегатов или формируя на них новые углеродные радикалы, способные к дальнейшим превращениям:
R1C· или R1OO· или R1O· + R2CH ® R2C· + R1H или R1OOH или R1OH
Сшивки белковых молекул образуются в основной массе при отсутствии кислорода, в этом случае, вместо того чтобы вступить в реакцию (d), алкильный радикал может прореагировать с гомологичным радикалом, образовав углерод-углеродную ковалентную связь:
R1C· + R2C· ® 1RCCR2
Образование белковых «сшивок» и гидроксилирование белков - не единственное последствие реакции пептидной связи с гидроксильными радикалами. Наличие алкоксильного радикала в полипептидной цепи может привести к ее разрыву при химической модификации, схематически отраженной на рисунке 2. Как видно из схемы, деструкция полипептидной цепи может идти двумя путями - a-амидным (b) и диамидным (a).
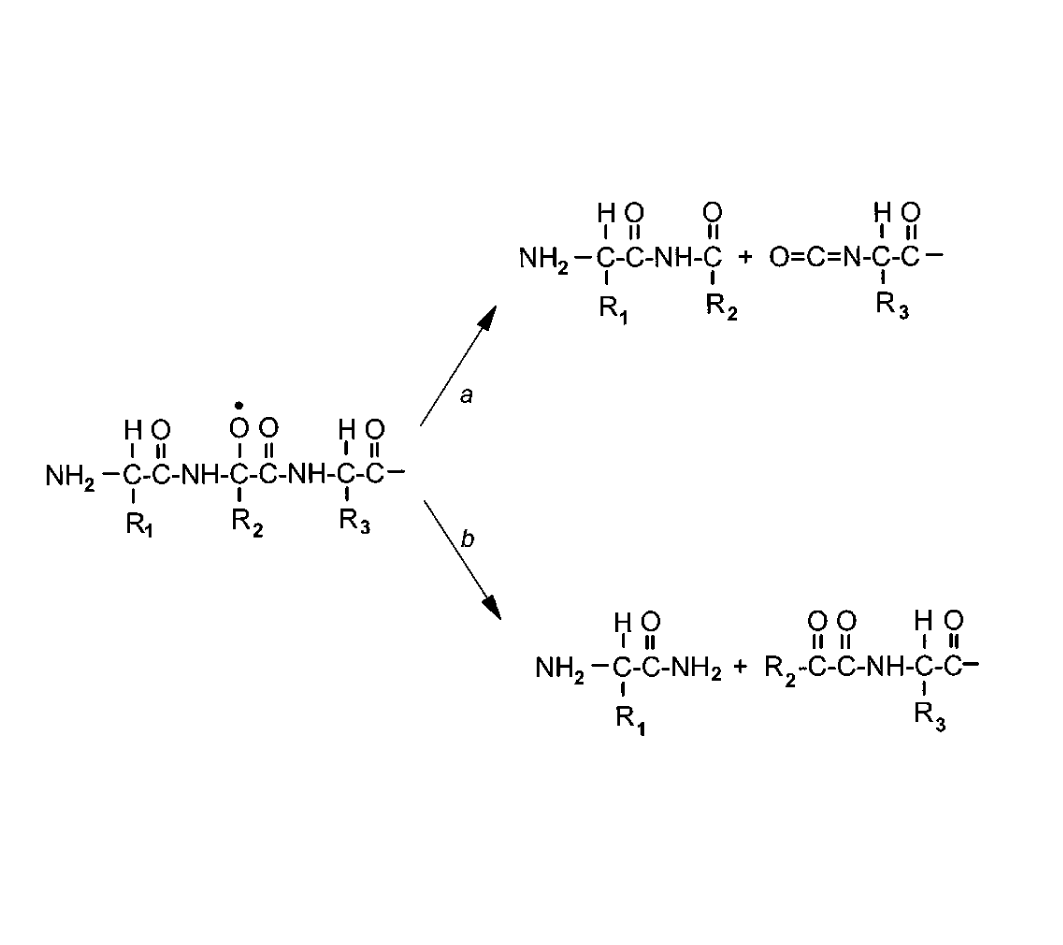
Рис. 2. Пути разрыва пептидной связи через окисление основной цепи.
Разрыв аминокислотной цепи a-амидным путем осуществляется через алкоксильный радикал, который, образуя иминопроизводное, спонтанно гидролизуется с освобождением двух пептидных фрагментов. Новообразованный C-конец после этой модификации существует в виде амидного производного, а N-конец – в виде кетоацильного производного.
В том случае, когда дефрагментация белка идет по диамидному пути, то на С-конце пептидного фрагмента, образовавшегося из N-концевого участка изначальной молекулы, формируется диамидная структура. На N-конце второго фрагмента образуется изоцианидное соединение.
Все аминокислотные остатки в составе белков способны оксисляться при взаимодействии с гидроксильным радикалом, однако продукты этих взаимодействий определены пока лишь частично. В таблице представлены продукты окисления боковых остатков аминокислот, наиболее подверженных атаке АФК и исследованных в этом плане.
Таблица 1. Продукты окислительной модификации остатков наиболее окисляемых аминокислот.
| Аминокислота | Продукты окисления |
| Цистеин | нитрозотиилы, тиоловые радикалы, цистин, коньюгаты с глутатионом |
| Метионин | метионинсульфоксид, метионинсульфон |
| Триптофан | кинуренин, 3-гидроксикинуренин, гидропиролиндол, оксииндол, N-формилкинуренин, 3-гидроксилкинуренин |
| Фенилаланин | 2,3-гидроксифенилаланин, 2-,3-,4-гидроксифенилаланин |
| Тирозин | 3,4-дигидроксифенилаланин, дитирозин (2,2’- бифенилпроизводные) |
| Гистидин | 2-оксогистидин, 4-ОН-глутамат, аспартат, аспарагин |
| Аргинин | глутаминовый полуальдегид |
| Лизин | 2-аминоадипиновый полуальдегид |
| Пролин | глутаминовый полуальдегид, 2-пирролидон, 4- и 5-гидроксипролин, пироглутаминовая кислота |
| Треонин | 2-амино-3-кетобутиловая кислота |
| Глутаминовая кислота | пировиноградная кислота |
Окислительная модификация боковых остатков некоторых аминокислот может, подобно механизмам, описанным выше, также приводить к дефрагментации белковой молекулы. Такой процесс возможен при воздействии АФК на остатки пролина и дикарбоновых аминокислот - аспарагиновой и глутаминовой. Для других возможны различные пути окисления (реакции – см. слайды)
Остатки тирозина окисляются АФК по двум путям с образованием тирозиновых димеров или 3,4-дигидроксифенилаланина (DOPA) (рис 6).
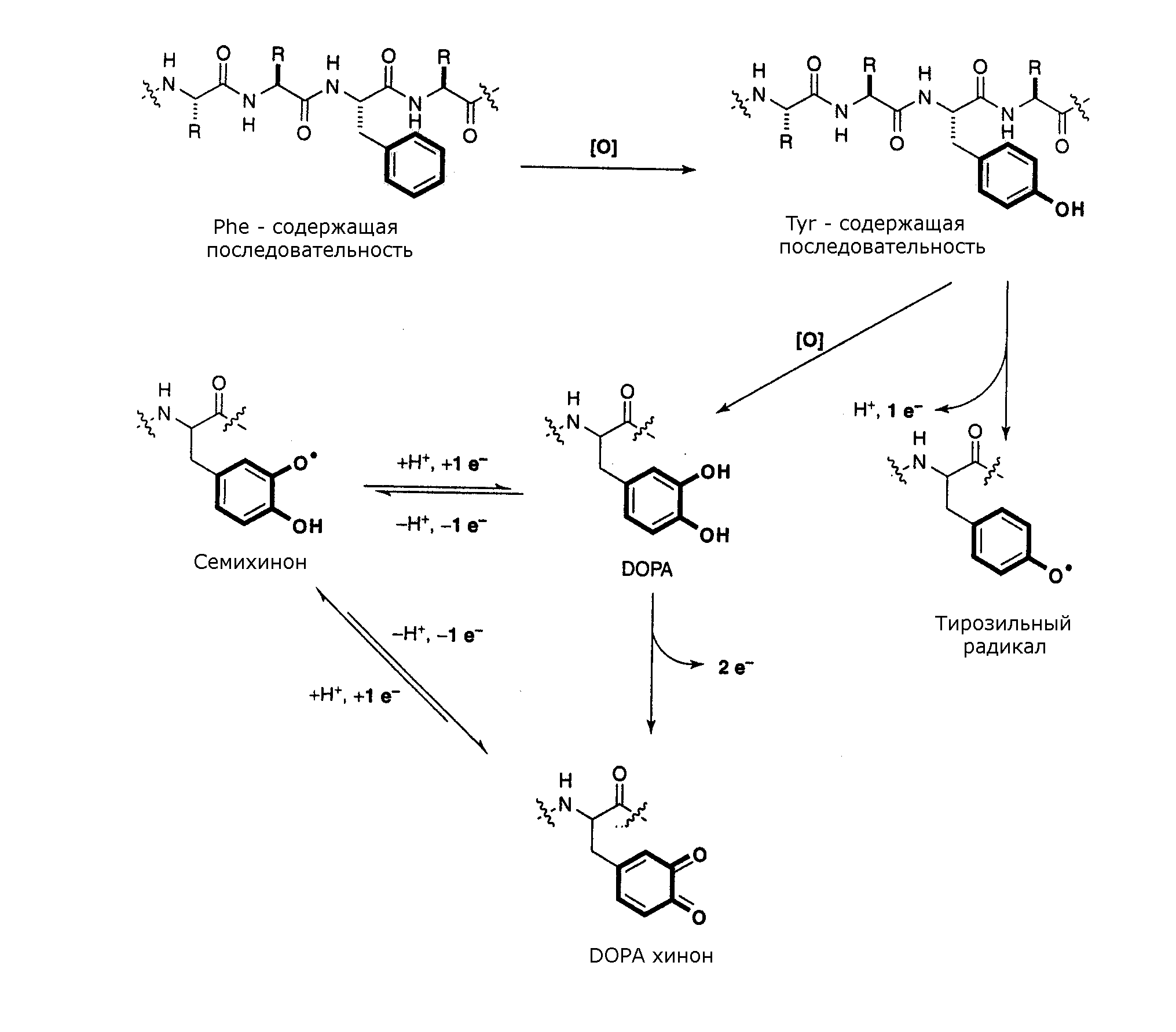
Рисунок 6. Пути окисления тирозина. Формирование редокс-активных соединений.
Полагают, что дитирозин, является наиболее перспективным биомаркером взаимодействия белков с АФК. А DOPA способен проявлять окислительно-восстановительную активность при обратимом переходе в форму семихинона, в связи с этим белки, содержащие это окисленное производное, способны к окислительно-восстановительным переходам. Поэтому считается возможным их участие в развитии ряда патологий, связанных со старением. В частности, предполагается, что они способны генерировать гидроксильные радикалы, катализируя реакцию Фентона.






