Состоит из белковых волокон и основного (аморфного) вещества.
В межклеточном веществе выделяют три основных типа волокон:
· коллагеновые;
· ретикулярные;
· эластические.
КОЛЛАГЕНОВЫЕ ВОЛОКНА
Коллагеновые волокнаобразованы белками коллагенами, которые являются наиболее распространенными белками организма. Характерная структура молекулы коллагена - длинная жесткая тройная спираль, которая состоит из 3-х скрученных спирально полипептидных цепей (α-цепей). Известны более 30 вариантов цепей, различных по химическому составу (типичные аминокислоты α-цепи: глицин, пролин, лизин, гидроксипролин). Варианты дают около 19 типов коллагена. Наиболее значение имеют пять первых типов (I-V). Коллагены I, II, III и Y типов являются фибриллярными, то есть они способны формировать нитевидные структуры - филаменты и фибриллы. Остальные коллагены, включая IY тип, этой способностью не обладают и являются аморфными (образуют плоские сети). Помимо фибробластов, коллаген могут синтезировать остеобласты, хондробласты, одонтобласты, цементобласты, ретикулярные клетки, гладкие миоциты.
Коллаген I типа характерен для рыхлой волокнистой соединительной ткани, дермы, костей, дентина, цемента, связок, сухожилий;
Коллаген II входит в состав хрящи, стекловидное тело глаза;
Коллаген III – ретикулярные волокна;
Коллаген IY – (нефибриллярный) образует базальные мембраны, капсулу хрусталика;
Коллаген Y – определяется в мышечных базальных мембранах, в стенках кровеносных сосудов, в коже, дентине.
Биосинтез коллагена включает внутриклеточный и внеклеточный этапы.
· Внутриклеточный этап включает: поглощение и транспорт необходимых аминокислот → синтез полипетидных α-цепей, посттрансляционные изменения, сборка трех α-цепей и образование проколлагена (в просвете грЭПС) → перенос в комплекс Гольджи, где происходит терминальное гликозилирование и упаковка в секреторные пузырьки → экзоцитоз молекул проколлагена в межклеточную среду.
· Внеклеточный этап включаетотщепление регистрационных пептидов с помощью специфических протеаз, связанных с плазмолеммой и образование молекул тропоколлагена толщиной 1,5 нм – нерастворимых, способных к самосборке. Далее происходит упорядоченная внеклеточная агрегация коллагеновых фибрилл толщиной 20-120 нм. Молекулы тропоколлагена связываются в продольные цепочки (микрофибриллы), располагаясь параллельно друг другу. При этом внутри каждой цепочки есть зоны зазора (промежутки); при этом в соседних цепочках молекулы тропоколлагена сдвинуты друг относительно друга на четверть длины. При окраске выявляется поперечная исчерченность (период 64-68 нм) коллагеновых фибрилл вследствие отложения красителя в зонах зазора. Коллагеновые фибриллы образуют коллагеновые волокна толщиной 1-20 мкм, которые могут объединяться в коллагеновые пучки (первичные, вторичные, третичные)
Морфология. Коллагеновые волокна- оксифильные, продольно исчерченные, извитые тяжи, лежат в ткани поодиночке или образуют пучки.
Основные функции коллагеновых волокон:
обеспечивают высокие механические свойства ткани (поскольку эти волокна - прочные и нерастяжимые);
обеспечивают структурную организацию (архитектонику) соединительной ткани;
обеспечивают взаимодействие между клетки и межклеточным веществом;
влияют на пролиферацию, дифференцировку, миграцию и функциональную активность различных клеток.
Поскольку ферментное гликозилирование пролина и лизина зависит от витамина С, наряду с другими симптомами, авитаминоз (цинга) характеризуется расшатыванием и выпадением зубов, из-за нарушения обновления коллагеновых волокон периодонтальной связки – главного элемента поддерживающего аппарата зуба.
РЕТИКУЛЯРНЫЕ ВОЛОКНА
Основа ретикулярных волокон – коллаген III типа. Ретикулярные волокна имеют малый диаметр (0.1-2 мкм) и образуют тонкие трехмерные сети. Каждое волокно образовано пучком коллагеновых микрофибрилл, заключенных в оболочку из гликопротеинов и протеогликанов. Из-за такой оболочки ретикулярные волокна, в отличие от коллагеновых, не окрашиваются эозином, а окрашиваются солями серебра, поэтому их часто называют аргирофильными волокнами.
Функция ретикулярных волокон - опорная: они образуют каркас миелоидной и лимфоидной тканей, оплетают базальные мембраны, окружают капилляры и нервные волокна, гладкомышечные клетки, образуют поддерживающую строму гепатоцитов.
ЭЛАСТИЧЕСКИЕ ВОЛОКНА
Эластические волокна наиболее многочисленны в участках, обладающих подвижностью: в подслизистой основе пищеварительного канала, в стенках артерий. Толщина эластических волокон 0.2-10 мкм; эти волокна ветвятся и анастомозируют друг с другом, образуя сети. В рыхлой соединительной ткани эластические волокна не образуют пучков.
Функция эластических волокон – обеспечение способности к обратимой деформации.
Главный белковый компонент эластических волокон – белок эластин. Молекулы эластина имеют в состоянии покоя форму скрученных нитей. При растяжении молекулы распрямляются, после нагрузки – закручиваются. Молекулы ковалентно сшиты в комплексы, формируют волокна и пластины (мембраны – в артериях).
Структура на электронно-микроскопическом уровне: в зрелом эластическом волокне выявляется центральный светлый аморфный компонент (эластин) и периферический микрофибриллярный компонент (тонкие волоконца гликопротеина фибриллина). Кроме зрелых собственно эластических волокон в эластическую систему входят волокна с меньшей степенью зрелости:
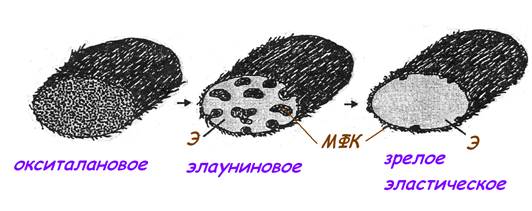
окситалановые, образованные микрофибриллами, сходными с периферическим компонентом зрелого волокна;
элауниновые, более зрелые, которые имеют островки микрофибрилл среди аморфного вещества.
По мере зрелости (в ходе эластогенеза) на фибриллярный компонент откладывается эластин, эластин (Э) накапливается, а микрофибриллярный компонент (МФК) постепенно оттесняется на периферию и разрушается.






