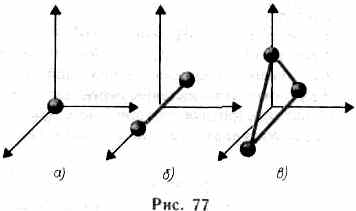
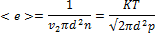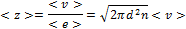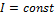Число степеней свободы – минимальное количество не зависящих друг от друга координат однозначно определяющих положение в пространстве.
Для жестких молекул: а) одноатомный – i= 3 (3 поступательные),
б) двухатомный - i= 5 (3 поступательные и 2 вращательные)
в) многоатомные - i= (3 поступательные и 3 вращательные)
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения < e 0> в (43.8):
Закон Больцмана о равномерном распределении энергии по степеням свободы: на каждую поступательную и каждую вращательную приходится одинаковая энергия  кГ; на каждую колебательную степень свободы приходится вдвое больше энергии
кГ; на каждую колебательную степень свободы приходится вдвое больше энергии
Для идеального газа колебательными степенями пренебрегают.
Закон Максвелла для распределения молекул идеального газа по скоростям их теплового движения. Средние скорости теплового движения частиц.
В газе молекулы движутся с разными скоростями Точно определить мгновенное значение скоростей невозможно. С точки зрения теории вероятности можно найти долю молекул, скорости которых лежат в интервале от v до v+dv, вот это отношение как v+dv имеет вид: 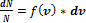 - (это не просто S английское, это функция, то есть интеграл)
- (это не просто S английское, это функция, то есть интеграл)
Закон Максвелла описывается некоторой функцией f (v), называемой функцией распределения молекул по скоростям.
Средние скорости теплового движения < vкв >= - средняя квадратичная скорость= 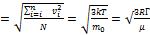 .
.
Средняя арифметическая скорость – это сумма всех скоростей молекул, деленное на число молекул. -
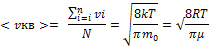
Наиболее вероятная скорость 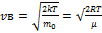
Барометрическая формула. Распределение Больцмана.
Барометрическая формула. Распределение Больцмана
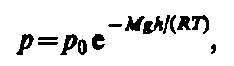
где р — давление на высоте h.
Прибор для определения высоты над земной поверхностью называется высотомером (или альтиметром). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Больцман обобщил барометрическую формулу для молекул газа находящихся в любом потенциальном поле и получил зависимость концентраций молекул от потенциального:
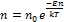 .
.
Среднее число столкновений и средняя длина свободного пробега молекул
Средней длинной свободного пробега называют расстояние, которое проходит молекула между двумя последовательными столкновениями.
Столкновениями считается – сближение молекул на расстоянии меньше или равное эффективному диаметру.