1-вая модель – это идеальный газ в котором пренебрегают собственным объемом молекул и их взаимодействием, а столкновение молекул друг с другом и с поверхностями считают обсалютно упругим.
Давление – это отношение силы, действующей перпендикулярно поверхности, к площади этой поверхности.
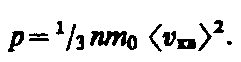 (43.3)
(43.3)
Выражение (43.3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что n =N / V, получим
 (43.4)
(43.4)
или
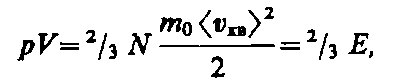 (43.5)
(43.5)
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm 0, то уравнение (43.4) можно переписать в виде
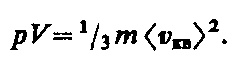
Для одного моля газа т=М (М — молярная масса), поэтому
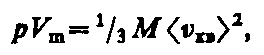
где V m — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pV m =RT. Таким образом,
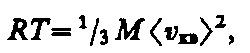
откуда
 (43.6)
(43.6)
Так как M=m 0 N А, где т 0 — масса одной молекулы, a N А — постоянная Авогадро, то из уравнения (43.6) следует, что
 (43.7)
(43.7)
где k=R/N А — постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода — 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Уравнение Клапейрона — Менделеева
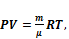 P – плотность газа, V – молярный объем, T – абсолютная температура, К. m – масса,
P – плотность газа, V – молярный объем, T – абсолютная температура, К. m – масса,
R – универсальная газовая постоянная (R = 8,3Дж⁄(моль∙К))
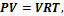
 молярная масса,
молярная масса,
 – менее обобщенное уравнение.
– менее обобщенное уравнение.
Средняя кинетическая энергия молекул. Внутренняя энергия идеальных газов.
Так, как молекулы принимают участие не только в поступательном, но и и во вращательном и поступательном движении энергия будет зависеть от числа степеней свободы.
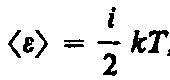
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:
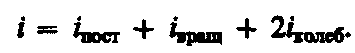
Внутренняя энергия идеального газа – суммарная кинетическая энергия всех молекул газа.
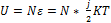

Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц.
Внутренняя энергия — однозначная функция термодинамического состояния системы, т. е. в каждом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, как система пришла в данное состояние). Это означает, что при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода.






