| Уравнение электродного процесса | Стандартный потенциал 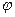 при 25оС при 25оС
| Уравнение электродного процесса | Стандартный потенциал 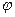 при 25оС при 25оС
|
| Li++e-=Li | -3,045 | Co2++2e-=Co | -0,277 |
| Rb++e-=Rb | -2,925 | Ni2++2e-=Ni | -0,250 |
| K++e-=K | -2,925 | Sn2++2e-=Sn | -0,136 |
| Cs++e-=Rb | -2,923 | Pb2++2e-=Pb | -0,126 |
| Ca2++e-=Ca | -2,866 | Fe3++3e-=Fe | -0,036 |
| Na++e-=Na | -2,714 | 2H++2e-=H2 | |
| Mg2++2e-=Mg | -2,363 | Bi3++3e-=Bi | 0,215 |
| Al3++3e-=Al | -1,662 | Cu2++2e-=Cu | 0,337 |
| Ti2++2e-=Ti | -1,628 | Cu++e-=Cu | 0,521 |
| Mn2++2e-=Mn | -1,180 | Hg22++2e-=2Hg | 0,788 |
| Cr2++2e-=Cr | -0,913 | Ag++e-=Ag | 0,799 |
| Zn2++2e-=Zn | -0,763 | Hg2++2e-=Hg | 0,854 |
| Уравнение электродного процесса | Стандартный потенциал 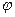 при 25оС при 25оС
| Уравнение электродного процесса | Стандартный потенциал 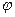 при 25оС при 25оС
|
| Cr3++3e-=Cr | -0,744 | Pt2++2e-=Pt | 1,2 |
| Fe2++2e-=Fe | -0,440 | Au3++3e-=Au | 1,498 |
| Cd2++2e-=Cd | -0,403 | Au++e-=Au | 1,691 |
Таблица 7. Растворимость кислот, солей, оснований в воде.
| Ионы | OH 
| NO 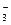
| F 
| Cl 
| Br 
| I 
| S 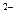
| SO 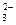
| SO 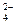
| CO 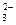
| SiO 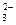
| PO 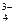
| CH 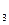 COO COO 
|
H 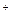
| P | P | P | P | P | P | P | P | P | H | P | P | |
NH 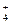
| P | P | P | P | P | P | P | P | P | P | - | P | P |
Li 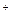
| P | P | P | P | P | P | P | P | P | P | P | H | P |
K 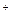
| P | P | P | P | P | P | P | P | P | P | P | P | P |
Na 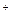
| P | P | P | P | P | P | P | P | P | P | P | P | P |
Ag 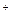
| - | P | P | H | H | H | H | M | M | H | H | H | P |
Ba 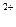
| P | P | M | P | P | P | - | M | H | H | H | H | P |
Ca 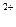
| M | P | H | P | P | P | - | M | M | H | H | H | P |
Mg 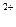
| M | P | M | P | P | P | - | M | P | H | H | H | P |
Mn 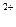
| H | P | P | P | P | P | H | H | P | H | H | H | P |
Zn 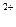
| H | P | M | P | P | P | H | M | P | H | H | H | P |
Ni 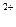
| H | P | P | P | P | P | H | H | P | - | H | H | P |
Sn 
| H | P | P | P | P | P | H | - | P | - | - | H | P |
Pb 
| H | P | M | M | M | H | H | H | H | H | H | H | P |
Cu 
| H | P | P | P | P | - | H | - | P | - | - | H | P |
Hg 
| - | P | - | P | M | H | H | - | P | - | - | H | P |
Hg 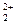
| - | - | M | H | H | H | H | - | M | H | - | H | M |
Fe 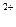
| H | P | M | P | P | P | H | M | P | H | H | H | P |
Fe 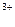
| H | P | H | P | P | - | H | - | P | - | - | H | P |
Al 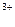
| H | P | M | P | P | P | - | - | P | - | - | H | P |
Cr 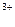
| H | P | M | P | P | P | - | - | P | - | - | H | P |
Таблица 8. Степени окисления s- и р- элементов.
| Группа | I | II | III | IV | V | VI | VII | VIII |
| s элементы | р элементы | |||||||
| Валентные электроны | s1 | s2 | s2р1 | s2р2 | s2р3 | s2р4 | s2р5 | s2р6 |
| Элемент Степени окисления | Li | Be | B | C 4,2 -4 | N 5,3 -3 | O -2 | F - -1 | Ne - - |
| Элемент Степени окисления | Na | Mg | Al | Si 4,2 -4 | P 5,3 -3 | S 6,4 -2 | Cl 1,3,5,7 -1 | Ar - - |
| Элемент Степени окисления | K | Ca | Ga | Ge 4,2 -4 | As 5,3 -3 | Se 6,4 -2 | Br 1,3,5,7 -1 | Kr 2,4 - |
| Элемент Степени окисления | Rb | Sr | In | Sn 4,2 -4 | Sb 5,3 -3 | Te 6,4 -2 | I 1,3,5,7 -1 | Xe 2,4,6,8 - |
| Элемент Степени окисления | Cs | Ba | Tl 1,3 | Pb 2,4 -4 | Bi 3,5 -3 | Po 4,6 -2 | At 5,7 -1 | Rn (2,4,6,8) - |
Серым выделены символы неметаллов
Таблица 9. Основные классы неорганических веществ.
| Вещества | Классификация | Примеры | |
| Простые | Металлы | s– элементы (кроме Н, Не) р – элементы Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi d – элементы f – элементы | |
| Неметаллы | s– элементы Н, Не р – элементы B, C, Si, N, P, As, O, S, Se, Te галогены (VII A группа) благородные газы (VIII A группа) | ||
| Сложные | Бинарные соединениия | гидриды карбиды нитриды оксиды сульфиды галиды | LiH, NaH, CaH2, AlH3 Be2C, CaC2, Al4C3 Na3N, Mg3N2, Si3N4 Na2O, CaO, Al2O3, SO3 K2S, ZnS, Fe2S3 NaCl, BaCl2, FeCl3 |
| Гидроксиды | кислоты основания амфолиты (амфотерные) | HNO3, H2SO4, H3PO4 KOH, Ba(OH)2, Ni(OH)3 Э(ОН)n = Н nЭОn Форма основания: Zn(OH)2, Al(OH)3, Be(OH)2 Форма кислоты: H2ZnO2, H3AlO3, H2BeO2 | |
| Соли | средние кислые сновные | NaNO3, Al2(SO4)3, K3PO4, KCl NaHSO4, KH2PO4, Ca(HCO3)2 MgOHCl, (CuOH)2SO4, Fe(OH)2Cl |
Таблица 10. Взаимосвязь простых веществ, оксидов,






