1. Для кислот эквивалентное число равно числу замещаемых в конкретной реакции ионов водорода, а для оснований - числу замещаемых гидроксид-ионов.
Пример: Са(ОН)2 + 2 НСl = СаСl2 + 2 Н2О
Э(Са(ОН)2) = 1/2 Са(ОН)2; Э(НСl) = 1 НСl
2. Эквивалентное число соли равно произведению количества замещаемых катионов металла на их заряд или произведению числа замещаемых анионов кислотных остатков на модуль их заряда.
Аl Сl3 + 3 Аg NО3 = Аl (N О3)3 + 3 Аg Сl
Э (Аl Сl3) = 1/3 Аl Сl 3; Э (АgNО3) = 1 АgNО3.
3. Эквивалентное число оксида равно произведению числа атомов элемента на валентность элемента. Пример:
Аl2О3; Э (Аl2О3) = 1/6 Аl2О3.
4. Эквивалентное число в окислительно - восстановительных реакциях определяется числом электронов, которые отдает или принимает частица восстановителя или окислителя.
К2Сr2O7 + 14 H Cl = 2 Cr Cl3 + 7 H2O + 2 KCl + 3 Cl2

 1 2 Cr2O7 2- + 14 H+ + 6e- ® 2 Cr3+ + 7 H2O
1 2 Cr2O7 2- + 14 H+ + 6e- ® 2 Cr3+ + 7 H2O
3 6 2 Cl- - 2e- ® Cl2
Z (K2Cr2O7) = 6; Z (Cr Cl3) = 3; Z (HCl) = 1; Z (Cl2) = 2.
Количество вещества - это число структурных элементов (атомов, молекул, ионов, эквивалентов) в системе. Единицей измерения количества вещества является моль.
Моль - количество вещества системы, которое содержит столько структурных элементов (молекул, эквивалентов и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12.
Число структурных единиц в моле называют числом Авогадро и для практических расчетов принимают равным 6,02 · 1023.
Массу одного моля вещества называют молярной массой М. Численно молярная масса равна молекулярной, но измеряется в г/моль. Например, молярная масса аммиака M(NH3) = 17 г/моль.
Молярную массу эквивалентов вещества В (в г/моль) можно рассчитать, исходя из молярной массы вещества, по формуле:
Мэ (В) =  .
.
Количество вещества эквивалентов (в моль) находят отношением массы вещества к молярной массе его эквивалента:
nэ (В) = m(В)/Мэ(В)
Количественные соотношения между эквивалентами веществ, участвующих в химической реакции, задаются законом эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ.
Согласно этому закону для реакции А + B = C + D должно выполняться соотношение: пэ (А) = пэ (В) = пэ (С) = пэ (D),
где nэ(Х) – количество молей эквивалентов соответствующего вещества.
Таким образом, для взаимодействующих веществ А и В можно записать:
nэ (А) == nэ(В)
или подставив значение nэ, получим
 =
=  ;
;  =
= 
Пример 1. Определите молярную массу эквивалентов СаСО3.
Решение: СаСО3 - средняя соль.
Z (СаСО3) = 1(число катионов кальция) ∙ 2(заряд катиона) = 2
Мэ (СаСО3) = 
 =
= 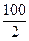 =50 г/моль.
=50 г/моль.
Ответ: молярная масса эквивалентов СаСО3 равна 50 г/моль.
Пример2. Вычислите молярную массу эквивалентов магния, если 60 г его вытеснили из кислоты 56 л водорода (н.у.).
Решение: Mgo + 2H+ → Mg+2 + H2
По закону эквивалентов nэ(Mg) = nэ(Н2),
Выразив количество молей эквивалентов магния через массу магния, а количество молей эквивалентов газообразного водорода через объем газа, получаем выражение: 
Преобразуем выражение Mэ(Mg) = 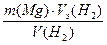 ;
;
Число эквивалентности Z(H2)=2; Vэ= 22,4/2=11,2 л
Mэ(Mg) =  = 12 г/моль
= 12 г/моль
Пример 3. При окислении щелочно-земельного металла массой 5г образуется оксид массой 7 г. Назовите этот металл.
Решение: 2Ме + О2 = 2МеО
По закону эквивалентов 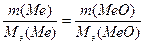 ;Мэ(МеО) = Мэ(Ме) + Мэ(О)
;Мэ(МеО) = Мэ(Ме) + Мэ(О)
Z(O) = 2; Мэ(О)=16/2 = 8 г/моль; обозначим Мэ(Ме)= x
 ; решив уравнение, получаем Мэ(Ме)= 20 г/моль для двухвалентного щелочно-земельного металла Z(Ме)=2;
; решив уравнение, получаем Мэ(Ме)= 20 г/моль для двухвалентного щелочно-земельного металла Z(Ме)=2;
М(Ме)= Мэ(Ме) ∙ Z(Ме) = 20 ∙ 2 = 40 г/моль
Определяемый металл – кальций.
Контрольные вопросы:
1. Определите молярные массы эквивалентов H2SO4 и Сu(ОН)2 в следующих реакциях:
а) H2SO4 + 2KOH = K2SO4 + 2H2O
б) H2SO4 + KOH = KHSO4 + H2O
в) Cu(OH)2 + 2HCl = CuCl2 + 2H2O
г) Cu(OH)2 + HCl = CuOHCl + H2O
2. Сколько молей эквивалентов содержится в а) 24,5 г H2SO4;
б) 12,3 г Н3РО4; в) 150 г СаСО3; г) 8,6 гCaSO4 ∙2Н2О; д) 79 гKA1(SO4)2 ∙12Н2О.
3. Рассчитайте молярную массу эквивалентов кислоты, если на нейтрализацию 0,009 кг ее израсходовано 0,008 кг гидроксида натрия.
4. Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла.
5. На нейтрализацию 0,471 г фосфористой кислоты израсходовано
0,644 г КОН. Вычислите молярную массу эквивалентов кислоты.
6. Определите молярную массу эквивалентов следующих соединений: Mn2O7, Cu2O, Са(ОН)2, A12(SO4)3∙18H2O, Ca3(PO4)2, Ag2O, FeSO4∙7H2O, Cu3 PO4.
7. При нагревании 20,06 г металла было получено 21,66 г оксида. Найдите молярную массу эквивалентов металла, если молярная масса эквивалентов кислорода равна 8 г/моль.
8. Вычислите молярную массу эквивалентов цинка, если 1,196 г его вытеснили из кислоты 438 мл водорода, измеренного при 17 °С и давлении
1 атм.
9. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (н. у.).
10. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить молярные массы эквивалентов металла и его оксида.
11. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, число эквивалентности которого равно 2?
12. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определить молярную массу эквивалентов кислоты.
13. В каком количестве NaOH содержится столько же молей эквивалентов, сколько в 140 г КОН?
14. В каком количестве Ва(ОН)2∙8Н2О содержится столько же молей эквивалентов, сколько в 156 гА1(ОН)3?
15. 0,493 гхлорида некоторого металла после обработки нитратом серебра образовали 0,861 г AgCl. Вычислить мольную массу эквивалентов металла.
16. Из 0,432 гметалла образовали 0,574 гего хлорида. Вычислить молярную массу эквивалентов металла, приняв молярную массу эквивалентов хлора равной 35,5 г/моль.
17. При пропускании сероводорода через раствор, содержащий 2,98 г хлорида некоторого одновалентного металла, образуется 2,2 г его сульфида. Вычислите молярную массу эквивалентов металла.
18. При сгорании трехвалентного металла массой 11,2 г образовался оксид массой 16 г. Какой был взят металл?
19. Сколько литров СО2 (при н.у.) надо пропустить через раствор Са(ОН)2, чтобы получить: а) 7 молей эквивалентов карбоната кальция; б) 7 молей карбоната кальция;
в) 100 г карбоната кальция?
20. Сколько молей эквивалентов оксида цинка получится при взаимодействии цинка с кислородом объемом 5,6 л (н.у.)






