Разные буферные растворы из области буферного действия не в равной мере эффективно противостоят изменению рН в результате добавок сильной кислоты или щёлочи. Мерой устойчивости буферного раствора к указанным выше внешним воздействиям является его буферная ёмкость.
Буферной ёмкостью раствора с заданным значением рН называется число молей эквивалентов сильной кислоты или щёлочи, которые нужно добавить к 1 дм3 данного буферного раствора, чтобы изменить его рН на единицу и обозначается:
по кислоте Вк , моль Н+ / дм3 буф. р-ра;
по щёлочи Вщ , моль ОН- / дм3 буф. р-ра.
Рассчитанную таким образом буферную емкость называют теоретической буферной емкостью.
Буферная ёмкостьраствора зависит как от исходного значения рН раствора, так и от абсолютных концентраций (количеств) кислоты и сопряжённого основания в нём. Заметим, что согласно уравнениям (6.1–6.3), величина рН буферного раствора определяется только отношением

и не зависит от абсолютных значений этих величин.
1) зависимость буферной ёмкости от рН представлена на рисунке, из которого видно, что наиболее устойчивы растворы со значением рН близким к рК сопряженной кислоты:
а) кислотный буфер:

б) основный буфер – форма зависимости сохраняется, а экстремум кривой приходится на значение рН = 14 - рКb.
2) увеличение абсолютных концентраций (количеств) компонентов буферного раствора с одним и тем же значением рН увеличивает их буферную ёмкость.
Если приготовить, например, три буферные системы, которые подчиняются приведённым ниже требованиям:
| I | II | III | ||
| nкў | < | nкўў | < | nкўўў |
| nосн ў | < | nоснўў | < | nоснўўў |
причём 
| например |  , ,
|
то согласно уравнению (2) эти растворы будут иметь одинаковые значения рН, но разную буферную ёмкость: Вў< ВІ< ВІў.
Экспериментальное определение буферной ёмкости связано с измерением рН буферного раствора на рН – метре до и после внесения добавки сильной кислоты или щёлочи к заданному объёму V буф.
а) для буферного раствора объёмом V буф. измеряют рН(нач), вносят добавку кислоты:

обычно вносят небольшой объём концентрированного раствора сильной кислоты, который практически не изменяет величину V буф, т.е. V доб << V буф; измеряют рН(кон.) и определяют
ЅDрН Ѕ= ЅрН(кон) - рН(нач)Ѕ.
Найденные величины подставляют в расчётную формулу:
 (6.9)
(6.9)
б) аналогично определяют буферную ёмкость по щёлочи:
 (6.10)
(6.10)
Расчет теоретической буферной ёмкости по кислоте для данного буферного раствора можно осуществить на основе уравнения (6.7), если положить в нём
pH(кон) = рН(нач) – 1,
и далее рассчитать величину добавки кислоты в количестве х моль, которая приведет к уменьшению рН на единицу в буферном растворе, содержащем первоначально n осн и n к моль сопряженных основания и кислоты, причем далее эта добавка пересчитывается на 1 дм3 буферного раствора:

где V буф, см3 – объём буферного раствора содержащего n осни n к моль сопряженных основания и кислоты.
Аналогично проводят расчёт буферной ёмкости по щёлочи с использованием уравнения (6.8), в котором полагают pH(кон.) = рН(нач.) + 1. Дальнейший расчёт аналогичен предыдущему.
ОБУЧАЮЩИЕ ЗАДАЧИ
1. Определить рН ацетатного буферного раствора, приготовленного путем смешивания 100 см3 раствора уксусной кислоты (НAс) с молярной концентрацией 0,1 моль/дм3 и 200 см3 раствора ацетата натрия (NaAc) с молярной концентрацией 0,2 моль/дм3. Как изменится рН при добавлении к нему 30 см3 0,2М раствора NaOH?
Решение:
а) Рассчитаем количество компонентов в буферном растворе:
| n к(буф) (НАс) = 0,1 Ч 0,1 = 0,01 моль | 
| подставляем в уравнение Г-Х (5.1): |
| nосн (буф) (NaAc) = 0,2 Ч 0,2 = 0,04 моль |
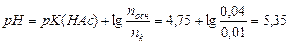
б) Рассчитаем число моль ионов ОН, - внесённых с добавкой щелочи:
n (ОН-) = c (NaOH) Ч V доб = 0,2 Ч 0,03 = 0,006 [моль]
В результате связывания ионов ОН- кислотой НАс происходит, изменение количеств сопряжённых кислоты и основания в буферном растворе:
| n кў(НАс) = 0,01 – 0,006 = 0,004 моль | 
| подставляем в уравнение Г-Х (6.1): |
| n оснў(NaAc) = 0,04 + 0,006 = 0,046 моль |

2. Необходимо приготовить буферный раствор с рН = 4,3. В распоряжении имеются муравьиная и угольная кислоты, гидроксид натрия. Какие вещества и в каких молярных соотношениях следует смешать для приготовления нужного раствора?
Решение:
а) Проведём анализ возможных буферных систем, которые можно приготовить на основе указанных в задаче веществ:
| область буферного действия | |||
| Формиатный буферный раствор |  HCOONa
HCOOH HCOONa
HCOOH
| рК = 3,75 Ю | рН = от 2,75 до 4, 75 |
| Гидрокарбонатный буфер |
 NaHCO3
H2CO3 NaHCO3
H2CO3
| рК1 = 6,37 Ю | рН = от 5,37 до 7,37 |
| Карбонатный буфер |
 NaHCO3
Na2CO3 NaHCO3
Na2CO3
| рК2 =10,32 Ю | рН = от 9,32 до 11,32 |
Величина рН заданного буферного раствора лежит в области буферного действия формиатного буферного раствора, поэтому для его приготовления необходимо взять муравьиную кислоту и гидроксид натрия.
б) Буферный раствор с заданным значением рН готовят методом частичной нейтрализации муравьиной кислоты гидроксидом натрия.
| HCOOH | + | NaOH | ® | HCOONa | + | H2O | |
| начало | n к | > | х | ||||
| окончание | n к – х | х |
где n к – количество кислоты в исходном растворе, х – количество добавленного NaOH, приводящее к формиатному буферному раствору с рН = 4,3. Дальнейший расчёт ведут по уравнению Г-Х (1):

Таким образом, для приготовления буферного раствора с рН = 4,3 количество муравьиной кислоты должно превышать необходимое количество гидроксида натрия в 1,28 раза.
Лабораторная работа №3






