Пусть равновесная молярная концентрация насыщенного раствора электролита АnBm над осадком равна S, а весь растворенный электролит полностью находится в диссоциированном виде (a = 1), тогда
| АnBm (осадок) | Û | АnBm (нас. р-р) | ® | n Az+ (р-р) | + | m Bz- (р-р) |
| Равновесие: | S моль/дм3 | [Аz+] = nS | [Bz-] = mS |
Из выражения для произведения растворимости
ПР (АnBm) = [Аz+]n∙ [Bz-]m = (nS)n∙ (mS)m = nn ∙ mm ∙ Sn+m (7.2)
молярная растворимость электролита S (АnBm), [ моль/дм3 ] равна
 ,
, 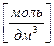
Если установлена молярная растворимость малорастворимого соединения, легко вычислить его массовую концентрацию в насыщенном над осадком растворе:
ρ(АnBm) = S × M(АnBm),  (7.3)
(7.3)
а также массу каждого из ионов малорастворимого соединения в насыщенном над осадком растворе:
m (Аz+) = nS М(Аz+),  (7.4)
(7.4)
m (Bz-) = mS М(Bz-),  (7.5)
(7.5)
Условия смещения ионного гетерогенного равновесия
Смещение ионного гетерогенного равновесия происходит в соответствии с принципом Ле-Шателье в направлении наиболее полного связывания ионов. Изменение концентрации ионов малорастворимого соединения в насыщенном над осадком растворе, особенно одноименных, приводит к существенному изменению растворимости осадка, при этом величина ПР остается неизменной. Из этой закономерности вытекают следующие четыре правила, лежащие в основе:
– образования осадка;
– растворения осадка;
– последовательности осаждения ионов;
– достижения полноты осаждения ионов.
Образование осадка.
Осадок малорастворимого соединения АnBm выпадает из пересыщенного раствора, когда стехиометрическое произведение молярных концентраций его ионов в растворе станет больше величины ПР (АnBm), т.е., выполняется неравенство:
сn(Аz+) ∙ сm(Bz-) > ПР (АnBm) (7.6)
Выпадение осадка продолжается до тех пор, пока раствор не станет насыщенным.
Растворение осадка.
Осадок малорастворимого соединения АnBm начнет растворяться в том случае, если раствор над ним станет ненасыщенным, когда стехиометрическое произведение молярных концентраций его ионов в растворе станет меньше величины ПР (АnBm), т.е., выполняется неравенство:
сn(Аz+) сm(Bz-) < ПР(АnBm) (7.7)
Создать условия для растворения осадка малорастворимого электролита можно за счет химического связывания хотя бы одного их его ионов в растворе над осадком в комплексное соединение или другое менее диссоциируемое соединение или путем изменения степени окисления одного из ионов (обоих) малорастворимого соединения, или другим способом.
Примеры:
1)Малорастворимые соли слабых кислот, например, карбонаты и фосфаты, растворяются в сильных кислотах, где вносимые ионы Н+ связывают анионы солей в малодиссоциирующие соединения:
| BaCO3(осадок) | Û | BaCO3(нас. р-р) | ® | 3 Ba2+ (р-р) | + | 2 СO32– (р-р) |
| СO32–(нас. р-р) | + | 2 Н+(добавка) | ® | Н2СО3 | ® | СО2↑ + Н2О |
Заметим, что малорастворимый сульфат бария ВаSО4 в кислотах не растворяется – почему?
2) Малорастворимый гидроксид алюминия Al(OH)3 можно растворить как в сильных кислотах, так и в щелочах за счет связывания иона ОН– в воду, а иона Al3+ в комплексное соединение:
| Al(OH)3 (осадок) | Û | Al(OH)3 (нас. р–р) | → | Al3+(р–р) | + | 3ОН–(р–р) |
| Al3+(р–р) | + | 4ОН–(добавка) | → | [Al(OH)4]–(р–р) | ||
| ОН–(р–р) | + | Н+(добавка) | → | Н2О |
3) Осадок хлорида серебра растворяется в водном растворе аммиака, т.к. взаимодействуя с аммиаком, образует водорастворимый комплекс [Ag(NH3)2Cl], устойчивый при избытке аммиака в растворе.
Подавить растворимость малорастворимого электролита можно, если в насыщенный раствор внести растворимый сильный электролит, при диссоциации которого образуются ион, одноимённый с ионом малорастворимого электролита.






