Тотығу-тотықсыздану потенциалына тотығу – тотықсыздану жұбына кіретін бір, не екі компоненттің бәсекелес комплекстүзу реакциясына қатысуы өте үлкен әсер етеді. Себебі жүйедегі комплекс түзетін компоненттің активтігі азаяды.
Мысалы, аммиакті ортада Ag+/Ag жұбын қарастырайық. Жартылай тотығу – тотықсыздану реакциясы Ag++e→Ag, электродты потенциалдың теңдігі:
Е=Е0+0,059 lg aAg+ =Е0 + 0,059 lg fAg+ + 0,059 lg [Ag+]
Күміс иондарының аммиакті ортада комплекс түзетінін еске алсақ:
Ag++NH3↔Ag(NH3)+ β1=103, 32
Ag++2NH3↔[Ag(NH3)2]+ β·β1,2 =107, 24
CAg+= [Ag+] + [Ag(NH3)+]+ [Ag(NH3)2+]=
= [Ag+] + β1 ∙[Ag+]∙[NH3]+ β1,2 ∙[Ag+]∙[NH3]2
CAg+ /[Ag+] =1+ β1 ∙ [NH3]+ β·β1,2 ∙[NH3]2= 1/α Ag+
[Ag+] = α Ag+∙ CAg+ ; Е=Е0+0,059 lg f Ag+ + 0,059 lg α Ag+ + 0,059 lg C Ag+
Ерітіндінің иондық күші және лигандтың (NH3) концентрациясы тұрақты болғанда реалды (шартты) стандартты потенциал:
Е01=Е0+0,059 lg f Ag+ + 0,059 lg α Ag+ , осыдан Е=Е01+ 0,059 lg CAg+;
потенциалдың мәні жалпы күміс иондарының концентрациясына тәуелді.
Ерітіндінің иондық күші және аммиактың концентрациясы 0,1М сәйкес болғандағы Е 01Ag мәнін табайық:
 Е01 =0,80 +0,059 lg 0,76+ 0,059 lg 10-5,24 = 0,80-0,007-0,309=0,484 B
Е01 =0,80 +0,059 lg 0,76+ 0,059 lg 10-5,24 = 0,80-0,007-0,309=0,484 B
Комплекс түзілу реакциясы жүргенде потенциалға ерітіндінің иондық күшінің әсері шамалы, сондықтан оны еске алмаса да болады.
Fe3+/Fe2+ жұбының ЭДТА-ның артық мөлшері жүргендегі реалды (шартты) потенциалын анықтайық:
Fe2++Y4- ↔ [FeY]2- β1=2∙1014
 [Fe2+]= C Fe2+∙ α Fe2+;
[Fe2+]= C Fe2+∙ α Fe2+;
Fe3++Y4- ↔ [FeY]- β2=1,3∙1025
 [Fe3+]= C Fe3+∙ α Fe3+;
[Fe3+]= C Fe3+∙ α Fe3+;

Жалпы түре Mn+ + ne↔M жүйесінің L лигандымен комплекстүзу реакциясын еске алғанда ML, ML2, ML3 ….MLn
СМ=[Mn+]+ [ML]+ [ML2]+……………….... [MLn];
[Mn+] / СМ= αM, осыдан [Mn+] = СМ∙ αM


Mn+/ Mm+ (n>m) жүйесіне Mn++ (n-M) ē ↔ MM+
C Mn+ = C ox , C MM+ = C red деп алайық. Сонда:
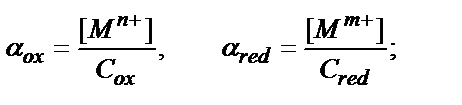
 ,
, 
 .
.
Тағы бір еске алатын жағдай лигандтың артық мөлшері жүргенде βn мәні β1, β2, β3 …….. βn-1 аралық комплекстердің мәнінен көп болса βn» βn-1……. β3, β2, β1, есептеуге тек βn мәнін алады.
Мысалы, Fe3+/Fe2+ жұбы KCN ерітіндісінде:
Fe3+ + 6CN- ↔ [Fe(CN)6]3- 
Fe2+ + 6CN- ↔ [Fe(CN)6]4- 

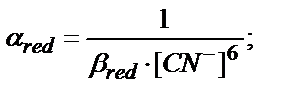
Тұнба түзу реакциясының әсері
Тотығу – тотықсыздану жұбының бір компонентімен бәсекелес тұнба түзу реакциясы сол компоненттің активтігін азайтып, тотығу тотықсыздану потенциалын өзгертеді. Бәсекелес реакцияның әсерін алынған тұнбаның ерігіштік көбейтіндісін пайдаланып ескеруге болады. Мысал ретінде Ag+/Ag жұбы потенциалының осы жүйеге хлорид иондарын қосқандағы өзгеруін қарастырайық:
Е=Е0 + 0,059 lg а Ag+ (9.9)
Хлорид иондарын қосқанда AgCl тұнбасы пайда болады:
ЕКAgCl = аAg+ ∙ аCl- =1,78∙10-10
Ерігіштік көбейтіндісінің мәнінен аAg+ = ЕКAgCl / аCl- (9.10)
(9.10) теңдіктің мәнін (9.9) теңдікке қойсақ:

яғни потенциал мәні хлорид иондарының концентрациясына тәуелді теңдік алынады:
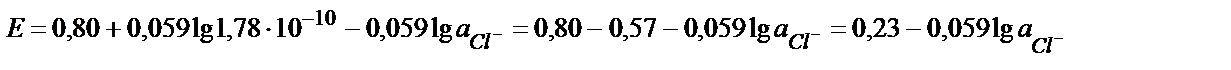
0,23 В (AgCl +е → Ag + +Cl-) жартылай реакциясына сәйкес, сондықтан бұл электрод хлор-күмісті электрод деп аталады: Ag, AgCl/Cl- ; а Cl- =1 моль/л болғанда Е0=0,23В. Калий хлоридінің қаныққан ерітіндісінде Е0 Ag, AgCl/Cl- = =0,199 В. Хлор – күмісті электродтың потенциалы хлорид – ионының концентрациясы өзгермесе белгілі температурада тұрақты мән, сондықтан мұндай электрод әртүрлі жүйелердің потенциалын өлшеуде салыстырмалы электрод ретінде пайдаланылады.






