Әрекеттесет≥н заттардың б≥реу≥нен ек≥нш≥с≥не электрондардың ауысуы нәтижес≥нде тотығу дәрежелер≥ өзгер≥п жүрет≥н реакци€ларды тотығу Ц тотықсыздану, не редокс реакци€лар дейд≥. Ёлектрондарды қосып алатын бөлшектер тотықтырғыштар деп аталады, өздер≥ тотықсызданады. Ёлектрондарды бер≥п ж≥берет≥н бөлшектер тотықсыздандырғыштар деп аталады, өздер≥ тотығады.
“отығу Ц тотықсыздану реакци€ларында тотықсыздан≠дырғыштар берген электрондар мен тотықтырғыштар қосып алған электрондардың саны тең болу керек.
“отығу Ц тотықсыздану реакци€сын жартылай тотығу және жартылай тотықсыздану реакци€ларына бөлуге болады. ћысалы:
2 Fe 3+ + Sn 2+ ↔2 Fe 2+ + Sn4+ (9.1)
Ѕұл реакци€ның жартылай тотығу реакци€сы
Sn 2+ Ц 2е → Sn4+, не Sn 2+ → Sn4+ + 2е (9.2)
жартылай тотықсыздану реакци€сы
Fe 3+ + е → Fe 2+ /*2 2 Fe 3+ + 2е → 2 Fe 2+ (9.3)
∆артылай реакци€ға к≥рет≥н заттар тотығу Ц тотықсыздану жұбын түзед≥ (Sn4+/ Sn 2+, Fe 3+/ Fe 2+ ). Ѕұл жұптың б≥р компонент≥ тотыққан түр≥ (Sn4+, Fe 3+ ), ек≥нш≥ компонент≥ тотықсызданған түр≥ (Sn 2+ , Fe 2+ ) болып табылады.
“отығу және тотықсыздану реакци€лары қатар жүред≥, Sn 2+ жоғалтқан электрондарды Fe 3+ қосып алады.
≈гер реакци€ға құрамында оттег≥ бар күрдел≥ бөлшектер қатысса атомдардың санын теңест≥ру үш≥н жартылай реакци€ға сутег≥ иондары, гидроксил иондары не судың молекулалары к≥ру≥ мүмк≥н. ћысалы,
Fe 2+ + MnO4- →Fe3+ +Mn 2+
“отықтырғыш ћnO4- реакци€ның нәтижес≥нде оның тотықсызданған түр≥ Mn 2+ -ке айналады. ћnO4- → Mn 2+ . “еңд≥кт≥ң ек≥ жағындағы атомдардың санын теңест≥ру үш≥н жартылай реакци€ның оң жағына төрт су молекуласы жазылады, осыған байланысты теңд≥кт≥ң сол жағына сег≥з сутег≥ иондары жазылады:
ћnO4- + 8Ќ+ → Mn 2+ + 4Ќ2ќ
ќсы жүйен≥ң тотығу Ц тотықсыздану жұбы ћnO4-, 8Ќ+/Mn2+. «ар€дтардың санын теңест≥ру үш≥н тепе теңд≥кт≥ң сол жағына бес электрон қосылады:
ћnO4- + 8Ќ+ +5е → Mn 2+ + 4Ќ2ќ (9.4)
≈к≥нш≥ жартылай реакци€
Fe 2+ -1e →Fe3+ не Fe 2+ →Fe3++ 1e (9.5)
Қосып алатын электрондар мен бер≥лет≥н электрондардың санын теңест≥ру үш≥н (9.5) реакци€ беске көбейт≥лед≥:
5Fe 2+ -5e → 5 Fe3+
(9.4) және (9.5) реакци€ларын қорытып жазғанда:
|
|
|
| ћnO4- + 8Ќ+ +5е → Mn 2+ + 4Ќ2ќ Fe 2+ -1e →Fe3+ | |
| ћnO4- + 8Ќ+ +5 Fe 2+ → Mn2+ + 4Ќ2ќ + 5Fe3+ |
“отығу Ц тотықсыздану жұбына бейтарап атомдар да к≥ру≥ мүмк≥н. ћысалы:
Cu2+ + Zn0 →Cu0 +Zn2+
∆артылай реакци€лар
Cu2+ + 2е →Cu0
Zn0 -2е → Zn2+ не Zn0 →Zn2+ + 2е
“отығу-тотықсыздану жұптары Cu2+/ Cu0, Zn2+/ Zn0.
“отығу-тотықсыздану жартылай реакци€ларының б≥р ерекшел≥г≥- электрондардың ауысуы және жалпы тотығу-тотықсыздану реакци€лары тотықтырғыш пен тотықсыздандырғышты б≥р б≥р≥нен бөлгенде де жүред≥, тек электрондар ауысатын өтк≥зг≥ш және ек≥ жүйен≥ң арасында иондар ауысатын мүмк≥нш≥л≥к болу керек. ќл үш≥н ек≥ ер≥т≥нд≥н≥ тұзды көп≥ршемен жалғастырады. “ұзды көп≥рше Ц электролитпен толтырылған и≥лген шыны түт≥кше.
9.1-суретте көрсет≥лген ек≥ жартылай тотығу-тотықсыздану жұбынан тұратын жүйен≥ гальваникалық элемент деп атайды. √альваникалық элементте хими€лық энерги€ электр энерги€сына айналады. Ѕұл гальваникалық элементт≥ сызба түр≥нде былай жазуға болады (+) Cu / Cu2+//Zn2+/Zn (-).
|
+ -
Cu 2 Zn
Cu2++2e |
| V |
| Cu2+ SO42- |
| SO42- Zn2+ |
9.1 Ц сурет. √альваникалық элемент.
1-жартылай элементтер. 2-тұзды көп≥рше. 3-вольтметр.
—ызбада ек≥ жартылай элемент б≥р б≥р≥мен ек≥ т≥к сызықпен бөл≥нген, жартылай элементт≥ң тотыққан және тотықсызданған түр≥ б≥р т≥к сызықпен бөл≥нген. ¬ольтметр гальваникалық элементт≥ң электр қозғағыш күш≥н (ЁҚ ) көрсетед≥. ЁҚ = (≈1 - ≈2), ≈1Ц тотықтырғыш потенциалы, ≈2Ц тотықсыздандырғыштың потенциалы. 9.1-суретте келт≥р≥лген гальвани≠калық элементте электрод рол≥н тотығу-тотықсыздану жұбының (Cu2+/ Cu0, Zn2+/ Zn0) б≥реу≥ атқарады: Cu және Zn. ≈гер электрод рет≥нде инертт≥ металл платина пластинасын алса, электрондар ауысуы осы металдың бет≥нде жүред≥:
Pt / Fe 3+ (Fe2+) // (Sn4+)Sn2+ / Pt
Fe3+ + 1e → Fe 2+ Sn2+ -2е → Sn4+
Sn2+ иондарының тотығуы нәтижес≥нде бөл≥нген электрон≠дар платина пластинкасының бет≥нен өтк≥зг≥ш арқылы ек≥нш≥ платина электродына ауысады да, оның бетк≥ қабатында Fe 3+ иондары тотықсызданады. Ѕағытталған тотығу-тотықсыздану реакци€сы, €ғни электрондардың ауысуы тепе-теңд≥к орнағанша жүред≥:
2Fe3+ + Sn2+ ↔2 Fe 2+ + Sn4+
∆алпы реакци€ның теңд≥г≥ және тепе-теңд≥к жағдайы процест≥ң қай жолмен жүрген≥не байланысты емес.
Әр қосылыстың тотығу не тотықсыздану қаб≥летт≥г≥ б≥рдей емес. ќлардың тотығу, тотықсыздану қаб≥летт≥г≥н көр≠сете≠т≥н шама Ц вольтпен өлшенет≥н тотығу-тотықсыздану потенциалы (электродты потенциал). ∆еке жартылай реакци€≠ның потенциалын анықтайтын әд≥с жоқ, себеб≥ бар өлшеу≥ш құрылғылар тек потенциалдар айырымын анықтайды. —ондық≠тан ек≥ электродтың, €ғни ек≥ жартылай реакци€лардың потенциалдар айырымы өлшенед≥. ќл үш≥н жеке жартылай реакци€ның не жартылай элементт≥ң потенциалын ек≥нш≥ стандартты электродпен салыстырып анықтайды. —өйт≥п әртүр≠л≥ тотығу-тотықсыздану жүйелер≥н≥ң тотығу, тотықсыздану қаб≥летт≥л≥г≥н≥ң салыстырмалы сипаттамасы алынады.
|
|
|
Ќег≥зг≥ салыстырмалы электрод рет≥нде стандартты сутек электродын пайдаланады. Ѕұл газ түр≥ндег≥ сутег≥н жақсы адсорбци€лайтын, ұсақ дисперстенген платинамен қапталған платина пластинкасы. ≤ атм қысымда газ түр≥ндег≥ сутег≥мен қаныққан электрод сутег≥ иондарының белсенд≥л≥г≥ (активт≥г≥) б≥рге тең ер≥т≥нд≥ге батырылады. —утег≥ стандартты электродының потенциалы 0,000 ¬ деп алынады. ѕлатина электрохими€лық реакци€ға қатыспайды, тек электрондарды тасымалдауға қатысады. —утег≥ электродының жартылай реакци€сы Ќ2(газ)↔2Ќ+ + 2е, тотығу-тотықсыздану жұбы 2Ќ+/Ќ2 . ≈к≥нш≥ жартылай электродтың табиғатына байланысты сутег≥ электроды не катод, не анод рөл≥н атқарады. јнод болса, электродта жүрет≥н реакци€ Ќ2↔ 2Ќ+ +2е, катод болса 2Ќ+ +2е → Ќ2, €ғни Ќ2↔ 2Ќ+ +2е қайтымды реакци€.
ћысалы:
(-) Zn /ZnSO4 (1M) // H2SO4 (1M), H2(газ) / Pt (+)
анод катод
Өз бет≥мен жүрет≥н реакци€
Zn+2H+ ↔ Zn2+ + H2,
мырыш анод рөл≥н атқарады, €ғни гальваникалық элементт≥ң тер≥с полюс≥ Zn Ц 2е ↔ Zn2+ (анодты реакци€). Ёлектрондар сыртқы өтк≥зг≥шпен мырыштан гальваникалық элементт≥ң оң полюс≥не (стандартты сутек электродына) бағытталады: 2Ќ++2е→Ќ2 (катодты реакци€). —ондықтан мырыш электродының потенциалының таңбасы (ЁҚ =≈(2Ќ+/Ќ2)-≈(Zn/Zn2+)=(0,00-  ) тер≥с
) тер≥с
 = Ц 0,76 B.
= Ц 0,76 B.
(-) Pt/H2 (газ), H2SO4 (1M) // CuSO4 (1M) / Cu (+)
анод катод
елт≥р≥лген гальваникалық элементтег≥ жартылай реакци€лар
Cu 2+ +2e → Cu0 (катодты реакци€)
Ќ2 Ц 2e → 2Ќ+ (анодты реакци€)
ћыс электродының потенциалы оң мән, себеб≥ ол галь≠ваникалық элементт≥ң катоды. Ёлектрондар сыртқы өтк≥зг≥шпен сутег≥нен мысқа бағытталған
(ЁҚ = ≈(Cu2+/ Cu0) Ц ≈(2Ќ+/Ќ2) = E(Cu2+/ Cu0) Ц 0,00);  .
.
Өз бет≥мен жүрет≥н реакци€
Cu 2+ + Ќ2 ↔ 2Ќ++Cu0
(-) Pt /H2 (газ) H2SO4 (1M) // FeCl3, FeCl2 (C (Fe3+) = C (Fe 2+) / Pt (+)
анод катод
∆артылай реакци€лар
Ќ2 Ц 2e → 2Ќ+
2Fe3+ + 2e → 2Fe 2+
≈ (Fe3+/Fe 2+) = +0,77¬. Өз бет≥мен жүрет≥н реакци€:
Fe3++Ќ2 Fe 2+ + 2Ќ+ .
“отығу Ц тотықсыздану жұбының потенциалы тек осы жұпқа к≥рет≥н тотықтырғыштың және тотықсыздандырғыштың табиғатына ғана тәуелд≥ емес, олардың концентраци€сына да тәуелд≥. “епе Ц теңд≥к потенциалдарының заттардың табиғатына (≈о арқылы есепке алынады), олардың концентраци€сына және температураға тәуелд≥л≥г≥ Ќернст теңд≥г≥мен өрнектелед≥:
 (9.6)
(9.6)
≈ Ц тотығу Ц тотықсыздану жұбының реалды (тепе Ц теңд≥к) потенциалы, ¬;
≈о Ц стандартты тотығу Ц тотықсыздану потенциалы, ¬.
R Ц әмбебап газды тұрақтылық, 8,314 ƒж/ ∙ моль тең;
F Ц ‘арадей саны, 96500 л тең;
n Цтотығу-тотықсыздану жартылай реакци€сына қатысатын электрондар саны;
|
|
|
αox, αred Ц заттың тотыққан және тотықсызданған түрлер≥н≥ң актив≥к концентраци€лары.
“отығу Ц тотықсыздану реакци€сына қатысатын бар компоненттерд≥ң активт≥г≥ б≥рге тең болғандағы жартылай реакци€ның тотығу-тотықсыздану потенци€лы стандартты потенциал деп аталады:
 (9.7)
(9.7)
ейб≥р тотығу-тотықсыздану жүйелер≥н≥ң стандартты потенциалдары 4.1 кестес≥нде келт≥р≥лген. “ұрақты F пен R-д≥ң сандық мәндер≥н қойып, натуралды логарифмд≥ ондық логарифмге ауыстырса (ln=2,3 lg), онда 25 0C-та (9.6) теңд≥г≥ былай жазылады:
 (9.8)
(9.8)
≈гер тотықтырғыш Ц тотықсыздандырғыш жұбының б≥реу≥ қатты не газ түр≥нде жүрсе, Ќернст теңд≥г≥не тек сұйық фазада (ер≥т≥нд≥де) жүрген түр≥н≥ң активт≥г≥ к≥ред≥. ћысалы Zn2+/ Zn0 , 2Ќ+/Ќ2 жұптары үш≥н:
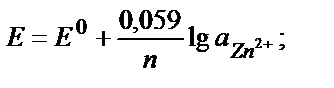

—ұйытылған ер≥т≥нд≥лерде активт≥кт≥ тепе-теңд≥к концентраци€сымен ауыстыруға болады:

9.1 Ц кесте.






