Для более точного определения влагосодержания сероводородсодержащего природного газа при содержании сероводорода до 50% мольных долей и давлении до Р=70 МПа и температуре 10≤Т≤175 0С необходимо использовать следующий метод: Сначала определить влагосодержание несернистого газа (углеводородные компоненты газа) из рисунка 2.19б; Затем определить мольное содержание в процентах эквивалентной концентрации сероводорода Н2S в сернистом газе из равенства Н2Sэкв=Н2S+0,7·СО2, в %; Далее для заданной величины температуры Т и рассчитанному значению эквивалентной концентрации сероводорода в газе Н2Sэкв, используя кривые, показанные на рисунке 2.19б (см. последовательность нахождения относительного влагосодержания сероводородсодержащего газа к влагосодержанию несернистого газа) находят  . Для этого необходимо для известной величины температуры горизонтальной линией пересечь кривую Н2Sэкв, а затем из точки пересечения провести вертикальную линию до пересечения с кривой давления, при котором требуется определить влагосодержание сернистого газа. Из точки пересечения вертикальной линии с кривой давления провести горизонтальную линию до оси ординат с относительным влагосодержанием сернистого газа. Ключ к получению ответа о влагосодержании сернистого газа показан на рисунке 2.19б. Из приведенных результатов видно, что с увеличением сероводорода в газе влагосодержание увеличивается.
. Для этого необходимо для известной величины температуры горизонтальной линией пересечь кривую Н2Sэкв, а затем из точки пересечения провести вертикальную линию до пересечения с кривой давления, при котором требуется определить влагосодержание сернистого газа. Из точки пересечения вертикальной линии с кривой давления провести горизонтальную линию до оси ординат с относительным влагосодержанием сернистого газа. Ключ к получению ответа о влагосодержании сернистого газа показан на рисунке 2.19б. Из приведенных результатов видно, что с увеличением сероводорода в газе влагосодержание увеличивается.

Рисунок 2.19б - Номограмма для определения относительного влагосодержания сернистого газа.
Теплоемкость газа (РИС 71-82)
Теплоемкость газа – это отношение количества теплоты, подведенной к газу в заданном термодинамическом процессе, к соответствующему изменению его температуры. В зависимости от вида процесса различают изобарную теплоемкость Ср, когда процесс происходит при постоянном давлении Р=const, и изохорную Сv, когда процесс происходит при постоянном объеме V=const. Единица измерения теплоемкости Дж/кг∙град или Дж/моль·град. Обычно в расчетах используют удельные – массовые или молярные – теплоемкости, т.е. теплоемкости, отнесенные к единице массы или к одному молю газа. Теплоемкость природных газов зависит от давления, температуры и состава газа, а также от процесса передачи тепла. Теплоемкость газа при заданных давлении и температуре определяется как сумма теплоемкостей, состоящих из теплоемкости при заданной температуре и атмосферном давлении 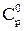 и приращения теплоемкости за счет влияния давления ΔСр, т.е.
и приращения теплоемкости за счет влияния давления ΔСр, т.е.
 (2.54)
(2.54)
Так как 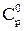 –
–  =R, получим:
=R, получим:
Cp–Cv=ΔCр–ΔCv+R (2.55)
Теплоемкость газов 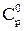 при атмосферном давлении определяется графически из рисунка 2.20 или аналитическим путем. При определении теплоемкости газовой смеси известного состава используют формулу:
при атмосферном давлении определяется графически из рисунка 2.20 или аналитическим путем. При определении теплоемкости газовой смеси известного состава используют формулу:
 (2.56)
(2.56)
где  – коэффициент теплоемкости i-го компонента при Р=0,098 МПа, и заданной температуре; gi – массовая доля i-го компонента в смеси.
– коэффициент теплоемкости i-го компонента при Р=0,098 МПа, и заданной температуре; gi – массовая доля i-го компонента в смеси.
Значения Ср приведены в таблице 2.2 при нормальных условиях и показаны на рисунке 2.20 в интервале изменения температуры 223≤Т≤423 К. Аналитически величина  может быть определена по формуле:
может быть определена по формуле:
 =Ei+nFi+n2Gi+n3Нi+Ni/n (2.57)
=Ei+nFi+n2Gi+n3Нi+Ni/n (2.57)
где Ei, Fi, Gi, Нi, Ni – коэффициенты, определяемые из таблицы 2.10, n=T/100; Т – температура газа, К.
Изобарная массовая теплоемкость может быть определена по формуле: при 1,6£ Тпр £ 2,1 и 0,8£ Рпр £ 3,5, по формулам
 ,
,

Рисунок 2.20 – Зависимость изобарной молярной теплоемкости Ср газов при атмосферном давлении от температуры.
Теплоемкость газов, не содержащих кислых компонентов и азота при атмосферном давлении, можно определить по известной плотности, используя формулу:
 (2.58)
(2.58)
Таблица 2.10 – Коэффициенты уравнения (2.57) для определения Ср0, Дж/кг·град
| Компоненты | Молекулярная масса, кг/кмоль |  , Дж/кг·град , Дж/кг·град
|  , Дж/кг·град , Дж/кг·град
|  , Дж/кг·град , Дж/кг·град
|  , Дж/кг·град , Дж/кг·град
|  , Дж/кг·град , Дж/кг·град
|
| Метан | 16,04 | 58522,25 | 15215,04 | -2947,67 | 18575,95 | |
| Этан | 30,07 | 62557,49 | 25663,79 | 36001,45 | 3343,11 | |
| Пропан | 44,09 | 66328,12 | 32767,24 | 62295,40 | -782,07 | |
| Бутан | 58,12 | 65812,73 | 33182,44 | 33182,44 | 3,8610 | |
| Изобутан | – | 68152,31 | 36790,16 | 75903,33 | -1685,56 | |
| Пентан | 72,15 | 65762,49 | 33814,98 | 66951,12 | -112,122 | |
| Изопентан | – | 66,838,91 | 34687,09 | 69556,98 | -1530,40 | |
| Гексан | 86,18 | 66060,17 | 34773,68 | 70914,34 | -456,22 | |
| Гептан | 100,20 | 66040,07 | 35091,50 | 31839,23 | -503,65 | |
| Октан | 114,22 | 66094,50 | 35466,84 | 73861,01 | -561,57 | |
| Нонан | 128,26 | 65986,06 | 35489,58 | 74039,37 | -522,39 | |
| Декан | 142,29 | 65991,50 | -35677,77 | 74788,39 | -549,49 | |
| Кислород | 32,0 | 21621,09 | 16458,14 | 49445,62 | 12051,12 | |
| Водород | 2,02 | 330368,33 | 294527,51 | 14165,32 | 200717,79 | |
| Вода | 18,02 | 40147,27 | 27801,52 | 79225,56 | 26409,75 | |
| Гелий | 4,0 | 5191,632 | ||||
| Аргон | 39,95 | 520,712 | ||||
| Криптон | 83,80 | 248,696 | ||||
| Хлор. водород | 36,46 | 741,248 | 14447,19 | 187,48 | 51,33 | 313,63 |
| Сероводород | 64,86 | 19097,88 | 154,95 | 43953,78 | 5109,53 | |
| Двуокись серы | 34,08 | 24379,36 | 16676,57 | 45818,66 | 11682,30 | |
| Азот | 28,01 | 21745,15 | 16129,31 | 45183,53 | 15429,99 | |
| Двуокись углерода | 44,01 | 25745,76 | 19428,01 | 53589,36 | 6924,42 | |
| Окись углерода | 28,01 | 22065,65 | 16193,91 | 44592,35 | 15197,54 |
где B1÷B6 – постоянные коэффициенты и соответственно равны: B1=5,5967; В2=-2,2335; В3=0,8073; В4=-1,0039; В5=3,1416; В6=5,7587.
При известном составе газа и наличии H2S, CO2 и N2 теплоемкость при заданной температуре и атмосферном давлении может быть определена по формуле:
 (2.59)
(2.59)
где 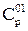 – теплоемкость газа без двуокиси углерода, сероводорода и азота, определяемая по формуле (2.58);
– теплоемкость газа без двуокиси углерода, сероводорода и азота, определяемая по формуле (2.58);  ,
,  ,
,  – поправки на присутствие этих компонентов, значения которых определяются по формулам:
– поправки на присутствие этих компонентов, значения которых определяются по формулам:
 (2.60)
(2.60)
 (2.61)
(2.61)
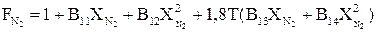 (2.62)
(2.62)
где Xi – мольные доли СО2, H2S и N2 в газе; Т – заданная температура, К; В7÷B14 – постоянные коэффициенты, значения которых соответственно равны: В7=0,4259 В8=1,2432·10-3; В9=-0,0406; В10=1,0089·10-3; В11=0,3624; В12=-0,4661; В13=0,0976; В14=0,2708.
Формула (2.59) может быть использована для расчета Cр в диапазоне изменения температуры 273≤T≤423 К и при концентрациях в газе сероводорода до 40%, двуокиси углерода до 20% и азота до 25% (мольных).
Приращение изобарной теплоемкости ΔСР может быть определено графическим и аналитическим способами. Наиболее простым способом определения величины ΔСР является графический способ по известным приведенным параметрам Рпр, Тпр из рисунка 2.21. Для заданного состава газа по известным критическим параметрам каждого компонента Ркр.i и Ткр.i по формуле (2.3) определяют псевдокритические параметры газа, а затем приведенные Рпр=Р/Рп.кр и Тпр=Т/Тп.кр. По известным Рпр и Тпр из рисунка 2.21 определяют ΔСр.

Рисунок 2.21 – Зависимость приращения изобарной теплоемкости ΔСР от приведенных давления и температуры.
Использование этого способа целесообразно при составе газа, где содержание метана ≥98%. Если мольная концентрация высококипящих углеводородных и неуглеводородных газов превышает 10%, а также при наличии в газе полярных веществ при определении ΔСр следует учесть влияние третьего параметра – фактора ацентричности молекул ω. Значение фактора ацентричности вычисляется по известному составу газа по формуле (2.22). При известных значениях Рпр, Тпр и ω приращение изобарной теплоемкости ΔСр определяется по формуле:
 (2.63)
(2.63)
Значения  и
и  определяются графически из рисунков 2.22 и 2.23. Размерность величины ΔСр зависит от размерности газовой постоянной R. В большинстве случаев используют значение R=1,986 ккал/моль·град. В этом случае для получения теплоемкости в Дж/моль·град вычисленный результат умножают на 4186,8. Для получения теплоемкости в Дж/кг·град необходимо величину ΔСР разделить на молекулярную массу газа М.
определяются графически из рисунков 2.22 и 2.23. Размерность величины ΔСр зависит от размерности газовой постоянной R. В большинстве случаев используют значение R=1,986 ккал/моль·град. В этом случае для получения теплоемкости в Дж/моль·град вычисленный результат умножают на 4186,8. Для получения теплоемкости в Дж/кг·град необходимо величину ΔСР разделить на молекулярную массу газа М.
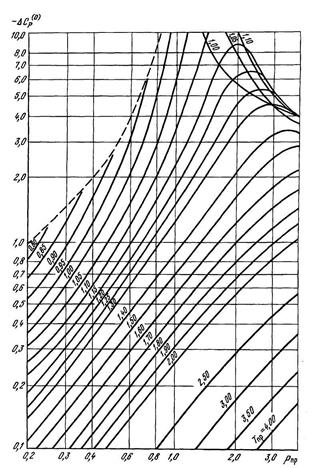
Рисунок 2.22 – Зависимость поправочной функции –ΔС(0)р от приведенных давления и температуры.
В интервалах изменения приведенных давления 0≤Рпр≤6 и температуры 1≤Тпр≤4 величины  /R и
/R и  /R могут быть определены графически из рисунка 2.24. Для более высоких давлений значение ΔСр может быть определено аналитическим путем. В частности, ΔСр может быть рассчитана по приведенной форме уравнения Бенедикта-Вебба-Рубина согласно [18].
/R могут быть определены графически из рисунка 2.24. Для более высоких давлений значение ΔСр может быть определено аналитическим путем. В частности, ΔСр может быть рассчитана по приведенной форме уравнения Бенедикта-Вебба-Рубина согласно [18].
Для определения изохорной теплоемкости Cv можно использовать формулу:
Cv=C0р+ΔCv–R (2.64)
где ΔCv – приращение изохорной теплоемкости, определяемое по формуле:
ΔCv/R=  /R+
/R+  /R. (2.65)
/R. (2.65)

Рисунок 2.23 – Зависимость поправочной функции –ΔС(1)р от приведенных давления и температуры.
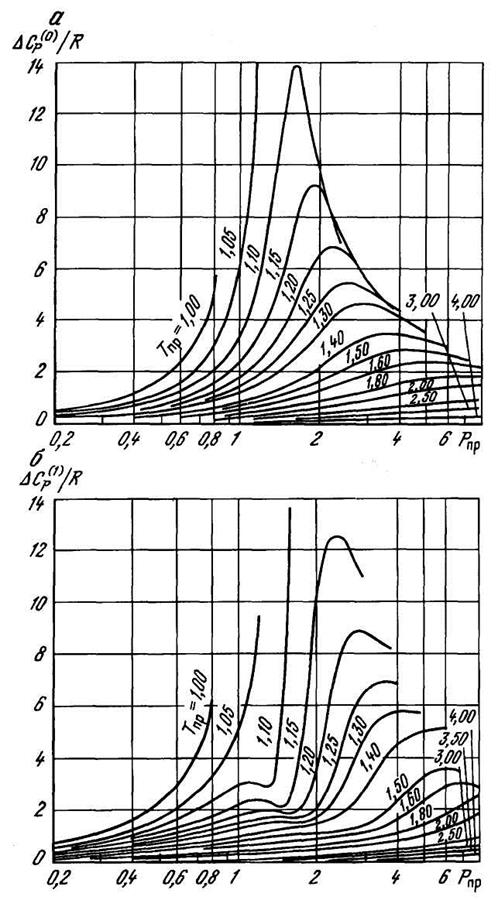
Рисунок 2.24 – Зависимости ΔС(0)р/R (а) и ΔС(1)р/R (б) от приведенных давления и температуры.
Значения  /R и
/R и  /R находят из рисунка 2.25.
/R находят из рисунка 2.25.

Рисунок 2.25 – Зависимости ΔCv(0)/R (а) и ΔCv(1)/R (б) от приведенных давления и температуры.
Теплопроводность газа (РИС 82-87)
Теплопроводность газа – это количество тепла, проходящего через его массы без перемещения, конвекции и теплообмена. Количество передаваемого тепла в газовой среде пропорционально градиенту температуры Δt, площади передачи F, продолжительности процесса теплопередачи τ, толщины слоя газа ΔL и выражается формулой:
Q=λ∙F∙τ∙Δt/ΔL (2.66)
где Δt=t2–t1 – разность температуры по обе стороны газовой среды толщиной ΔL; λ – коэффициент пропорциональности между количеством тепла и параметрами газовой среды.
Количество тепла, проходящего через единицы площади и толщины за единицы времени при разности температур, равной 1 град, принято называть коэффициентом теплопроводности. Коэффициент теплопроводности измеряется в Дж/м·с·град или Вт/м·град.
Теплопроводность газов зависит от давления, температуры и состава газа и определяется графическим или аналитическим методами. Все аналитические выражения для определения коэффициента теплопроводности получены аппроксимацией экспериментальных кривых. Наиболее простым способом определение λ является использование графических зависимостей λ/λат и λ/λкр от приведенных давления и температуры, показанных на рисунках 2.26 и 2.27, или зависимости (λ–λат) от приведенной плотности ρпр, показанной на рисунке 2.28. Для определения λ с использованием рисунка 2.27 необходимо вычислить величину λкр, т.е. теплопроводность газа при критических Ркр и Tкр.


Рисунок 2.26 – Зависимость приведенной теплопроводности λ/λат газов от приведенных давления и температуры – 0,6≤Рпр≤6 (a) и 0,1≤Рпр≤1 (б).
Для газовых смесей λкр должна быть определена как псевдокритическая теплопроводность по формуле:
λпк=12,24·10-5Mсм0,5Рп.кр2/3/Тп.кр1/6 (2.67)
где Мсм – молекулярная масса смеси, определяемая по формуле:
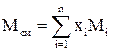 (2.68)
(2.68)
где Рп.кр и Тп.кр – псевдокритическое давление и температура.

Рисунок 2.27 – Зависимость приведенной теплопроводности λ/λкр газов от приведенных давления и температуры.

Рисунок 2.28 – Зависимость Δλ=λ–λат от приведенной плотности газов
При использовании рисунков 2.26 и 2.28 для определения λ необходимо вычислить величину λат, т.е. коэффициент теплопроводности при заданной температуре и атмосферном давлении Рат=0,098 МПа. Величину λат.см можно определить несколькими расчетными методами.
С погрешностью до 5% значение λат.см может быть определено по формуле:
 (2.69)
(2.69)
Величина λат.i в формуле (2.69) определяется в зависимости от заданных температурных условий и состава газа из рисунка 2.29, по табличным данным или расчетным путем. В частности:
– для метана, нафтеновых и ароматических углеводородов при Тпр<1
 ; (2.70)
; (2.70)
– для остальных углеводородов при любых температурах
 (2.71)
(2.71)
– для неуглеводородных компонентов при Тпр<1
 (2.72)
(2.72)
- для неуглеводородных компонентов при 1≤Тпр≤3
 (2.73)
(2.73)
– для неуглеводородных компонентов при 3≤Тпр≤15
 (2.74)
(2.74)
где  – теплоемкость i-го компонента при Рат; Zкр.i – значение коэффициента сверхсжимаемости Z при критических параметрах i-го компонента Ркр.i и Ткр.i; Тпр.i – приведенная температура i-го компонента.
– теплоемкость i-го компонента при Рат; Zкр.i – значение коэффициента сверхсжимаемости Z при критических параметрах i-го компонента Ркр.i и Ткр.i; Тпр.i – приведенная температура i-го компонента.
Параметр ξi и ξсм определяются по формулам:
 ;
;  (2.75)
(2.75)
В формулах (2.70)÷(2.74)  измеряется в Дж/моль∙град, Р – в МПа, Т – в К и λ – в Вт/м∙град. Более точно значения λат.см и λ могут быть определены согласно [18].
измеряется в Дж/моль∙град, Р – в МПа, Т – в К и λ – в Вт/м∙град. Более точно значения λат.см и λ могут быть определены согласно [18].
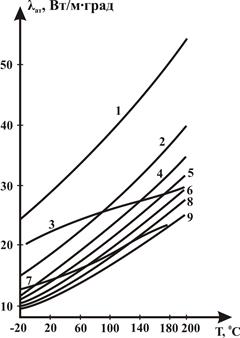
Рисунок 2.29 – Зависимость теплопроводности компонентов природных газов λат при атмосферном давлении от температуры:
1÷9 теплопроводность газов при Рат: 1 – метана, 2 – этана, 3 – азота, 4 – пропана, 5 – n-бутана, 6 – n-пентана, 7 – углекислого газа, 8 – n-гексана, 9 – n-гептана.
Дросселирование газа. Коэффициент Джоуля-Томсона. (РИС 87-91)
Дросселирование – расширение газа при постоянной энтальпии в процессе его прохождения через сужающие устройства (т.е. через местное сопротивление, каковым являются: дроссель, диафрагмы, сопла, штуцера, вентиль, кран, сужение трубы и т.д.), сопровождающееся изменением температуры, вызванным затратой энергии на преодоление внутренних молекулярных сил взаимного притяжения. Процесс, происходящий при этих условиях, т.е. при постоянстве энтальпии, называется адиабатическим. Изменение температуры газа при изоэнтальпийном его расширении называется дроссель-эффектом и установлено Джоулем и Томсоном. Отношение изменения температуры к изменению давления называется коэффициентом Джоуля-Томсона.
Коэффициент Джоуля-Томсона зависит от состава газа, давления и температуры, изменяется в широких пределах и, может иметь положительный и отрицательный знак. Отрицательный знак коэффициента Джоуля-Томсона показывает, что дросселирование сопровождается нагреванием газа. Для природных газов при температурах и давлениях, встречаемых на практике, дросселирование практически всегда сопровождается охлаждением газа. На Астраханском газоконденсатном месторождении при давлениях, близких к начальному коэффициент Джоуля-Томсона отрицательный. С увеличением давления за его критическим значением коэффициент Джоуля-Томсона уменьшается и проходит через нуль, т.е. через инверсионную точку, и становится отрицательным. В этом случае газ при дросселировании нагревается. Чем выше давление, тем значительнее нагревание газа.
Значение коэффициента Джоуля-Томсона может быть определено экспериментально и расчетным путем. Для проведения термогазогидродинамических расчетов используют аналитический способ определения коэффициента Джоуля-Томсона Di по формуле:
 (2.76)
(2.76)
В формуле (2.76) Ткр, Ркр – критические температура и давление газа, метод определения которых в зависимости от состава газа изложен ранее; f(Di) – функция, определяемая по графику из рисунка 2.30 в зависимости от приведенных давления и температуры газа. Функция f(Di) имеет размерность теплоемкости газа.
Графические зависимости f(Di), показанные на рисунке 2.30 в диапазоне изменений 1,6≤Tпp≤2,1 и 0,8≤Рпр≤3,5, могут быть выражены формулой:
 (2.77)
(2.77)
Или (одно и тоже) Обобщенная функция Джоуля-Томсона равна
 кДж/кг*К
кДж/кг*К
Для определения изменения температуры в результате дросселирования газа можно пользоваться номограммой, построенной для метана и показанной на рисунке 2.31. Для определения величины температуры газа после дросселирования на графике находят точку с координатами, соответствующими давлению Р1 и температуре Т1 до дросселирования. От этой точки проводят параллельно ближайшей изоэнтальпийной кривой линию до заданного после дросселирования давления Р2 и определяют Т2.
Средний коэффициент Джоуля-Томсона при использовании изоэнтальпийных диафрагм определяется по формуле:
Di=ΔТ/ΔР (2.78)

Рисунок 2.30 – Зависимость обобщенной функции f(Di) от приведенных давления и температуры.

Рисунок 2.31 – Номограмма для определения интегрального дроссель-эффекта метана.
или из выражения для определения конечной температуры газа после дросселирования:
 (2.79)
(2.79)
где
 =(Р1+Р2)/2Рп.кр; Тпр1=Т1/Тп.кр;
=(Р1+Р2)/2Рп.кр; Тпр1=Т1/Тп.кр;  =
=  (Pпр, Тпр1); (2.80)
(Pпр, Тпр1); (2.80)
 – средний коэффициент теплоемкости, рассчитанный для условий средних до и после дросселя давлений и температуры.
– средний коэффициент теплоемкости, рассчитанный для условий средних до и после дросселя давлений и температуры.
Интегральный дроссель-эффект может быть рассчитан и по уравнению состояния Битти-Бриджмена согласно [18].
Гидратообразование газов (РИС 97-107)






