Молекуланың орташа энергиясы
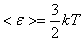 (8.10)
(8.10)
молекуланың тек ілгерілемелі қозғалысының энергиясын ғана көрсетеді. Алайда молекулалардың ілгерілемелі қозғалысымен қатар, молекулалардың айналуы және молекуланың қозғалыс құрамына кіретін атомдардың тербелуі де мүмкін. Қозғалыстың бұл екі түрі қандай да бір энергия қорымен байланысты болады, ал бұл энергияны анықтауға статистикалық физика тағайындайтын энергияның молекуланың еркіндік дәрежелері бойынша біркелкі таралуы жөніндегі қағида мүмкіндік береді.
Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы - классикалық жүйелерге қолданатын статистиканың негізгі заңдарының бірі. Механикалық жүйенің еркіндік дәрежелері саны деп жүйенің орнын анықтауда мүмкіндік беретін тәуелсіз координаталардың жиынтығын айтады. Материалдық нүктенің кеңістіктегі орны оның үш координаттарының мәндерімен анықталады. Газдардың жылу сыйымдылығын өлшегенде атомдарды материалдық нүктелер деп есептеуге болады. Олай болса, бір атомды молекулалар үш ілгерілемелі еркіндік дәрежеге, екі атомды молекулалар – үш ілгерілемелі, және екі айналмалы, көп атомды молекулалар және абсолютті қатты дене – үш ілгерілемелі және үш айналмалы еркіндік дәрежесіне ие болады. Жылулық тепе-теңдік жағдайында молекуланың әр еркіндік дәрежесіне 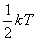 тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы,
тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы, 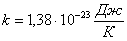 - Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы
- Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы
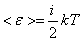 , (8.11)
, (8.11)
мұндағы i – ілгерілемелі, айналмалы және екі еселенген тербелмелі еркіндік дәрежелері сандарының қосындысы:
 . (8.12)
. (8.12)
Атомдардың арасында қатаң байланысы бар молекула үшін i молекуланың еркіндік дәрежелерінің санына тең болады.
Идеал газ молекулаларының жылулық қозғалысының орташа кинетикалық энергиясы. Ішкі энергия
Идеал газ молекулалары қашықтықтан әрекеттеспейтін болғандықтан, мұндай газдың ішкі энергиясы жеке молекулалардың энергияларының қосындысынан тұрады. Демек, идеал газдың бір киломолінің ішкі энергиясы Авагадро санын бір молекуланың орташа энергиясына көбейткенге тең болады:
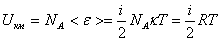 . (8.13)
. (8.13)
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағы киломольдердің санына көбейткенге тең болады:
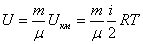 . (8.14)
. (8.14)
Сонымен (8.14) өрнектен берілген газдың массасы үшін ішкі энергия газ молекуласының еркіндік дәреже көрсеткіші өзгермейтін болса, оның абсолют температурасына тура пропорционал екендігі көрінеді.






