Термодинамиканың екінші заңының барлық қаралған тұжырымдамалары процестің мүмкіндіктерін талдау үшін энергия мөлшерінің сақталуының жеткіліксіз екенін көрсетеді. Энергия сандық түрде ғана емес, сапалық түрде де сипатталуы қажет. Энергияның сапасын анықтайтын және термодинамиканың екінші заңындағы шектеулерді сандық түрде сипаттайтын шама S энтропия болып табылады.
Термодинамиканың екінші заңының жалпылама тұжырымдамасы энтропия ұғымымен байланысты. Егер жүйе оқшауланған болса, яғни қоршаған ортамен жылу алмаспайтын болса ондай жүйенің энтропиясы:
 ,
,  . (9.5)
. (9.5)
Барлық нақты процестердің барлығы қайтымсыз болғандықтан оқшауланған жүйеде энтропия әрдайым артады. Энтропияның артуы жүйенің ықтималдылығы аз күйден ықтималдылығы көп күйге, яғни тепе-теңдік күйге ауысуын көрсетеді.
Бірақ флуктуациялар да болуы мүмкін. Оқшауланған жүйедегі энтропияның арту заңы статистикалық сипатқа ие.
(9.5) –да математикалық түрде өрнектелген термодинамиканың екінші заңы оған дейін қарастырылған тұжырымдамалармен астасады.
Жылу машиналарының жұмысын талдасақ, жүйеге dQ жылу түрінде берілген барлық энергияны dA жұмысқа айналдыру үшін оның қандай да бір бөлігі жеткілікті 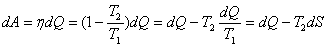 , және неғұрлым аз болса, соғұрлым энтропия көп болады. Бұл жағдай энтропияны жұмыс істеу қабілетінің өлшемі деп сипаттауға мүмкіндік береді. Жүйенің энтропиясының артуы табиғи процестердің ерекше белгісі болып табылады және энергия сапасының төмендеуіне алып келеді.
, және неғұрлым аз болса, соғұрлым энтропия көп болады. Бұл жағдай энтропияны жұмыс істеу қабілетінің өлшемі деп сипаттауға мүмкіндік береді. Жүйенің энтропиясының артуы табиғи процестердің ерекше белгісі болып табылады және энергия сапасының төмендеуіне алып келеді.
Кез келген қайтымды цикл үшін Клаузиус теоремасын (9.4) жазайық
 . (9.6)
. (9.6)
(9.6) интегралдың нөлге тең болуы  шамасы қандай да бір S күй функциясының толық дифференциалын береді. Сондықтан
шамасы қандай да бір S күй функциясының толық дифференциалын береді. Сондықтан
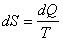 және
және 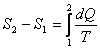 . (9.7)
. (9.7)
(9.7) формуласын термодинамикадағы энтропияның анықтамасы ретінде қарастыруға болады.
(9.7) анықтамадан туындайтын энтропияның кейбір қасиеттері:
- жүйенің энтропиясы - аддитивті шама  Мұның мәнісі: жүйе энтропиясы оның жеке бөліктерінің энтропияларының қосындысына тең;
Мұның мәнісі: жүйе энтропиясы оның жеке бөліктерінің энтропияларының қосындысына тең;
- жылу алмасусыз жүретін қайтымды процесте  – адиабаталық процесте- энтропия тұрақты болады;
– адиабаталық процесте- энтропия тұрақты болады;
- процестің энтропиясы қандай да бір тұрақты шамаға дейінгі дәлдікпен анықталуы мүмкін.
Қайтымды процестегі энтропияның өзгерісі (9.1) және (9.2) қатынастары негізінде есептеледі
 . (9.8)
. (9.8)
Жылулық процестерді талдау үшін координат осьтері ретінде T және S күй функцияларыалынатын TS – диаграммасы қолданылады.
Термодинамиканың бірінші және екінші бастамасы. Термодинамиканың екінші бастамасының статистикалық түсіндірілуі. Энтропия мен күй ықтималдылығының байланысы
Қандай да бір дененің толық энергиясынан тұтастай қозғалысының кинетикалық энергиясы мен сыртқы күш өрісіндегі потенциалдық энергиясын шығарып тастағанда қалған энергия оның ішкі энергиясы деп аталады.
Демек, ішкі энергия түсінігіне молекулалардың хаосты қозғалысының кинетикалық энергиясы, молекулалардың өзара әсерлесуінің потенциалдық энергиясы және ішкі молекулалық энергия кіреді екен. Ішкі энергия негізінен екі түрлі процестің: дененің А жұмыс істеуі мен денеге берілген Q жылу мөлшерінің есебінен өзгере алады. Жұмыс істеу жүйеге әсер етуші сыртқы денелердің орын ауыстыруымен қоса жүреді.
Денеге жылу беру сыртқы денелердің орын ауыстыруына тәуелді емес. Бұл жағдайдағы ішкі энергияның өзгерісі ыстығырақ дененің жеке молекулаларының салқынырақ дененің молекулаларына қарсы істеген жұмысының әсерінен болады. Бір денеден екінші денеге энергияның берілуіне әкелетін микроскопиялық процестердің жиынтығы жылу берілуі деп аталады.
Жүйе мен қоршаған ортаның арасындағы энергия алмасуының екі тәсілі бар деп тұжырымдалатын термодинамикадағы энергияның сақталу заңы физиканың негізгі заңдарының бірі болып табылады:
Жүйеге берілген жылу мөлшері және жүйеде атқарылған жұмыс жүйенің ішкі энергиясын өзгертуге жұмсалады
 , немесе
, немесе  , (9.9)
, (9.9)
мұндағы  – жүйеде атқарылған жұмыс;
– жүйеде атқарылған жұмыс;
 – сыртқы күштердің атқарған жұмысы.
– сыртқы күштердің атқарған жұмысы.
Ішкі энергия жүйенің күй функциясы болып табылады. Оның өзгерісі тек бастапқы және соңғы күйлеріне байланысты және бір күйден екінші күйге өту тәсіліне тәуелсіз.
Жылу мен жұмыс күйлерге ғана тәуелді болып қалмайды, сондай-ақ процестің түріне байланысты болады; олар процестің функциялары болып табылады.
Термодинамиканың екінші заңы табиғаттағы өтетін процестердің бағытын анықтайды. Екінші бастама бірінші бастама сияқты бірнеше тәсілдермен тұжырымдалуы мүмкін. Ең айқынырақ түрде тұжырымдап айтқанда екінші бастама: жалғыз-ақ нәтижесі жылудың салқын денеден ыстық денеге ауысуы болып келетін процестерді жүзеге асыру мүмкін емес.
Больцманның тағайындауы бойынша, энтропияның қарапайым статистикалық түсініктемесі бар. Егер бір емес, бірқатар күйдің ықтималдылығы бірдей және ең үлкен болса, онда тұйықталған жүйе мұндай күйлердің біреуінен басқаларына көше алады. Сөйтіп, тұйықталған жүйенің энтропиясы мен ықтималдылығының қасиеттері бірдей: олар не арта алады, не өзгеріссіз қала береді.
Келтірілген пайымдаулардан жүйенің энтропиясы мен ықтималдылығының арасында нақтылы байланыс болуға тиіс деген қорытынды шығады. Больцман бұл қатыстың түрі мынандай екенін көрсетті:
 , (9.10)
, (9.10)
мұндағы к- Больцман тұрақтысы, ал W- жүйе күйінің термодинамикалық ықтималдылығы, ол шаманы сол күйді жүзеге асыруға болатын түрліше тәсілдердің саны деп түсінуге тиіспіз.






