Билет
1. рецетор,классификаци
2. вазопрессин
3. схема биосинтеза гема
4. роль печени в уо
5. общие метаболиты
1. 1. Классификация рецепторов:
1. Мембранные рецепторы
а) 7-TMS рецепторы, взаимодействующие с гетеротримерными G-белками
б) 1-TMS рецепторы со свойствами гуанилатциклазы, тирозинкиназы, протеинфосфатаз, сер/тре протеинкиназ, взаимодействующие с тирозинкиназой.
в) ионные каналы (лиганд-зависимые, потенциал-зависимые, щелевые контакты)
2. Внутриклеточные
1 класс - ядерные и цитозольные ассоцииров. с hsp
2 класс – ядерные и цитозольные неассоц. c hsp
Функциональное назначение G-белка: 1) Gsa – активация АЦ, 2) Gia – ингибируют АЦ, 3) Gqa – реагируют с ФЛ С и активируют ее 4) Goa – открывают Ca2+-каналы.
G- белок передаёт сигнал с 7-TMS рецептора на вторичный посредник.
Рецепторы гормонов являются крупными белками, и каждая восприимчивая к гормону клетка может иметь от 2000 до 100000 таких рецепторов. Рецепторы высокоспецифичны для конкретного гормона, что предопределяет тип гормона, который сможет оказать влияние на определенную ткань. Гормоном активирует только те ткани, которые располагают специфическим к нему рецептором.
Локализация различных типов рецепторов гормонов обычно следующая.
1. Внутри клеточной мембраны или на ее поверхности (рецепторы к гормонам белковой и полипептидной природы, катехоламинам).
2. В цитоплазме клетки (рецепторы к различным стероидным гормонам).
3. В клеточном ядре (рецепторы к гормонам щитовидной железы, которые предположительно связаны с одной или более хромосомами).
Типы G-белков: известно около 20 видов
G0 – активирует кальциевые каналы
Gi – ингибирует АЦ
Gs- акт. АЦ и т.д.
G-белок: -гетеродимер
-3 субъединицы
- ассоциир. с ГДФ



 Лиганд+ R замена ГДФ на ГТФ ГТФ в Gальфа диссоциация G -белка альфа
Лиганд+ R замена ГДФ на ГТФ ГТФ в Gальфа диссоциация G -белка альфа
 АЦ
АЦ
 АТФ цАМФ
АТФ цАМФ
Патологическое функционирование G-белка:


 Холерный токсин Gальфа s в энтероцитах угнетение ГТФазной активности цАМФ образуется постоянно потеря воды энтероцитами
Холерный токсин Gальфа s в энтероцитах угнетение ГТФазной активности цАМФ образуется постоянно потеря воды энтероцитами
2. 1. Вазопрессин.
Хим.природа: пептид, построенный из 8 аминокислот.
Механизм действия: вазопрессин + 7-TMS рецептор ® Gq-белок ® ФЛ С ® ДАГ + ИФ3 ® Ca2+® 1) вазоконстрикция 2) усиливает реабсорбцию воды в нефроне.
Вазопрессин вырабатывается в задней доле гипофиза преимущестенно в нейронами супраоптического ядра. Способен повышать артериальное давление, сохранение воды в организме, и т.д.
3. Биосинтез гема и его регуляция. Нарушение биосинтеза гема (биохимическая диагностика).
Этапы синтеза гема:
1.  ГЛИ + Сукцинил-SKoA = δ-аминолевулиновая кислота
ГЛИ + Сукцинил-SKoA = δ-аминолевулиновая кислота
HS-КоА, СО2
Фермент-Аминолевулинат- синтаза, В6.
2.  2 δ-АЛК = Порфобилиноген (ПБГ)
2 δ-АЛК = Порфобилиноген (ПБГ)
Н2О
Фермент-δ-аминолевулинат дегидратаза
3. 4 ПБГ = ПротопорфиринIX(ППIX)
Через ряд промежуточных стадий.
4. ПП IX + Fe = гем
Фермент – гемсинтаза (феррохелатаза), вит. В 12, Сu.
Регуляция синтеза гема. Фермент, лимитирующий скорость синтеза гема (фермент 1). Он ингибируется избытком гема по принципу обратной связи, а активируется стероидными гормонами. Также ингибируется избытком гема ферменты 2 и 3(гемсинтаза). Фермент 2 чувствителен ко всем тяжелым металлам. Фермент 3 чувствителен к свинцу.
Нарушения синтеза гема. Заболевания, вызванные наследственными или приобретенными нарушениями синтеза гема – порфирии. Характерно выделение предшественником гема – порфиринов – с калом и мочой, которая окрашивается в темно-красный цвет. Порфирины также откладываются в коже, и при воздействии солнечного света образуются трудноизлечимые волдыри. Части и нервно-психические расстройства, т.к. порфирины нейротоксичны.
4. Роль печени в углеводном обмене – поддержание постоянства глюкозы в крови:
а) набором ферментов синтеза и распада гликогена (гексокиназа, глюкокиназа, гликогенсинтаза, гл-6-фосфатаза)
б) набором ферментов глюконеогенеза
в) набором ферментов, превращающих другие гексозы (галактозу, фруктозу) в глюкозу.
. Функциональные пробы, характеризующие роль печени в углеводном обмене:
а) нагрузочная проба галактозой – в норме выведение галактозы в моче не превышает 8% через 12 ч.
б) нагрузка глюкозой.
5. 
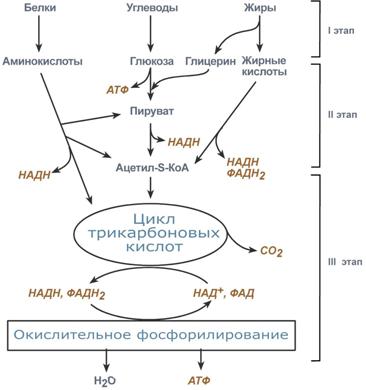
Ряд основных метаболических путей является общим для большинства клеток и организмов. Эти пути, в результате которых осуществляются синтез, разрушение и взаимопревращение наиболее важных метаболитов, а также накопление химической энергии, называются промежуточным метаболизмом. Здесь приводится сильно упрощенная схема этих процессов.
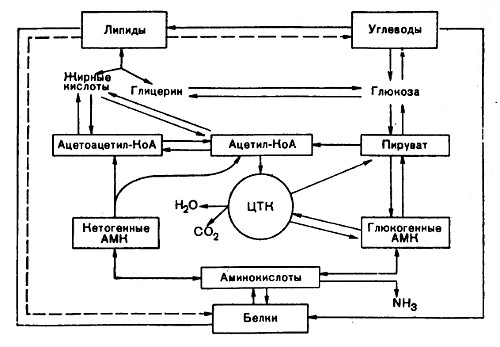
Билет
1. даг и итф
2. гормоны аденогипофиза. стг
3. роль печени в ло
4. обезвреживание продуктов распада hb
5. общий катаболизм и с-ма высвобождения энергии
1. Следующий класс 7-ТМС рецепторов связывается через Gq-белок с фосфолипазой С. При контакте с α-субъединицей фосфолипаза С катализирует гидролиз фосфатидилинозитолдифосфата на ДАГ и ИФ3. Последующие эффекты опосредуются либо ДАГ, либо ИФ3. 1). ИФ3 связывается с рецептором на поверхности ЭПР, открывая лигандзависимыеСа-каналы, что приводит к увеличению концентрации Са в цитозоле. Са связывается со специфическими Са-связывающими белками (калмодулином).Комплекс Са-калмодулин присоединяется к белкам-мишеням, изменяя их активность. Калмодулин является субъединицей Са-калмодулинзависимыхпротеинкиназ (СаМкиназы). СаМкиназыфосфорилируют ферменты-мишени, меняя их активность. 2). ДАГ две роли:
а). ДАГ может гидролизоваться с образованием арахидоновой кислоты, необходимой для синтеза простогландинов.
б). ДАГ способен активировать специфическуюпротеинкиназу (ПКС), которая фосфорилирует ряд белков.
2. Гормон роста (соматотропный гормон, СТГ) синтезируется в ацидофильных клетках передней доли гипофиза. СТГ человека состоит из 191 аминокислоты и содержит 2 дисульфидные связи; N- и C-концевые аминокислоты представлены фенилаланином. СТГ усиливает биосинтез белка, ДНК, РНК и гликогена, способствует мобилизации жиров из депо и распаду высших ЖК и глюкозы в тканях, активирует процессы ассимиляции, стимулирует рост скелета, координирует и регулирует скорость протекания обменных процессов. Многие эффекты осуществляются через особый белковый фактор. Существует две теории, объясняющие механизм действия ГР: теория прямого воздействия и теория соматомедина (опосредованного воздействия). Согласно первой из теорий, свободные молекулы соматотропина могут воздействовать непосредственно на клетки, связываясь с рецепторами гормона роста на их поверхности. Вторая теория гласит, что гормон роста оказывает свое действие на организм посредством промежуточного вещества. Было установлено, что таким веществом является именно инсулиноподобный фактор роста.
Гормоны передней доли гипофиза (аденогипофиза):
1. простые белки;
2. гликопротеины;
3. пептиды семейства проопиомеланокортина (ПОМК).
Гормоны - простые белки:
1. гормон роста (ГР);
2. пролактин (ПРЛ);
3. плацентарный пролактин (лактоген) (ПЛ) - хорионический соматомаммотропин (ХС).
Эти гормоны стимулируют рост и лактацию. Содержат 190-195 аминокислот, они близки по строению и эффекту.
Гормон роста содержит 191 АК. Строение на 85% аналогично строению холестерина (ХС) и на 35%- с пролактином (ПРЛ). Концентрация гормона роста выше, чем других гормонов. Секретируется эпизодически. Влияют стрессовые состояния, белковая пища, физические упражнения – при этом повышается секреция.
Влияние на обмен веществ:
а) повышает синтез белка:
- повышает транспорт АК в клетки;
- повышает синтез РНК и ДНК;
- повышает интенсивность трансляции белков.
Гормон роста действует через инсулинподобный фактор роста (ИФР-1,2). ИФР-1- это главный посредник в действии гормона роста.
б) влияет на углеводный обмен - антагонист инсулина:
- повышает содержание глюкозы в крови - гипергликемия;
- снижает периферическую утилизацию;
- повышает продукцию глюкозы в процессе глюконеогенеза.
в) влияет на липидный обмен, стимулирует липолиз:
- увеличивает скорость окисления ВЖК (в печени).
г) влияет на минеральный обмен:
- задерживает в организме кальций, магний, фосфор, стимулирует рост костной ткани.
Гиперсекреция гормона роста у детей проявляется в виде гигантизма, у взрослых - акромегалия. Дефицит - гипосекреция - приводит к карликовости.
Пролактин - белок, состоящий из 198 АК. Его секреция увеличивается при беременности и лактации. Участвует в инициации лактации и поддерживает ее уровень. Внутриклеточный медиатор для ПЛ не известен.
Хорионический соматомаммолиберин (плацентарный лактоген) - не выполняет строго специфических функций, стимулирует лактацию и лютеотропную активность. Эффекты метаболизма такие же, как и у гормона роста.
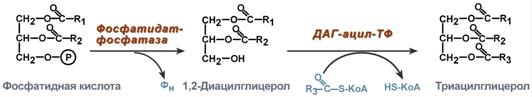
3.. Роль печени в обмене липидов (их депонировании):
а) синтез, распад, удлинение, укорочение ЖК
б) распад, синтез и модификация СЖК
в) синтез большинства ЛПНП и 90% ХС в организме
г) из ХС синтезируются желчные кислоты, входящие в состав желчи.
Жировая дистрофия печени:
-в энтероцитах накапливаются липиды
-развивается как ответ на острую или хроническую интоксикауию
Причины:
- накопление высших ЖК
- недостаток АК
- алкоголизм, следовательно нарушение синтеза апо-белков
- недостаток фосфолипидов
. Печень играет ключевую роль в метаболизме липидов:
•в ней синтезируются, распадаются, удлиняются и укорачиваются жирные кислоты, поступающие с пищеили образующиеся при распаде простых и сложных липидов;
•распадаются и синтезируются триацилглицеролы;
•синтезируется большинство липопротеинов и 90 % из общего количества холестерола в организме;
•в печени из холестерола синтезируются желчные кислоты, которые входят в состав желчи, необхо-димой для переваривания липидов в кишечнике;
•печень — единственный орган, в котором синтезируются кетоновые тела;
•в печени синтезируются витамин А и 25-гидроксихолекальциферол (предшественник витамина D3), запасается (!) витамин В12.
4. Гниение белков – это бактериальный распад белковых веществ и АК под действием микрофлоры кишечника. Идет в толстой кишке, однако может наблюдаться и в желудке – при снижении кислотности в нем.
Механизм обезвреживания – конъюгация (связывание) токсина с активной формой серной или глюкуроновой к-ты. Продукты конъюгации – нетоксичные вещества, которые могут выделяться с мочой.
Конъюгация - это присоединение к функциональным группам, образовавшимся в первой фазе или уже имеющимся у ксенобиотиков, других молекул или групп, увеличивающих гидрофильность и уменьшающих их токсичность.
Образовавшийся при распаде гемоглобина билирубин (Б.) поступает в кровь и там связывается с альбуминами плазмы (это непрямой Б.). Также имеется прямой Б.
Попадая в печень Б. ковалентно связывается с двумя мол. УДФ -глюкуроновой кислоты, образуя диглюкуронид билирубина, или связанный билирубин. Далее Б. поступает в тонкий кишечник, где из него образуется мезобилирубин, которые затем под действием микроорганизмов восстанавливается в уробилиноген, часть которого всасывается и поступает в печень (истинный уробилин), где разрушается. Большая часть уробилиногена поступает в толстый кишечник, где восстанавливается в стеркобилиноген (80% которого выделяется с калом) и под влиянием воздуха окисляется в стеркобилин, придающий характерную окраску стулу.
гем (Fe2+)® (над: оксигеназа) гемин(Fe3+) (это ферри форма) ® (над: редуктаза; под: НАДФH2®НАДФ) гемин (Fe2+) (ферро форма) ® (над: редуктаза, +О2; под: НАДФН2®НАДФ)оксигемин (Fe3+)® (над: редуктаза, +О2; под: -СО, -Fe3+)биливердин® (над: НАДФН2®НАДФ) ®билирубин® (над: +альбумин) билирубин-альбумин (неконъюгированный билирубин - НБ).
Как видно из схемы, в процессе реакций катаболизма гема, гемин восстанавливается с помощью редуктаз (НАДФН2) в ферро-форму (Fe2+).
При участии НАДФН2, кислород проходит последующее превращение с раскрытием тетрапирольного кольца гема, с выделением окиси углерода (СО) и освобождением ферри-иона (Fe3+).
Образуется ациклическое соединение биливердин, у которого редуктаза восстанавливает метиловый мостик между 3 и 4 пирролами, образуется желтый, токсический для клеток, пигмент – билирубин.
За сутки у взрослого человека массой 70 кг образуется 250-350 мг билирубина. Химические превращения гема в билирубин в клетках МФ можно наблюдать внутри организма в гематоме, где пурпурный цвет, обусловленный гемом, медленно переходит в желтый цвет, обусловленный билирубином.
Образованный в клетках билирубин является токсическим веществом, удаляется из них и поступает в кровь, взаимодействуя с транспортными белками - альбуминами. Образованное комплексное соединение билирубин-альбумин называется неконъюгированный билирубин - НБ.
НБ имеет свойства:
1. токсичен;
2. гидрофобен;
3. адсорбирован на альбумине;
4. не проходит через почечный эпителий;
5. не дает прямой реакции с диазо-реактивом Эрлиха.
НБ с помощью альбумина поступает для детоксикации в печень, где в гепатоцитах, в реакции конъюгации с глюкуроновой кислотой, при участии ТФ образуются:
- билирубин-моноглюкурониды (20%);
- билирубин-диглюкурониды (80%).
Эти билирубины носят название конъюгированного билирубина – КБ.
КБ имеет свойства:
1. не токсичен;
2. гидрофилен;
3. не связан с белками;
4. легко проникает через почечный барьер;
5. дает прямую реакцию с диазо-реактивом Эрлиха.
5. 


Билет
1. гормоны, классифик
2. г. Мозг вва надпочечников
3. мет пути с глю, феохромоцитома
4. антитокс ф печени. Квик-пытеля
5. 4 мехма регуляции мет путей
1.. Гормоны. Классификация........
Гормоны по химической природе делятся на:
1. Гормоны белковой природы
Гормоны - сложные белки (тиреотропин, гонадотропины)
Гормоны - простые белки (соматотропин, инсулин)
Гормоны - пептиды (глюкагон, кортикотропин,)
2. Производные аминокислот
адреналин, серотонин, тироксин
3. Стероиды (производные холестерола и других полиизопренов)
альдостерон, кортизол, половые гормоны, ретиноевая кислота
4. Эйкозаноиды (производные 20-углеродных, полиненасыщенных жирных кислот)
простагландин Е1, тромбоксан А2.
Большинство гормонов пептидной природы действуют через рецепторы на клеточной мембране, активируют вторичные посредники, которые изменяют (усиливают или уменьшают) функцию уже существующих клеточных компонентов.
Гормоны стероидной природы активируют через внутриклеточные рецепторы транскрипцию определенных генов и трансляцию новых белков, т.е. синтез новых клеточных компонентов.
2. Гормоны мозгового слоя - адреналин и норадреналин - производные тирозина. [схема образования: тирозин ® (оксигеназа, 1/2О2)диоксифенилаланин ® (декарбоксилаза, -СО2)дофамин ® (+О2)норадреналин ® (+СН3)адреналин].


Органы-мишени - печень, скелетные мышцы, сердечная мышца, слюнные железы, матка.
Механизм: через аденилатциклазную систему. Увеличивается цАМФ ® увеличение протеинкиназы ® увеличение фосфорилирования. Фосфорилазы действуют на превращение гликогена в глюкозу.
Адреналин действует и в печени, и в мышцах, вследствие чего повышается содержание глюкозы в крови, повышается содержания молочной кислоты. Адреналин повышает потребление кислорода, увеличивает липолиз, что приводит к росту количества свободных жирных кислот в крови. Повышает кровяное давление, частоту сердечных сокращений. Адреналин действует на a1, a2, b1 и b2-адренорецепторы. Если гормоны связаны с b-рецепторами, то происходит активация цАМФ, если с a-рецепторами - ингибирование цАМФ.
Гормоны мозгового слоя надпочечников: катехоламины (адреналин, норадреналин). Химическая природа: производные АК. Механизм действия (цАМФ):1) секрецию глюкагона и ¯ секрецию инсулина 2) секрецию паратирина 3) гликогенолиз 4) глюконеогенез в печени 5) липолиз.
Фе́охро́моцито́ма — гормонально активная опухоль хромаффинных клеток симпато-адреналовой системы надпочечниковой или вненадпочечниковой локализации, секретирующая большое количество катехоламинов
3. После принятия пищи концентрация глюкозы в крови может достигать 6 ммоль/л, глюкоза поступает в печень и превращается там в глюкозо-6-фосфат. Эту реакцию катализирует глюкокиназа (в других клетках гексокиназа). Глюкокиназа не ингибируется глюкозо-6-фосфатом.
Далее гл-6-ф может иметь различную судьбу:
- когда потребность в продуктах метаболизма в качестве источника топлива высока, происходит расщепление до ацетил-КоА, из которого затем синтезируются кетоновые тела.
- когда потребность в источниках энергии – продуктах внутриклеточного метаболизма низкая, происходит синтез триацилглицеролов, фосфолипидов, гликогена (запасание происходит под действием инсулина)
4. Исследование антитоксической функции. Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата натрия он в печени соединяется с глицином с образованием гиппуровой кислоты, которую определяют в моче.
Антитоксическая функция. Поступающие в организм ксенобиотики (чужеродные вещества) и обра-зующиеся в самом организме токсичные или непригодные для дальнейших превращений продукты метаболиз-ма обезвреживаются в печени следующими способами:
•метилированием (никотиновая кислота);
•ацетилированием (сульфаниламидные препараты);
•окислением (алкоголь, ароматические углеводороды, катехоламины, биогенные амины);
•восстановлением (нитробензол);
•путём синтеза мочевины (аммиак);
•конъюгацией, т. е. связыванием с сильно полярными, отрицательно заряженными молекулами — ак-тивными формами глюкуроновой или серной кислот — УДФ-глюкуроновой кислотой и ФАФС (фосфоаденоз-инфосфосульфатом). Так метаболизируются стероидные гормоны, билирубин, продукты гниения белков в ки-шечнике, фенолы, желчные кислоты;
•с помощью микросомной системы монооксигеназ (лекарственные препараты и канцерогены) и ре-дуктаз (кетоны, альдегиды, красители);
•с помощью ферментов пероксисомного окисления — оксидаз и каталаз (мочевая кислота, аминокис-лоты, лактат, пероксид водорода).
5. Сходные механизмы регуляции:
- обеспечение субстратами
- аллостерические взаимодействия
- ковалентная модификация
- уровень фермента
- разделение метаболических процессов по отдельным отсекам (компартментам): в цитозоле – гликолиз, пентозофосфатный путь, синтез ЖК; в митохондриях – цикл Кребса, окислительное фосфорилирование, β-окисление, синтез и утилизация кетоновых тел; в цитозоле и митохондриях – глюконеогенез, синтез мочевины.
Билет
1.внутрикл р, пути сигнала для эстрогенов и глюкокортик
2. сах диабет. Восст путь обмена глю
3. бх диагност пораж печени
4. микросом сма (в печени)
5. субстраты для нервн ткани
1. 2. Внутриклеточные
1 класс - ядерные и цитозольные ассоцииров. с hsp
2 класс – ядерные и цитозольные неассоц. c hsp
Механизм действия стероидных половых гормонов (андрогены,прогестерон), кроме эстрогенов: связываются с рецептором в цитоплазме. Рецептор состоит из трех доменов. Гормон связывается с доменом 1 (гормонсвязывающий домен).Происходит изменение конформации домена 1, эти изменения передаются домену 2 (ДНК-связывающему домену). Уходят белки теплового шока hsp,блокировавшие ДНК-связывающий домен, выходят 2 цинковых пальца и с их помощьюпроисходит димеризация 2-ух рецепторов – образуется гомодимер. Этот гомодимер перемещается в ядро и цинковыми пальцами связывается с ДНК. Активируется домен 3 (домен для связывания и активации факторов транскрипции).Рецепторы для эстрогенов построены аналогично цитозольным, но располагаются сразу в ядре.
Глюкокортик: Механизм действия:
Рецепторы расположены в цитоплазме, состоят из трех частей:
1) домен АF1 – активатор транскрипции 2) ДНК-связывающий домен (имеет цинковые пальцы, закрытые белком – ингибитором hsp) 3) гидрофобный карман.
Гормон + гидрофобный карман ® сброс белка теплового шока (hsp) ® освобождение цинковых пальцев ®димеризация рецепторов (гомодимер)® связь с ДНК ® запуск транскрипции.
2. Сахарный диабет- группа эндокринных заболеваний, развивающихся вследствие абсолютной или относительной недостаточности гормона инсулина, в результате чего развивается гипергликемия. Метаболизм глюкозы в инсулиннезависимых тканях:
1) глюкоза проникает в клетку ® сорбитол (с помощью альдозоредуктазы и НАДФН+Н+)®фруктоза (под действием сорбитолДГ). В норме этот путь происходит в клетках артериальных стенок, клетках Шванна, в эритроцитах, в хрусталике и сетчатке глаза, в семенниках
2) глюкоза связывается с аминогруппами белков (гликозилирование), что изменяет строение белков и нарушает их функции. Может быть гликозилирование гемоглобина, белков базальных мембран ® изменение капилляров, утолщение базальных мембран.
Восстановительный путь обмена глюкозы при сахарном диабете – образование сорбитола: глюкоза проникает в клетку ® сорбитол (с помощью альдозоредуктазы и НАДФН+Н+). Это наиболее интенсивно протекает в артериальных стенках, кл Шванна и т.д. Сорбитол вызывает осмотическое набухание клеток и нарушение их функций.
Основной механизм повреждения тканей при сахарном диабете - гликозилирование белков - не ферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (лиз, арг). При этом нарушаются функции белков в результате изменения заряда белковой молекулы, ее конформации или блокирования активного центра, что приводит со временем к ангиопатиям (повреждениям базальных мембран сосудов).
Недостаток инсулина ® мобилизация жиров ® заполнение кровеносного русла СЖК и ТАГ ® ингибирование синтеза ВЖК ® катаболические пути не справляются с избытком образующегося ацетил-КoA ® в печени из ацетил-КoA синтезируются кетоновые тела ® накопление в крови (кетоз), т.к. скорость их образования превышает возможности клеток по их использованию ® метаболический ацидоз.
3. С помощью биохимических тестов можно выявить изменения при поражении менее 5% паренхимы печени, тогда как клинически заболевание проявляется при поражении >80%.
7. Исследование активности ферментов плазмы крови, характеризующих печеночный обмен.
При заболеваниях паренхимы в крови резко увеличен уровень органо-специфического фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность холинэстеразы.
При незначительных поражениях гепатоцитов: в плазме крови увеличивается активность цитоплазматических ферментов печени (АлАТ, АсАТ, сорбитолдегидрогеназы, g-глутамилтранспептидазы).
При сильном поражении гепатоцитов повышается активность митохондриальных ферментов: глутамилдегидрогеназы, митохондриальной АсАТ.
При механической желтухе в крови возрастает щелочная фосфатаза и лейцинаминопептидаза.
При длительном декомпенсированном поражении снижается активность холинэстеразы, ЛХАТ, содержание факторов свертывания крови и общее содержание белков крови.
4. 
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткую цепь, которая заканчивается цитохромом P450. Цитохром Р450 взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способоствуя появлению у нее гидрофильности, а другой – в молекулу воды.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Основным белком этого процесса является гемопротеин – цитохром Р450.
Работа цитохрома Р450 обеспечивается двумя ферментами:
НАДН‑цитохром b5‑оксидоредуктаза, содержит ФАД,
НАДФН‑цитохром Р450‑оксидоредуктаза, содержит ФМН и ФАД.
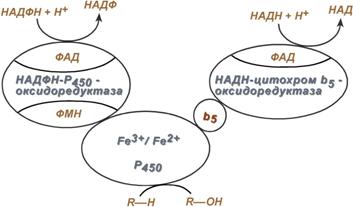
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.
Существенной особенностью микросомального окисления является способность к индукции или ингибированию, т.е. к изменению мощности процесса.
Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Они бывают
1. Широкого спектра действия, которые обладают способностью стимулировать синтез цитохрома Р450 и НАДФН-цитохром Р-450-редуктазы, глюкуронилтрансферазы. Классическим представителем являются производные барбитуровой кислоты – барбитураты, также сюда относятся диазепам, карбамазепин, рифампицин и др.
2. Узкого спектра действия, т.е. стимулируют одну из форм цитохрома Р450 – ароматические полициклические углеводороды (метилхолантрен, спиронолактон и многие другие)
Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема. Они делятся на:
1. Обратимые
прямого действия – угарный газ (СО), антиоксиданты,
непрямого действия, т.е. влияют через промежуточные продукты своего метаболизма, которые образуют комплексы с цитохромом Р-450 – эритромицин.
2. Необратимые ингибиторы – аллопуринол, аминазин, прогестерон, оральные контрацептивы, тетурам, фторурацил,
5.. Глюкоза – главный энергетический субстрат, использующийся нервной тканью в норме. Запасы гликогена в мозге незначительны (0,1 % от массы мозга). Гликоген сосредоточен главным образом в астроглии. Высокая потребность в энергии при низких запасах гликогена ставит нервные клетки в прямую зависимость от доставки глюкозы из крови. Потребность в глюкозе довольно высокая. В спокойном состоянии мозг потребляет около 5 мг глюкозы в 1 мин на 100 г массы мозга. В обычных условиях эта потребность удовлетворяется, однако гипогликемия вызывает нарушения функции клеток мозга. При голодании, в первые часы происходит мобилизация глюкозы из депо, затем уровень глюкозы в крови поддерживается благодаря глюконеогенезу. В поздние сроки (1 неделя) голодания в качестве источника энергии нервные клетки могут использовать кетоновые тела.
Билет
1.цамф, аденилатцико мехм
2.стг
3.роль печени в об
4. метаб билирубина в жкт
5. аллостерич рег акт ферм. Физиоло конц глю в крови
1. При контакте с α-субъединицей Gs-белка мембранный фермент аденилатциклаза активируется и катализирует образование вторичного посредника – цАМФ (повышение его концентрации в клетках кратковременно, распадается под действием фосфодиэстераз до 5-АМФ). цАМФ-аллостерический активатор протеинкиназы А. ПКА фосфорилирует ключевой фермент (присоединяя фосфат к остаткам СЕР, ТРЕ).
Механизм действия: паратгормон взаимод. с 7-тмс-рец. = > активация аденилатциклазы = > повыш. уровня цАМФ, ионизированного кальция, ДАГ, инозитолтрифосфата = > активация остеокластов.
2. см. выше
3. Роль печени в обмене белков. Освобождающиеся в процессе пищеварения аминокислоты попа-дают с током крови в печень и используются для:
•синтеза белков плазмы крови (альбуминов, глобулинов, факторов свёртывания крови);
•образования α-кетокислот путём трансаминирования или окислительного дезаминирования амино-кислот;
•глюконеогенеза;
•синтеза кетоновых тел;
•получения энергии, подвергаясь превращениям в цикле трикарбоновых кислот;
•синтеза мочевины;
•синтеза креатина, холина.
Функции альбуминов плазмы:
1.Создают большую часть онкотического давления, обеспечивая нормальное распределение воды и ионов между кровью и тканевой жидкостью, мочеобразование.
2.Служат белковым резервом крови, который составляет 200 г белка. Он используется организмом при белковом голодании.
3.Благодаря отрицательному заряду способствуют стабилизации и препятствуют оседанию форменных элементов крови.
4.Поддерживают кислотно-щелочное равновесие, являясь буферной системой.
5.Переносят половые гормоны, желчные пигменты и ионы кальция.
Глобулины включают четыре субфракции – a1, a2, b и g-глобулины. Функции глобулинов:
1.a-глобулины участвуют в регуляции эритропоэза, т.к. один из них является эритропоэтином.
2.Необоходимы для свертывания крови, т.к. к ним относится один из факторов свертывания -.
3.Участвуют в растворении тромба, т.к. содержат фермент фибринолитической системы плазминоген.
4.a2-альбумин церулоплазмин переносит 90% ионов меди, необходимых организму.
5.Переносят гормоны тироксин и кортизол
4. см.выше
5. Заключается в увеличенной утилизации аминокислот для энергитических целей, усилении гликолиза и активности пируватдегидрогеназы, увеличении всинтеза гликогена для пополнения его запасов и усиление синтеза жирных кислот.
Ферменты.
фосфофруктокиназа1(актив фруктозо-2,6 - ФФ, ингибируется АТФ цитратом)
фруктозо-бифосфатаза 1 (ингибируется фруктозо-2,6 - ФФ, активируется АТФ)
пируваткиназа (активир фруктозо-1,6-ФФ, ингиб АТФ)
пируватдегидрогеназа (актив пируватом)
ацетил КоАкарбоксилаза(активируется цитратом)
ацилкарнитинтрансфераза(ингиб малонил-КоА)
гликогенсинтаза(актив гл6-ф)
фосфорилаза (ингиб глюкозой и гл-6-ф)
Физиологич конц глю в крови 3,3—5,5 ммоль/л
Билет
1.гормоны, схема сигнала
2. половы г. Рецепт андрог и эстрогенов
3. распад hb в печени рисунок
4.мет пути обмена углев в печени. Пфп и глюкуроновый путь
5. особенности мет-ма У,Л,Б после приема пищи, схема связи
1. ищи выше и ниже
2. Гормоны половых желез: женские (эстроген, прогестерон, активин, ингибин, фолистатин, релаксин – синтезируются в яичниках), мужские (андрогены – тестостерон и дигидрокситестостерон, ингибин, активин – синтезируются в семенниках). Гормоны стероидной природы: эстроген, прогестерон, тестостерон, белковой природы: активин, фолистатин, ингибин, релаксин.
Механизм действия стероидных половых гормонов (андрогены,прогестерон), кроме эстрогенов: связываются с рецептором в цитоплазме. Рецептор состоит из трех доменов. Гормон связывается с доменом 1 (гормонсвязывающий домен).Происходит изменение конформации домена 1, эти изменения передаются домену 2 (ДНК-связывающему домену). Уходят белки теплового шока hsp,блокировавшие ДНК-связывающий домен, выходят 2 цинковых пальца и с их помощьюпроисходит димеризация 2-ух рецепторов – образуется гомодимер. Этот гомодимер перемещается в ядро и цинковыми пальцами связывается с ДНК. Активируется домен 3 (домен для связывания и активации факторов транскрипции).Рецепторы для эстрогенов построены аналогично цитозольным, но располагаются сразу в ядре.
Эффект эстрогенов: стимулируют: 1) пролиферация эндотелия 2) возбудимость миометрия 3) рост протоков молочной железы 4) секреция пролактина (но не действие) 5) транспортные белки печени 6) анаболики 7) приводят к гипотермии 8) задерживают воду.
Функции прогестерона: стимулирует: 1) развитие желез матки, индуцирует превращение клеток стромы в децидуальные клетки 2) снижает возбудимость миометрия 3) рост альвеол грудной железы 4) катаболик 5) повышает температуру тела 6) натрийуретик
Эффект андрогенов: стимулирует: 1) сперматогенез 2) вторичные половые признаки 3) анаболик
3. 
И отличия ищи тут где то
4. В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Активный синтез гликогена происходит после приема пищи, когда концентрация глюкозы в крови воротной вены достигает 20 ммоль/л. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенез из аминокислот и глицерина.
Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз (фруктозы, галактозы) в глюкозу.
Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот и холестерола из глюкозы.
Пфп

Глюкуроновый

5. Основные особенности белков, жиров, УВ в печени после принятия пищи.
1. Поддержание ур-ня глюкозы на постоянном уровне: после принятия пищи концентрация глюкозы в крови достигает 6 и выше ммоль/л, она поступает в печень и превращается там в гл-6-фосфат, т.к.:
-противоположно миоцитам и адипоцитам инсулин не оказывает здесь прямого влияния на поглощение глюкозы
-интенсивность фосфорилирования глюкозы в печени пропорциональна концентрации глюкозы в крови
-в гл-6-фосфат в печени превращаются другие моносахариды, подвергшиеся всасыванию в кишечнике (фруктоза, галактоза)
2. увеличение утилизации АК для энергетических целей, усиленный гликолиз и активность пируват ДГ, увеличение синтеза гликогена, усиление синтеза ЖК.
3.ЖК используются для синтеза ТАГ, фосыолипидов, которые в составе липопротеинов секретируются в кровоток.
Билет
1. рецепторы. Пример передачи сигнала
2. вазопрессин
3. конц каких в-в уменьш или увелич при удал печени…ппц
4.возможн пути оксил этанола и ацетальдегида…
5. ковалентная модификация структуры ферментов
1.см.выше
2. см.выше
3. без б гг
4. Метаболизм этанола осуществляется тремя ферментативными системами: 1) алкогольдегидрогеназной (80%) 2) микросомальной этанолокисляющей системой (МЭОС – 15%) 3) каталазой (5%).
1) Алкогольдегидрогеназа наиболее активно метаболизирует этанол в печени, преимущественна локализована в цитозоле клеток (только 10% - в ЭПС и митохондриях). Катализирует реакцию образования ацетальдегида: этанол + НАД+ ® ацетальдегид + НАДН+Н+.
2) МЭОС катализирует реакцию: этанол + НАДФН+Н+ + О2 ® ацетальдегид + 2 Н2О.
3) каталаза катализирует реакцию: этанол + Н2О2 ® ацетальдегид + 2 Н2О.
Образующийся ацетальдегид далее окисляется ацетальдегиддегидрогеназой в уксусную кислоту, которая превращается в ацетил-КоА и 1) вступает в ЦТК или 2) идет на синтез ВЖК и холестерола. В сутки в тканях человека образуется и окисляется 1-9 г этанола.
5. ковалентная модификация фермента:
1) частичный протеолиз (ограниченный протеолиз). Таким образом активируются ферменты пищеварительного канала: пепсин, трипсин, химотрипсин. Трипсин имеет состояние профермента трипсиногена, состоящего из 229 АК остатков. Под действием фермента энтерокиназы и с добавлением воды он превращается в трипсин, при этом отщепляется гексапептид. Изменяется третичная структура белка, формируется активный центр фермента и он переходит в активную форму.
2) фосфорилирование - дефосфорилирование. Пр.: липаза+АТФ= (протеинкиназа) фосфорилированная липаза+АДФ. Это трансферная реакция, использующая фосфат АТФ. При этом осуществляется перенос группы атомов от одной молекулы к другой. Фосфорилированная липаза является активной формой фермента.
Поддержание ур-ня глюкозы на постоянном уровне: после принятия пищи концентрация глюкозы в крови достигает 6 и выше ммоль/л, она поступает в печень и превращается там в гл-6-фосфат, т.к.:
-противоположно миоцитам и адипоцитам инсулин не оказывает здесь прямого влияния на поглощение глюкозы
-интенсивность фосфорилирования глюкозы в печени пропорциональна концентрации глюкозы в крови
-в гл-6-фосфат в печени превращаются другие моносахариды, подвергшиеся всасыванию в кишечнике (фруктоза, галактоза)
При голодании, в первые часы происходит мобилизация глюкозы из депо, затем уровень глюкозы в крови поддерживается благодаря глюконеогенезу. В поздние сроки (1 неделя) голодания в качестве источника энергии нервные клетки могут использовать кетоновые тела.
Билет
1. гормоны, синтез, транспорт
2. гормоны регулир ур глю. Пример мех-ма одного г., повыш уровень глю
3. превращ глю, где удф-глюкуроновая к-та, тесты антиткосич ф-ии печени
4. роль печени в ол. Синтез жк и хс.
5. мет пути в печени в жир тк при голодании
1.см.выше
2. самыми главными гормонами, учавств в метаболизме глюкозы явл инсулин и глюкагон.
Инсулин синтезируется на полирибосомах B-клетками поджелудочной железы. Хим.прир: препроинсулин имеет 23-аминокислотный сигнальный пептид, удаляемый при поступлении в эндопл сеть. Остаток молекулы сворачивается и при участии дисульфидных мостиков обр проинсулин. Пептидный сегмент, соединяющий А- и В-цепи - С-пептид.
. Влияние инсулина на метаболизм углеводов:
1) на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция глюкокиназы гл в гл-6-ф концентрация свободной гл поддерживается на низком уровне гл проникает в кл путем простой диффузии по градиенту концентрации.
2) на утилизацию гл: усиливает гликогенез (например, повышает активность гликогенсинтазы)
3) на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4) на метаболизм гл: содержание гл в крови.
Расстройство метаболизма углеводов при диабете: 1) гипергликемия из-за а) пониженного проникновения гл в клетки б) утилизации гл различными тканями в) глюконеогенеза в печени 2) снижение гликогенеза.
Человеческий глюкагон - линейный полипептид. Образуется альфа-клетками панкреатических островков и верхних отделов ЖКТ. Содержит 29 ак.
Глюкагон стимулирует глюконеогенез. Действует на 7ТМС рец, в печени после взаим с рец он действует через Gs-белок, активируя аденилатциклазу и стимулируя образование ц АМФ. Это ведет при участии протеинкиназы к активированию гликогенфосфорилазы и увеличению распада гликогена, повышению уровня глюкозы в плазме. кроме того, протеинкиназа А, активируемая глюкагоном, снижает утилизацию гл-6-ф, ингибируя преобразование фосфоенолпирувата в пируват. Это ведет к уменьшению концентрации фр-2,6-дифосфата, что, в свою очередь, ингибирует преобразование фр-6-ф в фр-1,6-дифосфат. Конечный эффект указанных изменений - увеличение уровня гл-6-ф, который в печени превращается в свободную глюкозу. Глюкагон– пептид, образуется α-клетками островков Лангерганса поджелудочной железы. Механизм действия (7-TMS р-ры): гликогенолиз, глюконеогенез, образование кетоновых тел и липолиз.
3. 
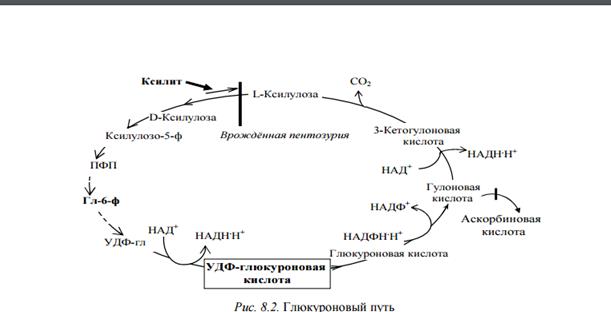
При распаде гемоглобина непрямой билирубин (свободный) поступает в кровь и связывается с альбуминами плазмы. Затем он поступает в печень, где связывается с 2 молекулами УДФ-глюкуроновой кислоты под действием УДФ-глюкуронилтрансфреразы с образованием билирубиндиглюкуронида – прямого (связанного) билирубина. Свободный билирубин, в отличие от связанного, не дает цветную реакцию с диазореактивом Эрлиха, пока белки плазмы крови не осаждены спиртом.
. Исследование антитоксической функции. Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата натрия он в печени соединяется с глицином с образованием гиппуровой кислоты, которую определяют в моче.
Антитоксическая функция. Поступающие в организм ксенобиотики (чужеродные вещества) и обра-зующиеся в самом организме токсичные или непригодные для дальнейших превращений продукты метаболиз-ма обезвреживаются в печени следующими способами:
•метилированием (никотиновая кислота);
•ацетилированием (сульфаниламидные препараты);
•окислением (алкоголь, ароматические углеводороды, катехоламины, биогенные амины);
•восстановлением (нитробензол);
•путём синтеза мочевины (аммиак);
•конъюгацией, т. е. связыванием с сильно полярными, отрицательно заряженными молекулами — ак-тивными формами глюкуроновой или серной кислот — УДФ-глюкуроновой кислотой и ФАФС (фосфоаденоз-инфосфосульфатом). Так метаболизируются стероидные гормоны, билирубин, продукты гниения белков в ки-шечнике, фенолы, желчные кислоты;
•с помощью микросомной системы монооксигеназ (лекарственные препараты и канцерогены) и ре-дуктаз (кетоны, альдегиды, красители);
•с помощью ферментов пероксисомного окисления — оксидаз и каталаз (мочевая кислота, аминокис-лоты, лактат, пероксид водорода).
4. ацетил-КoA ® в печени из ацетил-КoA синтезируются кетоновые тела
Холестерол образуется из ацетил-КоА 
5. 
Билет
1.аденилатциклаза и фофсодиэсераза, схема с цамф, аденилатцикл мех-м
2.глюкокортик. б. кушинга и аддисона
3. роль печени в оу, какой кроме гликогенолиза путь образов глю?
4.глицерофосф путь таг и фл, жиров инфильтр печени, липотропные в-ва и их роль
5.общий катаб-м, общие пути энергии, реакции с атф
1. Самый распространенный второй посредник - цАМФ-аденилатциклазная система. Она состоит из 2 частей: собственно аденилатциклазный компонент и протеинкиназный компонент.
В плазматической мембране находятся рецепторы 2 типов: Rs - стимулирующий и Ri - ингибирующий. Внутри мембран находится G-белок (Gs, Gi) (читается джи-белок). G-белок распадается на a и bg субъединицы, которые могут взаимодействовать между собой. a-субъединица и ГТФ действуют на аденилатциклазу, превращая ее в активную форму. Эта активная аденилатциклаза находится на внутренней поверхности ЦПМ. Под влиянием АЦ АТФ превращается в цАМФ+ФФн. Разрушается цАМФ с помощью фермента - фосфодиэстеразы.
Пример: Механизм действия: паратгормон взаимод. с 7-тмс-рец. = > активация аденилатциклазы = > повыш. уровня цАМФ, ионизированного кальция, ДАГ, инозитолтрифосфата = > активация остеокластов.
АКТГ стимулирует синтез аденилатциклазы
адреналин и норадреналин- Механизм: через аденилатциклазную систему
2. Глюкокортикоиды: кортикостерон, кортизол (самый активный в организме человека), кортизон.
Клетки-мишени для глюкокортикоидов - печень, почки, лимфоидная ткань, соединительная ткань, мышцы.
Рецепторы находятся в цитозоле, проходят через мембрану и действуют на ген. Гормон ® ген ® белок.
Влияние на обмен веществ:
1. активация глюконеогенеза;
2. повышение уровня глюкозы в крови;
3. повышение синтеза гликогена в печени;
4. стимулируют липолиз в области конечностей и липогенез в области туловища и лица;
5. повышение окисления жирных кислот;
6. повышение образования кетоновых тел;
7. в печени увеличивается синтез белка, в мышцах, лимфоидной, соединительной тканях увеличивается распад белка;
8. противовоспалительное действие, вызывают инволюцию лимфоидной ткани;
В основе патогенеза патологических изменений, которые развиваются при синдроме Кушинга со стороны большинства органов и систем, лежит в первую очередь гиперпродукция кортизола. Кортизол в нефизиологических концентрациях оказывает катаболическое действие на белковые структуры и матрицы большинства тканей и структур, в которых постепенно развиваются выраженные дистрофические и атрофические изменения.
Гипофункция
Первичная недостаточность – болезнь Аддисона проявляется:
гипогликемия,
повышенная чувствительность к инсулину,
анорексия и снижение веса,
слабость,
гипотензия,
гипонатриемия и гиперкалиемия,
усиление пигментации кожи и слизистых (компенсаторное увеличение количества, обладающего небольшим меланотропным действием).
Вторичная недостаточность возникает при дефиците АКТГ или снижении его эффекта на надпочечники – возникают все симптомы гипокортицизма, кроме пигментации.
Гиперфункция
Первичная – болезнь Кушинга проявляется:
снижение толерантности к глюкозе – аномальная гипергликемия после сахарной нагрузки или после еды,
гипергликемия из-за активации глюконеогенеза,
ожирение лица и туловища (связано с повышенным влиянием инсулина при гипергликемии на жировую ткань) – буйволиный горбик, фартучный (лягушачий) живот, лунообразное лицо,
глюкозурия,
повышение катаболизма белков и повышение азота крови,
остеопороз и усиление потерь кальция и фосфатов из костной ткани,
снижение роста и деления клеток – лейкопения, иммунодефициты, истончение кожи, язвенная болезнь желудка и двенадцатиперстной кишки,
нарушение синтеза коллагена и гликозаминогликанов,
гипертония благодаря активации ренин-ангиотензиновой системы.
3. под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. 
Роль печени в углеводном обмене – поддержание постоянства глюкозы в крови:
а) набором ферментов синтеза и распада гликогена (гексокиназа, глюкокиназа, гликогенсинтаза, гл-6-фосфатаза)
б) набором ферментов глюконеогенеза
в) набором ферментов, превращающих другие гексозы (галактозу, фруктозу) в глюкозу.
. Функциональные пробы, характеризующие роль печени в углеводном обмене:
а) нагрузочная проба галактозой – в норме выведение галактозы в моче не превышает 8% через 12 ч.
б) нагрузка глюкозой.
4.

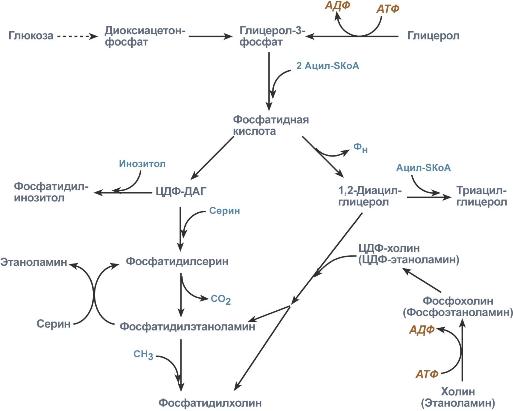
Механизм развития жировой инфильтрации и дегенерации печени: избыточное потребление этанола ® увеличение содержания в гепатоцитах ВЖК и холестерола ® в печени происходит интенсивные распад и синтез фосфолипидов из компонентов нейтрального жира, однако для данного процесса необходимы неорганические фосфаты и так называемые липотропные факторы (холин) ® липотропные факторы не поступают или поступают в малом количестве ® накопление нейтральных жиров в гепатоцитах ® жировая инфильтрация печени и ее дегенерация.
5. В клетке существуют четыре основных процесса, обеспечивающих высвобождение энергии из химических связей при окислении веществ и ее запасание:
1. Гликолиз (2 этап биологического окисления) – окисление молекулы глюкозы до двух молекул пировиноградной кислоты, при этом образуется 2 молекулы АТФ и НАДН. Далее пировиноградная кислота в аэробных условиях превращается в ацетил-SКоА, в анаэробных условиях – в молочную кислоту.
2. β-Окисление жирных кислот (2 этап биологического окисления) – окисление жирных кислот до ацетил-SКоА, здесь образуются молекулы НАДН и ФАДН2. Молекулы АТФ "в чистом виде" не появляются.
3. Цикл трикарбоновых кислот (ЦТК, 3 этап биологического окисления) – окисление ацетильной группы (в составе ацетил-SКоА) или иных кетокислот до углекислого газа. Реакции полного цикла сопровождаются образованием 1 молекулы ГТФ (что эквивалентно одной АТФ), 3 молекул НАДН и 1 молекулы ФАДН2.
4. Окислительное фосфорилирование (3 этап биологического окисления) – окисляются НАДН и ФАДН2, полученные в реакциях катаболизма глюкозы, аминокислот и жирных кислот. При этом ферменты дыхательной цепи на внутренней мембране митохондрий обеспечивают образование большей части клеточного АТФ.

Билет
1.внуртиклет рецеторы г
2.инсулин, синтез, строение,влияние, скорость развития эффекта
3.обезвреживание в печени, тесты антиктоксич ф-ии
4.роль печени в снабжении энергией, схема синтеза источника
5. ферменты и аллостерич регуляторы, поддержив ур глю натощак
1.см.выше
2. Инсулин синтезируется на полирибосомах B-клетками поджелудочной железы. Хим.прир: препроинсулин имеет 23-аминокислотный сигнальный пептид, удаляемый при поступлении в эндопл сеть. Остаток молекулы сворачивается и при участии дисульфидных мостиков обр проинсулин. Пептидный сегмент, соединяющий А- и В-цепи - С-пептид.
Рецептор инсулина: гликопротеин, 1-TMS-рецептор на поверхности клеток-мишеней. Гетеродимер, состоит из двух субъединиц – α и β. Инсулин связывается с α-субъединицей, β-субъединица преобразует полученный сигнал (обладает тирозинкиназной активностью и содержит участок аутофосфорилирования).
Г + рецептор ® изменение конформации α-субъединиц ® активация тирозинкиназной активности β-субъединицы ® активация инсулинорецепторного субстрата (IRS) ® запуск:
а) фосфатидилинозитолкиназный путь ® ДАГ + ИФ3 ® активация 50 ферметов обмена углеводов, липидов, белков, активация движения GLUT4.
б) МАП-киназный путь (митогенактивируемая протеинкиназа) ® Å факторов транскрипции ® синтез белков, стимуляция деления кл.ф
в) активация RAS-белка, связанного с рецептором фактора роста.
. Влияние инсулина на метаболизм углеводов:
1) на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция глюкокиназы гл в гл-6-ф концентрация свободной гл поддерживается на низком уровне гл проникает в кл путем простой диффузии по градиенту концентрации.
2) на утилизацию гл: усиливает гликогенез (например, повышает активность гликогенсинтазы)
3) на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4) на метаболизм гл: содержание гл в крови.
Инсулин – это полипептид, состоящий из 51 АК. Состоит из двух полипептидных цепей: А и B-цепи. Эти цепи соединяются дисульфидными мостиками. [рис. 2-х цепей. А-цепь на левом (N-конце) завершается ГЛИ, на правом (С-конце) – АСП, 21 АК; В-цепь слева ФЕН, справа ТРЕ, 30 АК. 2 дисульфидных мостика]
Инсулин синтезируется в виде проинсулина, который состоит из 84 АК - синтезируется в виде 1 полипептидной цепи. При превращении проинсулина в инсулин отщепляется С-цепь из 33 АК (проинсулин®инсулин+С-пептид).
Клетки-мишени - мышечная ткань, печень, жировая ткань. Рецепторы к инсулину находятся на поверхности клеток. Рецепторы могут подвергаться интернализации, т.е. проникать внутрь мембраны комплексов «инсулин- рецептор», что приводит к разрушению путем эндоцитоза. Это объясняется снижением чувствительности клеток организма к инсулину при ожирении, т.к. количество рецепторов снижается и возникает устойчивость к инсулину. Внутриклеточный медиатор к инсулину не известен. Инсулиновые рецепторы являются ферментами и повышают активность фосфодиэстеразы и снижают уровень цАМФ.
Влияние инсулина на метаболизм:
1. углеводный обмен:
- снижение уровня глюкозы;
- повышение транспорта глюкозы через мембрану мышц и жировую ткань, без повышения специфических переносчиков глюкозы в печень.
- в печени активируется глюкокиназа, т.е. глюкоза®(над стрелкой инсулин) глюкозо-6-фосфат;
- инсулин повышает интенсивность утилизации глюкозы - гликолиз;
- активирует гликогенсинтазу, повышая синтез гликогена;
- снижает активность глюкозо-6-фосфатазы, т.е. глюкоза не выходит из печени;
- инсулин ингибирует глюконеогенез.
Т.е. инсулин стимулирует усвоение глюкозы организмом. 30-40% глюкозы превращается в жиры, 50% идет на гликолиз, а 10% превращается в гликоген.
2. липидный обмен:
- стимулирует липогенез;
- ингибирует липолиз.
3. белковый обмен:
- повышает синтез белка;
- ингибирует распад белка;
- стимулирует транспорт АК в клетки;
- повышает транскрипцию мРНК;
- повышает пролиферацию клеток, усиливая факторы роста фибробластов, тромбоцитарного фактора роста и фактора роста эпидермиса.
3. Антитоксическая функция. Поступающие в организм ксенобиотики (чужеродные вещества) и обра-зующиеся в самом организме токсичные или непригодные для дальнейших превращений продукты метаболиз-ма обезвреживаются в печени следующими способами:
•метилированием (никотиновая кислота);
•ацетилированием (сульфаниламидные препараты);
•окислением (алкоголь, ароматические углеводороды, катехоламины, биогенные амины);
•восстановлением (нитробензол);
•путём синтеза мочевины (аммиак);
•конъюгацией, т. е. связыванием с сильно полярными, отрицательно заряженными молекулами — ак-тивными формами глюкуроновой или серной кислот — УДФ-глюкуроновой кислотой и ФАФС (фосфоаденоз-инфосфосульфатом). Так метаболизируются стероидные гормоны, билирубин, продукты гниения белков в ки-шечнике, фенолы, желчные кислоты;
•с помощью микросомной системы монооксигеназ (лекарственные препараты и канцерогены) и ре-дуктаз (кетоны, альдегиды, красители);
•с помощью ферментов пероксисомного окисления — оксидаз и каталаз (мочевая кислота, аминокис-лоты, лактат, пероксид водорода).
Исследование антитоксической функции. Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата натрия он в печени соединяется с глицином с образованием гиппуровой кислоты, которую определяют в моче.
Исследование антитоксической функции. Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата натрия он в печени соединяется с глицином с образованием гиппуровой кислоты, которую определяют в моче.
4.хз
5.хз.
Билет
1.рецепторы, примеры…
2.инсулин, природа, влияние на метаб-м
3. схема распада hb
4. биохимич маркеры для диагн-ки забол печени,пок-ли белк обмена при болезн печени
5. мет.пути, поддержив ур глю. Гормоны
1.см.выше
2.см.выше
3.см.выше
4. При заболеваниях паренхимы в крови резко увеличен уровень органо-специфического фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность холинэстеразы.
При незначительных поражениях гепатоцитов: в плазме крови увеличивается активность цитоплазматических ферментов печени (АлАТ, АсАТ, сорбитолдегидрогеназы, g-глутамилтранспептидазы).
При сильном поражении гепатоцитов повышается активность митохондриальных ферментов: глутамилдегидрогеназы, митохондриальной АсАТ.
При механической желтухе в крови возрастает щелочная фосфатаза и лейцинаминопептидаза.
При длительном декомпенсированном поражении снижается активность холинэстеразы, ЛХАТ, содержание факторов свертывания крови и общее содержание белков крови.
Азот мочевины / остаточный азот = 0,5 в норме, при поражениях печени снижается.
а) альбуминово-глобулиновый коэффициент А/Г = 1,5-1,7 в норме. При острых поражениях А/Г¯ за счет уменьшения уровня альбуминов, при хронических – за счет повышения глобулинов.
5. При голодании, в первые часы происходит мобилизация глюкозы из депо, затем уровень глюкозы в крови поддерживается благодаря глюконеогенезу
Влияние инсулина на метаболизм углеводов:
1) на транспорт глюкозы через мембрану: облегчает диффузию гл в клетки, кроме печеночных за счет увеличения числа переносчиков GLUT4. В печеночных кл: индукция глюкокиназы® гл в гл-6-ф ® концентрация свободной гл поддерживается на низком уровне ® гл проникает в кл путем простой диффузии по градиенту концентрации.
2) на утилизацию гл: усиливает гликогенез (например, повышает активность гликогенсинтазы)
3) на образование гл: ингибирует глюконеогенез (ингибирует синтез ФЕПКК).
4) на метаболизм гл: ¯ содержание гл в крови.
Расстройство метаболизма углеводов при диабете: 1) гипергликемия из-за а) пониженного проникновения гл в клетки б) ¯ утилизации гл различными тканями в) глюконеогенеза в печени 2) снижение гликогенеза.
Глюкагон повышает уровень цАМФ, следовательно увеличивается протеинкиназа увеличивается количество фосфорилазы-В увеличивается количество фосфорилазы-А, которая действует на превращение гликогена в глюкозу.
Билет
1.g-белки, виды, пример сигнала. Холерный токсин
2. йодсодер г. Щж
3. биохим проц печени регулир конц глю и хс в крови, пути использ хс в печени
4. обтурац желтуха
5. мет. пути в жир и мыш ткани после еды, схема синтеза таг в жир тк, отличие от синт в печени
1. Внутриклеточные петли этих рецепторов содержат центры связывания G-белка.G-белок-тримерный белок (α, β, γ), обладает ГТФ-азной активностью.
Механизм действия. После связывания сигнальной молекулы с рецептором клетки-мишени происходит замена ГДФ (который связан с α-субъединицей G-белка) на ГТФ, и G-белокдиссоциирует на α-субъединицу и димер субъединиц βγ. Далее – в зависимости от субклассаG-белка: если Gαs-белок-происходит активация аденилатциклазы (β-адренэргический рецептор);если Gαi-белок - ингибирование аденилатциклазы (α2-адренергический рецептор); если Gαq-белок – активация фосфолипазы С.
При контакте с α-субъединицей Gs-белка мембранный фермент аденилатциклаза активируется и катализирует образование вторичного посредника – цАМФ (повышение его концентрации в клетках кратковременно, распадается под действием фосфодиэстераз до 5-АМФ). цАМФ-аллостерический активатор протеинкиназы А. ПКА фосфорилирует ключевой фермент (присоединяя фосфат к остаткам СЕР, ТРЕ).
Следующий класс 7-ТМС рецепторов связывается через Gq-белок с фосфолипазой С. При контакте с α-субъединицей фосфолипаза С катализирует гидролиз фосфатидилинозитолдифосфата на ДАГ и Дата добавления: 2017-01-28; Мы поможем в написании ваших работ!; просмотров: 848 | Нарушение авторских прав Лучшие изречения:






