Введение
Скорость отдельных стадий коррозионного процесса, как и других химических и электрохимических реакций зависит от температуры Т. При повышении Т кислотная коррозия ускоряется, а скорость коррозии с кислородной деполяризацией может проходить через максимум за счет осложняющего влияния снижения растворимости кислорода с ростом Т.
Анализ температурной зависимости любого процесса основан на термодинамике лимитирующей стадии. При электродных реакциях в качестве замедленной стадии рассматриваются стадии разряда-ионизации или транспортной стадии (диффузия, конвекция, миграция), Температурная зависимость скорости процесса  обычно описывается уравнением Аррениуса:
обычно описывается уравнением Аррениуса:
 (1)
(1)
где А- энергия активации, представляющая собой потенциальный барьер на пути реакции.
Для электродных процессов истинную энергию активации, отвечающую заданному гальвани-потенциалу, определить невозможно. Поэтому экспериментально находят эффективную или реальную энергию активации  при заданном перенапряжении. Коррозия протекает при стационарном потенциале
при заданном перенапряжении. Коррозия протекает при стационарном потенциале  , который за редким исключением отличен от равновесного потенциала одной из частных электродных реакций. В этом случае исследуется зависимость скорости коррозии
, который за редким исключением отличен от равновесного потенциала одной из частных электродных реакций. В этом случае исследуется зависимость скорости коррозии  от Т при
от Т при  , на основании которой определяется кажущаяся энергия активации коррозии
, на основании которой определяется кажущаяся энергия активации коррозии  :
:
 (2)
(2)
 (3)
(3)
С ростом Т неоднозначно изменяется  , существенно могут меняться состояние поверхности электрода, концентрация деполяризатора (кислорода), растворимость анодных продуктов и т.д. В общем случае зависимость
, существенно могут меняться состояние поверхности электрода, концентрация деполяризатора (кислорода), растворимость анодных продуктов и т.д. В общем случае зависимость  от
от  может быть нелинейной, что указывает на зависимость
может быть нелинейной, что указывает на зависимость  от Т и, следовательно, на изменение механизма процесса с ростом температуры. В этих условиях вместо
от Т и, следовательно, на изменение механизма процесса с ростом температуры. В этих условиях вместо  обычно рассчитывают температурный коэффициент скорости процесса
обычно рассчитывают температурный коэффициент скорости процесса  и находят его зависимость от Т. При линейной зависимости
и находят его зависимость от Т. При линейной зависимости  от
от  выражение (3) упрощается:
выражение (3) упрощается:
 (4)
(4)
где  - угловой коэффициент прямой
- угловой коэффициент прямой  . Из уравнения (4) следует:
. Из уравнения (4) следует:
 (5)
(5)
Если  <10 кДж/моль, коррозионный процесс лимитируется диффузией. При
<10 кДж/моль, коррозионный процесс лимитируется диффузией. При  >40 кДж/моль процесс протекает с кинетическим контролем. Когда
>40 кДж/моль процесс протекает с кинетическим контролем. Когда  =10-40 кДж/моль имеет место смешанная кинетика.
=10-40 кДж/моль имеет место смешанная кинетика.
Адсорбционные ингибиторы блокируют часть поверхности  корродирующего металла и меняют
корродирующего металла и меняют  на величину
на величину  . Скорость коррозии в их присутствии
. Скорость коррозии в их присутствии  равна:
равна:
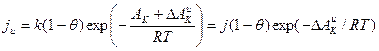 (6)
(6)
Соответственно выражение для коэффициента торможения коррозии 
 и имеет вид:
и имеет вид:
 (7)
(7)
Следовательно, в присутствии ингибиторов следует использовать формулы:
 (8)
(8)
 (9)
(9)
где  .
.
Если  или
или  , выражение (8) переходит в (3). Для таких ингибиторов не требуется учета температурной зависимости
, выражение (8) переходит в (3). Для таких ингибиторов не требуется учета температурной зависимости  . Соответствующие графические зависимости
. Соответствующие графические зависимости  представлены на рис.1 (прямые О отвечают чистым растворам, И - с добавкой ингибитора). Если
представлены на рис.1 (прямые О отвечают чистым растворам, И - с добавкой ингибитора). Если  , графики
, графики  должны иметь вид, представленный на рис.1а.
должны иметь вид, представленный на рис.1а.
 Рис.1.
Рис.1.
|  Рис.2
Рис.2
|
Ингибиторы такого типа действуют по активационному механизму (А-механизм), т.е. их эффект обусловлен только изменением  на величину
на величину  . Отрезок ординаты между этими прямыми равен
. Отрезок ординаты между этими прямыми равен  . Защитный эффект таких добавок снижается с ростом Т.
. Защитный эффект таких добавок снижается с ростом Т.
Если  и не зависит от Т, а ингибиторы не влияют на
и не зависит от Т, а ингибиторы не влияют на  (
(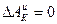 ), то их эффект обусловлен лишь экранированием (блокировкой) части
), то их эффект обусловлен лишь экранированием (блокировкой) части  поверхности, и графики имеют вид двух параллельных прямых и представлены на рис.1б. Такие ингибиторы называются блокировочными (
поверхности, и графики имеют вид двух параллельных прямых и представлены на рис.1б. Такие ингибиторы называются блокировочными ( -механизм). Разница ординат при Т=const равна
-механизм). Разница ординат при Т=const равна  . Зная К, можно рассчитать степень защиты
. Зная К, можно рассчитать степень защиты 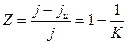 , причем в простейшем случае
, причем в простейшем случае 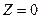 . Если частица ингибитора блокирует более одного коррозионно-активного центра,
. Если частица ингибитора блокирует более одного коррозионно-активного центра,  , в обратном случае
, в обратном случае  .
.
Для ингибитора смешанного типа ( - и А- механизмы действуют одновременно) графическая зависимость при
- и А- механизмы действуют одновременно) графическая зависимость при  представлена на рис.1а, хотя количественное разделение блокировочного и активационного эффектов весьма затруднительно. Однако на основании графиков
представлена на рис.1а, хотя количественное разделение блокировочного и активационного эффектов весьма затруднительно. Однако на основании графиков  при
при  можно вполне определенно судить о механизме действия ингибитора.
можно вполне определенно судить о механизме действия ингибитора.
Напротив, если неизвестен характер изменения  с температурой, информация о механизме ингибирования носит приближенный характер. Если
с температурой, информация о механизме ингибирования носит приближенный характер. Если  растет с Т, графики
растет с Т, графики  имеют вид, представленный на рисунке 2 и защитный эффект ингибитора увеличивается с Т. Кажущаяся энергия активации в присутствии ингибитора получается меньше
имеют вид, представленный на рисунке 2 и защитный эффект ингибитора увеличивается с Т. Кажущаяся энергия активации в присутствии ингибитора получается меньше  в чистом растворе (
в чистом растворе ( ), что противоречит кинетическим представлениям, поскольку ингибитор (
), что противоречит кинетическим представлениям, поскольку ингибитор ( ) не может снижать
) не может снижать  (
( ). Это противоречие устраняется при расчетах по формулам (8), (9).
). Это противоречие устраняется при расчетах по формулам (8), (9).
Другой причиной указанного явления может быть изменение характера п роцесса коррозии при добавлении в раствор ингибитора. Если адсорбированный ингибитор образует на поверхности металла достаточно плотную полимолекулярную пленку, создающую диффузионный барьер, процесс коррозии контролируется диффузией и величина  снижается до 8-12 кДж/моль.
снижается до 8-12 кДж/моль.
На основании одних температурно-кинетических измерений без знания величины  и учета
и учета  нельзя судить о механизме действия ингибиторов. Например, графики на рис.1а могут отвечать ингибиторам активационного типа, смешанного типа, а также блокировочным (если
нельзя судить о механизме действия ингибиторов. Например, графики на рис.1а могут отвечать ингибиторам активационного типа, смешанного типа, а также блокировочным (если  падает с ростом Т).
падает с ростом Т).
Графики рис.1б могут относиться к блокировочным ингибиторам или смешанного действия (если  растет с температурой). Графики рис.2 также могут относиться к ингибиторам либо блокировочным, либо смешанного действия.
растет с температурой). Графики рис.2 также могут относиться к ингибиторам либо блокировочным, либо смешанного действия.
Вышеприведенные соотношения (4)-(9) и анализ температурных зависимостей скоростей процесса и  справедливы и для частных электродных реакций: ионизации металла и водородной деполяризации. Однако при этом необходимо учитывать также зависимость
справедливы и для частных электродных реакций: ионизации металла и водородной деполяризации. Однако при этом необходимо учитывать также зависимость  и
и  от Е. Расчеты
от Е. Расчеты  производятся на основании графиков
производятся на основании графиков  или
или 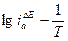 , где
, где 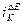 и
и  - значения токов в тафелевой области при постоянной поляризации электрода
- значения токов в тафелевой области при постоянной поляризации электрода  .
.
Экспериментальная часть
Цель работы: Исследование температурной зависимости скорости коррозии и частных электродных реакций и определение контролирующих стадий процесса. Исследование температурной зависимости защитного эффекта ингибиторов. Определение энергии активации процессов и влияние на нее ингибиторов.
Оборудование, сосуды, реактивы.
1. Термостат и термостатный сосуд с крышкой-2
2. Гальваностатическая установка или потенциостат с ячейкой –1
3. Весы аналитические - I
4. Стаканы или широкогорлые колбы на 150-200 мл - 2-3.
5. Пробирки – 40.
6. Стаканы на 50 мл - 2.
7. Термостатированные стаканы на 50 мл – 2.
8. Мерный цилиндр на 200 мл - I.
9. Образцы исследуемого металла для весовых измерений – 40, для поляризационных – 36.
10. Раствор серной или соляной кислоты (I моль/л) - 200-300 мл
11. Ингибитор.
Методика выполнения работы
Выполнение работы связано с исследованием процесса коррозии или его частных электродных реакций.
Методика весовых коррозионных измерений
1. Приготовить по 100 мл чистой кислоты и с добавками ингибиторов.
2. Каждый из растворов в количестве ~5 мл влить в 3 пробирки, установленные в водяной термостат.
3. В каждую пробирку погрузить по 1 образцу металла, предварительно взвешенного на аналитических весах с точностью до 0,0001 г.
4. После заданного времени образцы выгрузить, промыть водопроводной и дистиллированной водой, высушить фильтровальной бумагой и повторно взвесить.
5. Указанные операции (кроме I) повторить при каждой температуре.
Методика поляризационных измерений
1. Анодные и катодные поляризационные кривые снимаются одновременно в термостатированной ячейке с различными электродными пространствами на установке, схема которой представлена на рис.3.

Рисунок 3 – Схема установки
2. Ток, подаваемый на ячейку от источника тока (И), регулируется магазином сопротивления (R) и регистрируется миллиамперметром (мА). Потенциалы исследуемых электродов (ИЭ), один из которых является анодом, а другой катодом, измеряются относительно электрода сравнения (ЭС) и пересчитываются на нормальной водородный электрод (НВЭ). Измерение потенциала производится при помощи вольтметра (В).
3. Электроды погружаются в ячейку и подключаются к измерительной и поляризующей системам. Необходимо следить, чтобы капилляры Луггина (КЛ) электролитических ключей (ЭК) располагались в непосредственной близости от ИЭ. Часть ЭК, обращенная к ячейке заполняется исследуемым раствором, другая часть - насыщенным раствором 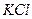 . Электроды выдерживаются в ячейке без поляризации 5 мин., а затем измеряется
. Электроды выдерживаются в ячейке без поляризации 5 мин., а затем измеряется  . Задаются ступенчато меняющиеся значения
. Задаются ступенчато меняющиеся значения  (по указанию преподавателя) и после выдержки при каждом
(по указанию преподавателя) и после выдержки при каждом  в течение 2 мин. производится измерение потенциалов катода (
в течение 2 мин. производится измерение потенциалов катода ( ) и анода (
) и анода ( ). Каждая кривая снимается на новых электродах после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке. Каждую кривую следует воспроизводить не менее 2-3 раз.
). Каждая кривая снимается на новых электродах после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке. Каждую кривую следует воспроизводить не менее 2-3 раз.
Измерения проводятся для каждой температуры при  в случае исследования
в случае исследования  или в заданном интервале Е при исследовании частных электродных реакций.
или в заданном интервале Е при исследовании частных электродных реакций.
Оформление результатов измерений
1. Форма заполнения рабочего журнала для весовых измерений:
металл__________ кислота и ее С, моль/л_____________
ингибитор________Синг, моль/л ________________
площадь образца_____см2, время испытаний _____час.
| №№ об- раз- цов | Масса образца (г) |  (г)
(г)
|

|  г/
г/  час час
| 
| К | Z | 
| |
Начальная 
| Конеч
ная 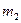
| ||||||||
Для поляризационных измерений:
Металл_____рабочий раствор_______ПАВ________Температура_____
Таблица
i, A/ 
| 1-ый опыт | 2-ой опыт | среднее | Значение Е но НВЭ | ||||
 ,В ,В
| 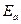 ,В ,В
|  ,В ,В
| 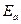 ,В ,В
|  ,В ,В
| 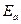 ,В ,В
|  ,В ,В
| 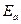 ,В ,В
| |
Пересчет потенциалов на шкалу НВЭ осуществляется по формуле
 (1)
(1)
 - потенциал НЭ по шкале НВЭ
- потенциал НЭ по шкале НВЭ
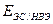 - потенциал ЭС по шкале НВЭ (Справочник химика, т.3)
- потенциал ЭС по шкале НВЭ (Справочник химика, т.3)
 - потенциал ИЭ относительно ЭС, т.е. показания вольтметра
- потенциал ИЭ относительно ЭС, т.е. показания вольтметра
с учетом знака всех Е.
2. Построить графики  ,
, 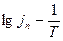 ,
,  ,
,  ,
, 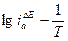 .
.
3. По формулам (4), (8), (9), принимая  рассчитать
рассчитать  ,
, 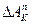 .
.
Примечание: Если снимаются при разных Т поляризационные кривые, построить эти кривые при всех Т и представить графики  и
и 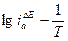 для нескольких потенциалов (в том числе при
для нескольких потенциалов (в том числе при  ). Для этих же Е рассчитать
). Для этих же Е рассчитать  .
.
4. С учетом цели работы и полученных результатов сделать выводы.
Контрольные вопросы
1. Температурная зависимость скорости коррозии.
2. Истинная, реальная и кажущаяся энергия активации.
3. Температурная зависимость эффекта ингибиторов.
4. Основные типы ингибиторного эффекта.
5. Методика эксперимента и принципы расчетов






