Лабораторный практикум по теории коррозии
учебно-методическое пособие
по курсу «Избранные главы прикладной электрохимии. Теория коррозии»
для студентов химического факультета
Ростов-на-Дону
 2016
2016
Учебно-методическое пособие разработано доктором химических наук, доцентом кафедры электрохимии Бережной А.Г. и профессором кафедры электрохимии Экиликом В.В.
Ответственный редактор докт. хим. наук А. Г. Бережная
Печатается в соответствии с решением кафедры электрохимии химического факультета ЮФУ, протокол № 125 от 26.02. 2016 г.
Содержание
| Работа №1. Химическая коррозия | |
| Работа № 2. Гомогенный и гетерогенный механизмы коррозии | |
| Работа № 3. Коррозия с водородной и кислородной деполяризацией | |
| Работа № 4.Определение характера замедленной стадии водородной деполяризации при кислотной коррозии металлов | |
| Работа № 5. Температурная зависимость скорости коррозии и частных электродных реакций | |
| Работа № 6. Определение механизма действия ингибиторов кислотной коррозии металлов | |
 |
Работа № 1. Химическая коррозия
Введение
Химическая коррозия - процесс взаимодействия металла с окружающей средой, протекающий по механизму химических гетерогенных реакций, когда переход металла в ионное состояние и восстановление окислителя происходят в одном акте при их непосредственном контакте.
Примерами химической коррозии являются взаимодействия металлов с неэлектролитами или сухими газами при повышенной температуре (газовая коррозия). Необходимым условием протекания процесса является термодинамическая неустойчивость М в среде, когда при окислении (1) ∆G< 0. Из уравнения изотермы химической реакции (2) следует условие возможности химической коррозии (3):
mM + 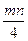 O2 = MmOmn/2 (1)
O2 = MmOmn/2 (1)
∆G = RTln 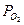 -mn/4 – RTln
-mn/4 – RTln 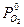 -mn/4 (2)
-mn/4 (2)
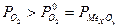 (3)
(3)
где n –валентность М, 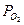 - парциальное давление О2 в газе,
- парциальное давление О2 в газе,
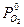 – его равновесное значение, т.е. давление диссоциации оксида.
– его равновесное значение, т.е. давление диссоциации оксида.
Для технических металлов в воздушной атмосфере 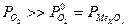 . Исключение составляют Au, а также Ag и Cu при повышенных t. Кинетика окисления, т.е. жаростойкость существенно зависит от свойств образующейся пленки оксида: сплошности, однородности и проницаемости. Чем выше защитные свойства пленки, тем меньше ее толщина. Условие сплошности основано на соотношении ∆ молярных объемов металла VM и оксида
. Исключение составляют Au, а также Ag и Cu при повышенных t. Кинетика окисления, т.е. жаростойкость существенно зависит от свойств образующейся пленки оксида: сплошности, однородности и проницаемости. Чем выше защитные свойства пленки, тем меньше ее толщина. Условие сплошности основано на соотношении ∆ молярных объемов металла VM и оксида 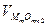 :
:
1< 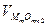 / VM < 2,5 (4)
/ VM < 2,5 (4)
При ∆<1 пленка несплошная, а если оно больше 2,5, возникающие внутренние напряжения разрушают пленку. Кинетика коррозии определяется м е х а н и з м о м, т.е. последовательностью стадий с указанием лимитирующей.
В общем случае имеют место следующие стадии: массоперенос окислителя в газовой фазе к поверхности М, его диссоциативная хемосорбция, химическая реакция образования оксида, массоперенос катионов Мn+ и О2- в фазе оксида, возгонка летучего оксида. Первая и последняя стадии обычно не лимитируют процесса. Кинетика описывается законами роста пленок во времени t.
Известно несколько законов роста оксидной пленки во времени, зависящих от ее защитных свойств.
1) Линейный закон наблюдается при кинетическом контроле, т.е. в условиях образования незащитных пленок, когда отношение мольных объемов оксида и металла (условие сплошности пленок) меньше единицы. Процесс контролируется химической реакцией образования пленки из металла и кислорода. В этом случае удельное увеличение массы образца 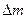 (г/м2) зависит от времени
(г/м2) зависит от времени 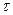 (ч) согласно уравнению:
(ч) согласно уравнению:
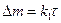 (5)
(5)
где 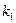 - константа (г/м2*ч).
- константа (г/м2*ч).
Линейный закон характерен для щелочных и щелочноземельных М (кроме Ве), где ∆<1, при образовании летучих оксидов (W, Mo) и при малых t для большинства М.
2) Параболический закон имеет место при диффузионном контроле, т.е. в условиях образования сплошных защитных пленок, когда отношения удельных объемов оксида и металла больше единицы. В этом случае с ростом толщины пленки, наблюдается самоторможение процесса коррозии:
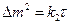 (6)
(6)
где 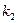 - константа (г2/м2*ч).
- константа (г2/м2*ч).
3) При смешанном диффузионно-кинетическом контроле рост пленки во времени может быть описан квадратичным уравнениям Эванса:
 (7)
(7)
или степенным законом:
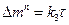 (8)
(8)
где 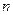 - показатель степени,
- показатель степени, 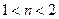 ,
, 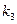 - константа (гn/м2nч).
- константа (гn/м2nч).
4) Логарифмический закон реализуется, если при окислении металлов торможение процесса диффузии происходит в большой степени, чем следует из первого закона Фика. Это случается, если перенос электронов протекает через тонкие пленки, наблюдается туннельный эффект или возникают дополнительные препятствия диффузии образующимися в пленке микропузырями:
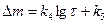 (9)
(9)
где 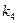 и
и 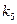 - константы.
- константы.
Закон роста пленок, особенно толстых, может меняться во времени, например в следующей последовательности: линейный, сложно-параболический, параболический, что сопровождается ростом защитных свойств пленки. В толстые пленки входят все устойчивые оксиды и в идеальном случае образуются многослойные пленки, где от внутренней границы к внешней убывает содержание М, например, Fe|FeO|Fe3O4|Fe2O3|O2.
В реальных процессах окисления металлов также реализуются более сложные зависимости роста пленок во времени из-за осложняющих факторов: нарушения сплошности пленки внутренними напряжениями, возникающими при росте пленки или изменении температуры.
По характеру окисления металлы классифицируются следующим образом. При ∆< 1 процесс самоускоряется и наступает возгорание. Для технически важных М (Fe, Ni, Cu, Mn, Ti) при снижении температуры увеличивается показатель степени в параболе и возможен переход к логарифмическому закону. При растрескивании пленки показатель степени падает. Неблагородные металлы как компоненты жаростойких сплавов и покрытий (Zn, Al, Cr)дают пленки с высокой защитной способностью, которые растут по логарифмическому закону. При образовании летучих оксидов на V, W, Mo, Ru, Os процесс определяется скоростью возгонки. Благородные металлы термодинамически устойчивы.
При газовой коррозии возможна высокотемпературная пассивация, когда рост скорости по мере увеличения 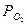 при некотором критическом
при некотором критическом 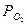 меняется на резкое падение за счет создания условий для формирования высокозащитной пленки. Критическое
меняется на резкое падение за счет создания условий для формирования высокозащитной пленки. Критическое 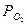 падает с ростом скорости газового потока.
падает с ростом скорости газового потока.
В слабоокислительных средах, где образование окалины затруднено, возможны науглероживание и обезуглероживание сталей с участием цементита:
Fe3C + CO2 ⇆ 3 Fe + 2 CO (10)
Fe3C + H2O ⇆ 3Fe + CO + H2 (11)
Fe3C + 2H2 ⇆ 3Fe + CH4 (12)
В основе обезуглероживания лежит процесс разложения цементита. Сталь теряет способность закаливаться и снижает прочность. При возрастании в газе содержания CO, H2 и CH4 обезуглероживание снижается и становится возможным науглероживание.
Особыми видами газовой коррозии являются также образование водородной хрупкости и ванадиевая коррозия. В водородной атмосфере кроме обезуглероживания снижение жаропрочности обусловлено абсорбцией водорода, образованием твердого раствора водорода в железе и появлением растрескивания по границам зерен из-за образования H2О и CH4. Несмотря на очистку стали от ванадия, он попадает в виде продуктов горения жидкого топлива. Оксиды ванадия катализируют окисление по реакциям (13), (14), а легкоплавкий V2O5 , особенно при наличии соединений щелочных металлов, флюсует соединения окалины.
4Fe + 3 V2O5 ® 2 Fe2O3 + 3 V2O3 (13)
V2O3 + O2 ® V2O5 (14)
Экспериментальная часть
Цель работы: Исследование кинетики окисления металла или сплава на воздухе при определенной температуре, установление закона роста оксидной пленки во времени и определение констант кинетического уравнения.
ОБОРУДОВАНИЕ, ПОСУДА, РЕАКТИВЫ
1. Печь муфельная или тигельная.
2. Весы аналитические.
3. Образцы исследуемых металлов или сплавов.
4. Щипцы для извлечения образцов из печи.
МЕТОДИКА ВЫПОЛНЕНИЯ РАБОТЫ
Информация о законе роста пленки во времени и контролирующем факторе процесса может быть получена на основании опытных данных об изменении массы образца во времени.
1. Включить печь для прогрева до заданной температуры.
2. Зачистить образец наждачной бумагой, измерить, обезжирить органическим растворителем и протереть фильтровальной бумагой.
3. Взвесить образец с точностью до четвертого знака после запятой и поместить в печь.
4. Через каждые15 минут выдержки в печи образец выгрузить, остудить на воздухе, взвесить и поместить в печь. Опыт повторять 6-8 раз.
ОФОРМГЕНИЕ РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1. Форма заполнения рабочего журнала.
Условия опыта: материал образца и его размеры ___х____х______(мм)
Площадь образца _____(м2), температура образца _______ (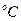 ),
),
время начала опыта_______.
Таблица 1
Чистое время от начала опыта 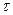 , ч , ч
| Масса образца, г | Изменение массы
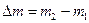 , г , г
| Среднее удельное увеличение массы
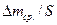 , г/м2 , г/м2
| |
до опыта 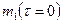
| после опыта
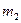
| |||
2. Пользуясь справочными данными (см. приложение) рассчитать объемное отношение для оксида металла и металла по формуле (14):
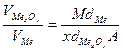 (14)
(14)
где 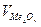 - объем 1 моля оксида (см3)
- объем 1 моля оксида (см3)
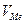 - объем металла на 1 моль оксида (см3)
- объем металла на 1 моль оксида (см3)
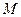 - молекулярная масса оксида (г)
- молекулярная масса оксида (г)
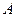 - атомная месса металла (г)
- атомная месса металла (г)
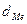 - плотность металла (г/см3) (см. приложение)
- плотность металла (г/см3) (см. приложение)
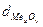 - плотность оксида (г/см3) (см. приложение)
- плотность оксида (г/см3) (см. приложение)
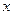 - число атомов металла в молекуле оксида.
- число атомов металла в молекуле оксида.
3. Построить график 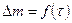 .
.
4. Графическим или численным дифференцированием найти скорость окисления для каждого опыта 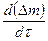 и сопоставить со средней скоростью процесса
и сопоставить со средней скоростью процесса 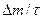 .
.
5. Спрямить график 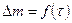 при помощи одной из функциональных сеток (табл. 2). Вычислить константы полученного уравнения (расчеты и спрямление графиков провести на компьютере).
при помощи одной из функциональных сеток (табл. 2). Вычислить константы полученного уравнения (расчеты и спрямление графиков провести на компьютере).
Таблица 2
Типы функциональных сеток для прямолинейного преобразования
| Уравнение | Функциональная сетка | Примечание | |
| y | X | ||
| (5) | 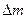
| 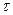
| |
| (6) | 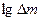
| 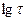
| угловой коэффициент равен 0,5 |
| (7) | 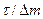
| 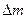
| |
| (8) | 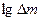
| 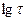
| угловой коэффициент равен 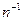
|
| (9) | 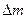
| 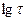
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Химическая коррозия, определение, специфика.
2. Условия возможности протекания химической коррозии.
3. Методы зашиты.
4. Контролирующие факторы химической коррозии.
5. Законы роста пленки во времени.
6. Методика эксперимента и принципы расчетов.
ДОПОЛНИТЕЛЬНЫЕ МЕРЫ БЕЗОПАСНОСТИ
Запрещается брать образец в руки после его нахождения в печи. Для работы с ним использовать щипцы. Запрещается размещение образца вне специальной подставки.
Приложение
Плотности элементов и их окислов
| Me, MexOy | 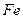
| 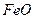
| 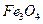
| 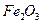
| 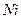
| 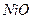
| 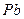
| 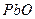
| 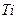
| 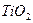
| 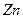
| 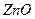
|
| d, г/см3 | 7,86 | 5,7 | 5,1 | 5,24 | 8,9 | 7,45 | 11,34 | 9,53 | 4,54 | 4,26 | 7,14 | 5,6 |
Работа № 2. Гомогенный и гетерогенный механизмы коррозии
Введение
Электрохимическая коррозия отличается от химической тем, что суммарная реакция (1) протекает з виде территориально разделенных реакций окисления (2) и восстановления (3):
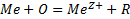 (1)
(1)
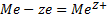 (2)
(2)
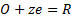 (3)
(3)
где Me - металл, 0 - окислитель, R - восстановитель.
Коррозия, протекающая по электрохимическому механизму, подчиняется закономерностям, определяющим кинетику и механизм электродных реакций. В отличие от простых электрохимических систем (2), (3), которые характеризуются равновесным потенциалом, описываемым уравнением Нернста, и плотностью тока обмена 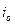 при Ер
при Ер 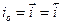 в случае коррозии мы имеем дело с полиэлектродом, на котором протекает одновременно две и более электродные реакции. В результате протекания этих реакций металл приобретает потенциал коррозии.
в случае коррозии мы имеем дело с полиэлектродом, на котором протекает одновременно две и более электродные реакции. В результате протекания этих реакций металл приобретает потенциал коррозии.
Условие его стационарности имеет вид: 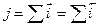 . При стационарном потенциале коррозии Ес две электродные реакции протекают сопряженно. В общем случае сопряженные реакции процесса коррозии могут характеризоваться наличием или отсутствием взаимного влияния. Согласно принципу независимости электродных процессов, закономерности их совместного протекания при отсутствии осложняющих обстоятельств, остаются такими же, как и в случае каждой реакции в отдельности. Следствия из принципа независимости относятся к различным случаям установления электродного потенциала. При заданном потенциалом электрода скорость каждой электрохимической реакции однозначно определена, взаимное влияние отсутствует (следствие 1). Для бестокового электрода возмогло взаимное влияние протекающих реакций, но только через изменение электродного потенциала (стационарного потенциала коррозии), кинетические уравнения реакций при этом не меняются (следствие 2). Применимость принципа независимости электродных процессов и следствий из него иллюстрируется графиком на рис. 1, где прямая линия отвечает зависимости скорости ионизации
. При стационарном потенциале коррозии Ес две электродные реакции протекают сопряженно. В общем случае сопряженные реакции процесса коррозии могут характеризоваться наличием или отсутствием взаимного влияния. Согласно принципу независимости электродных процессов, закономерности их совместного протекания при отсутствии осложняющих обстоятельств, остаются такими же, как и в случае каждой реакции в отдельности. Следствия из принципа независимости относятся к различным случаям установления электродного потенциала. При заданном потенциалом электрода скорость каждой электрохимической реакции однозначно определена, взаимное влияние отсутствует (следствие 1). Для бестокового электрода возмогло взаимное влияние протекающих реакций, но только через изменение электродного потенциала (стационарного потенциала коррозии), кинетические уравнения реакций при этом не меняются (следствие 2). Применимость принципа независимости электродных процессов и следствий из него иллюстрируется графиком на рис. 1, где прямая линия отвечает зависимости скорости ионизации 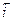 металла от потенциала, а точки соответствуют значениям j при каждом Еc.
металла от потенциала, а точки соответствуют значениям j при каждом Еc.
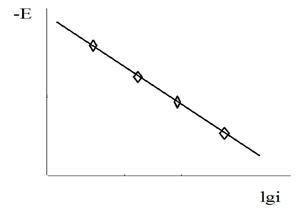 Рисунок 1
Рисунок 1
| относятся изменение состава и свойств оксидной пленки, образование нерастворимых соединений на поверхности металла, адсорбция поверхностно-активных веществ, изменение концентрации ионов и приэлектродном слое, в том числе рH и др. |
Изменение Еc возможно введением окислителей. Отклонения от принципа независимости электродных процессов, обусловленные наличием осложняющих обстоятельств, связаны преимущественно с изменением состояния поверхности электрода или приэлектродного слоя раствора под действием параллельно протекающих реакций.
Если поверхность металла однородна, электродные реакции могут протекать по всей поверхности. Если она неоднородна, реакция локализованы, причем степень локализации может сохраняться во времени. Наличие химических и структурных неоднородностей играет существенную роль в кинетике коррозии, но не являются обязательным условием ее протекания. Согласно термодинамической оценке, электрохимическая коррозия возможна, когда нернстовский потенциал металла для процесса (2) отрицательнее равновесного потенциала какой-либо окислительно-восстановительной системы (3) в данном растворе. Поскольку в момент контакта металла с агрессивной средой в растворе отсутствуют ионы MeZ+, следовательно, Ер системы MeZ+/Me в соответствии с формулой Нернста равен - ¥ и все металлы независимо от их природы и природы реакций (3) могут коррозировать. В реальных условиях вблизи поверхности электрода практически мгновенно накапливается MeZ+, что позволяет делить металлы на термодинамически устойчивые в присутствии данного окислителя и неустойчивые. Термодинамическая оценка возможности коррозии не нуждается в необходимости наличия на поверхности металла микрогальванических элементов, обусловленных ее химической или физической неоднородностью.
Напротив, согласно теории локальных гальванических элементов (ТЛГЭ) наличие примесей более благородного металла (катодов) приводит к возникновению разности потенциалов на поверхности, которая заставляет основной металл (анод) растворяться. Скорость коррозии должна быть тем выше, чем больше разность потенциалов в коррозионном гальваническом элементе. Логическим следствием ТЛГЭ является невозможность коррозии чистого однородного металла с эквипотенциальной поверхностью. Для подтверждения этой теории приводятся опыты де ля Рива по увеличению jZn при наличии в нем примесей и Голубева-Акимова по экспериментальному обнаружению неэквипотенциальности поверхности корродирующего металла. В противоречии с теорией микрогальванических элементов находятся экспериментальные данные по снижению jZn добавкой Рb, по возможности растворения амальгам металлов, имеющих вполне однородную поверхность, и благородных металлов, к которым нельзя подобрать более благородные примеси. Из коррозионной диаграммы (рис.2) также следует, что между разностью потенциалов DЕ катодных и анодных участков поверхности и величиной j существует обратная связь.
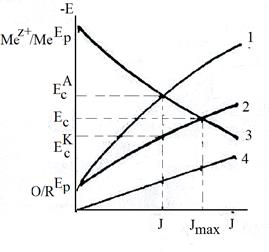 Рисунок 2 – Коррозионная диаграмма.
Рисунок 2 – Коррозионная диаграмма.
| 1- катодная поляризационная кривая с поправкой на омический фактор 2- катодная поляризационная кривая 3- анодная поляризационная кривая 4- прямая закона Ома |
Действительно, если агрессивная среда достаточно электропроводна, что тем более относится к металлу, то омическим фактором можно пренебречь и точка пересечения кривых 2 и 3 дает значения максимального тока коррозии jmax и стационарного потенциала коррозии Ec, одинакового для всей поверхности корродирующего металла. При наличии омического фактора, выражаемого зависимостью омического падения напряжения DЕ от I (прямая 4), кривую 2 (или 3) необходимо перестроить с его учетом. Кривая 1 получена при геометрическом сложении кривой 2 и прямой 4, т.е. к значениям поляризации необходимо прибавлять омическое падение напряжения. Из рисунка 2 следует, что это приводит к понижению тока коррозии (J<Jmax) и появлению неэквипотенциальности поверхности, т.к. значению j отвечают разные потенциалы на кривых 2и 3. Потенциал коррозии анодных участков Е,более отрицателен, чем катодных Е. Таким образом, разность потенциалов является не движущей силой коррозионного гальванического элемента, не причиной электрохимической коррозии, а лишь следствием омического падения напряжения.
Следовательно, при правильной трактовке работы гальванического элемента, которая базируется на тех же фундаментальных положениях электрохимической кинетики, что и теория электрохимической коррозии, возможно использование ТЛГЭ применительно к некоторым коррозионным процессам. Особенно часто такие представления применяются при трактовке гальванической коррозии, когда в электрическом контакте находятся разнородные металлы. Отсюда также следует, что концепция локальных элементов не является единственно возможной, а предпочтительна электрохимическая трактовка на базе электрохимической термодинамики и формальной кинетики электродных процессов. Не следует также смешивать понятия ТЛГЭ и гетерогенно-электрохимический механизм коррозии.
Предложено два механизма электрохимической коррозии: гомогенный и гетерогенный. При гомогенно-электрохимическом механизме коррозии катодная и анодная реакция независимы и не связаны с определёнными участками поверхности, которая вполне однородна структурно и химически. На одном и том же участке поверхности металла возможно передающееся во времени протекание анодной и катодной реакций.
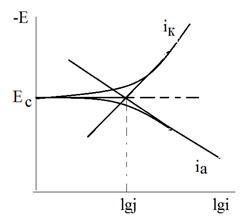 Рисунок 3.
Рисунок 3.
| 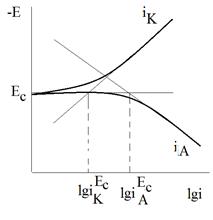 Рисунок 4
Рисунок 4
|
Критерием такого механизма является пересечение тафелевых участков поляризационных кривых катодного и анодного процессов в точке, лежащей на линии Ес (рис.3). Этому условию отвечает равенство (при Ес):
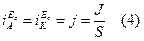
Равенство значений j, найденных по рис.3 и определенных каким-либо независимым методом (весовым, объемным), служит доказательством электрохимического механизма коррозии. Гомогенный механизм характерен для достаточно чистых металлов и их амальгам.
При гетерогенно-электрохимическом механизме коррозии анодная и катодная реакции также могут быть независимы, но они достаточно локализованы в пространстве, т.е. связаны с определенными участками поверхности, причем степень локализации сохраняется во времени. Анодная реакция обычно локализуется на включениях более электроотрицательного металла, на участках поверхности, свободных от пленки оксида или от адсорбированного ингибитора и т.п. Катодная реакция протекает преимущественно на участках с низким перенапряжением этого процесса. Дифференциация катодных и анодных процессов (участков) характерна для технических металлов. В общем случае площади катодных и анодных участков неодинаковы, т.е. Sk¹Sa Однако, согласно условию стационарности при Еc:
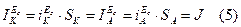
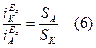
Показателем гетерогенного механизма является пересечение тафелевых участков анодной и катодной кривой линии Ес в разных точках (рис.4).
Электрохимическая гетерогенность поверхности означает различие характера процессов и их скоростей на различных по природе участках. Эти участки могут иметь различные потенциалы при наличии омического фактора, или вся поверхность будет эквипотенциальна при его отсутствии.
Причинами возникновения электрохимической гетерогенности могут быть неоднородность металла, в том число его поверхности, жидкой фазы, различие физических условий.
Экспериментальная часть
Задание 1. Определение механизма коррозии.
Цель работы: Анализ поляризационных кривых. Доказательство электрохимического механизма коррозии. Определение механизма электрохимической коррозии.
Оборудование, посуда, реактивы
1. Установка для поляризационных измерений с ячейкой – 1.
2. Весы аналитические - 1
3. термостатный сосуд с крышкой - 1
4. Секундомер или часы - 1
5. Склянка на 1 л - 1
6. Мерный цилиндр на 250 мл – 1
7. Пробирки - 6
8. Образцы исследуемых металлов для весовых измерений - 2x3
для поляризационных -"- - 2x4
9. Раствор соляной или серной кислот (0,5-1,0 моль/л) - 150-200 мл.
Методика эксперимента
Коррозионные и поляризационные измерения проводятся и растворе кислота. Металлы, кислота, ее концентрация, время коррозии, режим снятия поляризационных кривых - по указанию преподавателя.
Методика коррозионных измерений
Коррозионные измерения проводятся весовым методом.
1. В каждую из 6-ти пробирок налить примерно 5 мл раствора кислоты и поместить их в водяной термостат.
2. Образцы двух металлов (каждого по 3 образца), предварительно взвесив на аналитических весах с точностью до 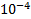 г, поместить в пробирки с раствором кислоты (1 образец в пробирку). Образцы можно брать только пинцетом!
г, поместить в пробирки с раствором кислоты (1 образец в пробирку). Образцы можно брать только пинцетом!
3. После заданного промежутка времени образца выгрузить, отмыть водопроводной и дистиллированной водой, высушить фильтровальной бумагой и повторно взвесить на тех жe весах.
Методика поляризационных измерений
Анодные и катодные поляризационные кривые снимаются одновременно в термостатированной ячейке с разделенными электродными пространствами на установке, схема которой представлена на рис.5. Ток, подаваемый на ячейку от источника тока (И), регулируется магазином сопротивлений (R) и регистрируется миллиамперметром (мА). Потенциалы исследуемых электродов (ИЭ), один из которых является анодом, а другой катодом, измеряются относительно электродов сравнения (ЭС) и пересчитываются на нормальный водородный электрод (НВЭ). Измерение потенциала производится при помощи потенциометра или вольтметра (В).
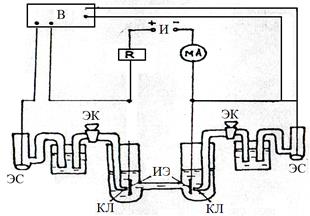
Электроды погружаются в ячейку и подключаются к измерительной и поляризующей системам. Необходимо следить, чтобы капилляры Луггина (КЛ) электролитических ключей (ЭК) располагались в непосредственной близости от ИЭ. Часть ЭК, обращенная к ячейке, заполняется исследуемым раствором, другая часть - насыщенным раствором КСL. Электроды выдерживаются в ячейке без поляризации 5 мин., затем измеряются Ес. Задаются i (по указанию преподавателя) и после выдержки при каждом i в течение 2 мин. производится измерение потенциалов катода (Е,) и анода(Е). Каждая кривая снимается на новых электродах после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке, Каждую кривую следует воспроизводить не менее 2-3 раз. Электроды обезжириваются при кипячении в спирте, промываются в свежей порции спирта и высушиваются фильтровальной бумагой
Оформление и обработка результатов измерений
1. В отчете должны найти отражение: природа металла, рабочий раствор, ПАВ, и температура. Результаты поляризационных измерений занести в таблицу:
| i,А/см2 | 1 опыт | 2 опыт | Среднее значение | Значение Е по НВЭ | ||||
| Ек,В | ЕА,В | Ек,В | ЕА,В | Ек,В | ЕА,В | Ек,В | ЕА,В | |
Пересчет потенциалов на шкалу НВЭ осуществляется по формуле:
Еиэ/нвэ = Еэс/нвэ - Еиэ/эс Еиэ/нвэ - потенциал ИЭ по шкале НВЭ
Еэс/нвэ - потеницал ЭС по шкале НВЭ, (Справочник химика, т.3).
Еиэ/эс - потенциал ИЭ относительно ЭС, т.е. показания вольтметра с учетом знака.
Данные весовых измерений представить в виде таблицы:
| Металл | №№ | Масса, г | ∆m, г | ∆mср, г | j,А/см2 | |
| до | после | |||||
2. Построить поляризационные кривые в координатах Е –lg i.
3. Проэкстраполироватъ тафелевские участки на линию Ес, сопоставить полученные графики с представленными на рис.3,4.
4. Рассчитать Jk по формуле:
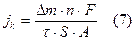
F - Число Фарадея (26,8 А-час), А - атомная масса металла.
5. Сопоставить значения скорости коррозии, найденной из электрохимических измерений по рис.3,4 (Jэ) и рассчитанной по формуле (7) по данным прямых коррозионных испытаний (jk). Значения Jэ для случая, представленного на рис.3, непосредственно сопоставляются с величинами Jк. Если экспериментальный график отвечает представленному на рис.4, необходимо ввести поправку на гетерогенность поверхности. Предполагаем, что характер гетерогенности одинаков для коррозионных и поляризационных измерений и вся поверхность образцов электрохимически активна. Тогда, зная 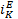 и
и 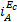 можно по формуле (6) определить отношение SA/SK и на основании общей площади образца для поляризационных измерений рассчитать
можно по формуле (6) определить отношение SA/SK и на основании общей площади образца для поляризационных измерений рассчитать 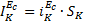
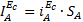 . Величины
. Величины 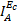 и
и 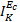 должны совпадать. Поскольку значения Jк (см. таблицу), рассчитанные весовым способом, фактически отражают скорость анодной реакции распространения металла при Ес, то следует проводить сопоставление величин Jк и
должны совпадать. Поскольку значения Jк (см. таблицу), рассчитанные весовым способом, фактически отражают скорость анодной реакции распространения металла при Ес, то следует проводить сопоставление величин Jк и 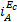 (рис.4).
(рис.4).
6. Примерное равенство величин Jк и 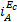 или Jк и Jэ указывает на доминирование электрохимического механизма коррозии. Если Jк > Jэ или
или Jк и Jэ указывает на доминирование электрохимического механизма коррозии. Если Jк > Jэ или
Jк> 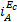 , то реализуется химико-электрохимический механизм, рис.5.
, то реализуется химико-электрохимический механизм, рис.5.
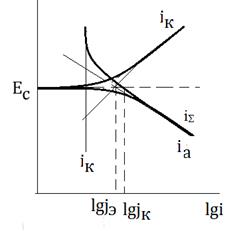 Рисунок 5- Коррозионная диаграмма
Рисунок 5- Коррозионная диаграмма
| iS - суммарная скорость растворения металла i=ix+iA ix - скорость растворения металла по химическому механизму iк –скорость катодной реакции iA - Скорость анодного растворения металла При Ес lg jК=lg (jэ+jx) |
Рассчитать долю химического механизма коррозии по формулам:
А) для рис. типа 3: 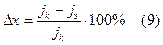
Б) для рис. типа 4: 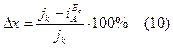
Примечание: Если Jк < Jэ это может указывать на различное соотношение SA/SK при коррозионных и поляризационных измерениях. При гомогенном механизме вся поверхность металла равнодоступна для катодной и анодной реакций. Следовательно, при катодной поляризации на всей поверхности будет протекать восстановление деполяризатора, при анодной поляризации воя поверхность будет растворяться, а при коррозии в каждый момент времени на половине поверхности может протекать анодная реакция и на другой половине - катодная. Для учета такой возможности при использовании формулы (7) вместо S следует подставлять S/2.
7. Сделать выводы.
Задание 2. Моделирование коррозионного полиэлектрода
Цель работы:. Ознакомление с работой коррозионного полиэлектрода при пространственном разделении катодной и анодной реакций. Анализ поляризационных кривых при работе электрохимической системы в режиме гальванического элемента и электролитической ванны.
Оборудование, посуде, реактивы
1. Установка для поляризационных измерений и ячейка - 1.
2. Секундомер или часы - 1.
3. Склянка на 1 л - 1.
4. Мерный цилиндр на 100 мл - 1.
5. Стакан на 100 мл -2
6. Образцы исследуемого металла
7. Платиновый электрод - 1.
8. Раствор соляной или серной кислот (1 моль/л) – 150-200 мл.
Методика эксперимента
1. Собрать установку (рис.7.)
2. Установить Pt -электрод и насыщать в течение 15 мин, раствор водородом.
3. Установить электрод из исследуемого металла.
4. Измерить Е исследуемого и платиноводородного электродов.
5. Замкнуть цепь, поставив переключатель 9 в положение "а". Магазин сопротивления 8 полностью введен. Через 2 мин. зарегистрировать ток и измерить потенциалы обоих электродов.
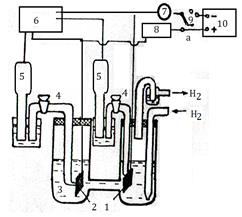 Рисунок 6 – Схема установки
Рисунок 6 – Схема установки
| 1. Платиновый электрод. 2. Рабочий электрод 3. Исследуемый раствор. 4. Электролитический ключ 5. Электрод сравнения. 6. Регистратор потенциала. 7. Регистратор тока. 8. Регулируемый резистор. 9. Переключатель. 10. Источник питания. |
6. Меняя сопротивление внешней цени при помощи магазина 8, после каждых 2-х мин. выдержки измерять ток и потенциалы.
7. Разомкнуть электрическую цепь переключателем 9, ввести магазин 8 и, переведя переключатель в положение "6", включить источник тока. Увеличивая ток при помощи регулятора источника тока и магазина 8, после каждой 2-х минутной выдержки регистрировать значения потенциалов и тока.
8. Изменить электрическое сопротивление внутренней цепи путем замены рабочего раствора и повторять операции 2-6.
Примечание: Исследуемые металл и растворы, значения сопротивления внешней цепи (п.6) и устанавливаемого тока (п.7) – по указанию преподавателя.
Оформление и обработка результатов измерений
1. При оформлении отчета указать условия эксперимента (металл, электролит, температуру, площадь образцов), а данные измерений представить в виде таблицы:
| Rвн, Ом | I,A | i, A/см2 | Потенциал электрода Е по отношению к электроду сравнения | E по НВЭ, B | |||||||
| Me | Pt | Me | Pt | ЕМе | ЕPt | ||||||
| E1 | E2 | Ecp | E1 | E2 | Ecp | ||||||
2. Построить поляризационные кривые в координатах Е-i и E-lgi, определить тафелевы константы.
3. Сопоставить кинетические закономерности для разных растворов и различных режимов работы электрохимической системы: гальванического элемента (область с отключенным источником питания) и электролизера (область с включенным источником питания).
4. Сделать выводы.
Контрольные вопросы
1. Сущность электрохимического механизма коррозии.
2. Принцип независимости ЭП, следствия и отклонения.
3. Термодинамическая оценка возможности коррозии.
4. Теория локальных гальванических элементов.
5. Электрохимическая гетерогенность поверхности, ее причины.
6. Механизмы коррозии.
7. Методики эксперимента и принципы расчетов.
Дополнительные меры безопасности
Запрещается поправлять электроды и электролитические ключи при включенном источнике питания. После снятия каждой кривой следует отключить источник питания, установить в исходное положение регулятор напряжения, переключатели регистраторов и магазина сопротивления.






