Введение
Коррозия металлов в растворах неокислительных кислот (соляная, серная) протекает в основном с водородной деполяризацией и катодным контролем. Поэтому ее скорость j тесно связана с перенапряжением выделения водорода, а характер зависимости j от pH раствора определяется природой замедленной стадии, обусловливающей появление перенапряжения  Н. Обычно, выделение водорода лимитируется замедленностью одной из двух стадий разряда 1 или рекомбинации 2:
Н. Обычно, выделение водорода лимитируется замедленностью одной из двух стадий разряда 1 или рекомбинации 2:
Н3О + е  Надс
Надс 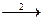 Н2 (1)
Н2 (1)
Суждение о степени заторможенности указанных стадий может быть получено на основании анализа зависимости j от pH по методу Антропова, сущность которого заключается в следующем.
На неоднородной поверхности металла в условиях протекания коррозии по гетерогенному механизму (Sa  Sk) соотношения между кинетическими параметрами процесса имеют вид:
Sk) соотношения между кинетическими параметрами процесса имеют вид:
lg  = lg
= lg 
 (2)
(2)
 =
=  (3)
(3)
j=  =
= 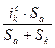 =
=  (4)
(4)
Предполагая, что зависимость между поляризацией и плотностью тока описывается тафелевой прямой:
 (5)
(5)
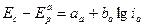 (6)
(6)
и решая совместно систему уравнений (2) – (6), можно получить выражение:
 (7)
(7)
где  и
и  - равновесные потенциалы, отвечающие катодной и анодной реакциям, ak и aa - величины катодной и анодной поляризации при плотности тока I A/см2,
- равновесные потенциалы, отвечающие катодной и анодной реакциям, ak и aa - величины катодной и анодной поляризации при плотности тока I A/см2, 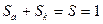 cм2 ,
cм2 , 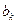 и
и  - удельные поляризуемости. Для выражения j в виде функции концентрации водородных ионов, необходимо знать, как меняются величины в уравнении (7) с pH. Для узкого интервала pH допускается, что S k и Sa не зависят от pH. Принимается также, что скорость анодного растворения, aa и ba не зависят от pH*. Следовательно, влияние pH на скорость коррозионного процесса осуществляется через величины
- удельные поляризуемости. Для выражения j в виде функции концентрации водородных ионов, необходимо знать, как меняются величины в уравнении (7) с pH. Для узкого интервала pH допускается, что S k и Sa не зависят от pH. Принимается также, что скорость анодного растворения, aa и ba не зависят от pH*. Следовательно, влияние pH на скорость коррозионного процесса осуществляется через величины  и
и  . Зависимость
. Зависимость  от pH не связана с природой замедленной стадии:
от pH не связана с природой замедленной стадии:
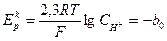 pН (8)
pН (8)
Особенности катодного выделения водорода на данном металле проявляются лишь в характере изменения с pH величины ak.
По рекомбинационной теории  Н не является функцией pH,
Н не является функцией pH, 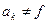 (pH)** и уравнение (7) принимает вид:
(pH)** и уравнение (7) принимает вид:
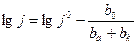 pH
pH 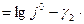 pН (9)
pН (9)
В lg j0 объединены все величины, не зависящие от pН; lg j0 отвечает значению lg j при pН=0.
По теории замедленного разряда  Н изменяется с pH при любых концентрациях кислоты по уравнению:
Н изменяется с pH при любых концентрациях кислоты по уравнению:
 pH (10)
pH (10)
где 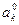 - перенапряжение при
- перенапряжение при  I А /см2 и pH=0.
I А /см2 и pH=0.
Примечание: *Эти допущения обычно не отвечают реальным условиям, информация о характере замедленной стадии процесса, полученная этим методом, носит качественный характер и рассматривается в виде некоторого приближения. **В действительности  Н может незначительно меняться с pH за счет дипольного характера связи “металл-водород”.
Н может незначительно меняться с pH за счет дипольного характера связи “металл-водород”.
В этом случае уравнение (7) принимает вид:

Индексы 1 и 2 при  в уравнениях (9), (11) отвечают типу замедленной стадии по схеме (1). Уравнения (9), (11) могут быть использованы при приближенных расчетах j по данным поляризационных измерений, если известна природа замедленной стадии или для предварительного суждения о природе перенапряжения в рассматриваемых условиях на основании коррозионных и поляризационных измерений.
в уравнениях (9), (11) отвечают типу замедленной стадии по схеме (1). Уравнения (9), (11) могут быть использованы при приближенных расчетах j по данным поляризационных измерений, если известна природа замедленной стадии или для предварительного суждения о природе перенапряжения в рассматриваемых условиях на основании коррозионных и поляризационных измерений.
Кроме вышеупомянутых ограничений метод Антропова может быть использован лишь при исследовании процессов, протекающих в основном за счет водородной деполяризации, не приводящих к образованию труднорастворимых продуктов. Желательно проводить исследования при постоянной концентрации аниона кислоты (за счет введения соответствующей соли).
Характер замедленной стадии водородной деполяризация в значительной степени определяется природой корродирующего металла. В первом приближении можно считать, что на непереходных металлах с высоким  Н (Hg, Cd, Pb) более замедлена стадия разряда, а на переходных с низким
Н (Hg, Cd, Pb) более замедлена стадия разряда, а на переходных с низким  Н (Pt, Pd)- рекомбинация. Для группы металлов со средним
Н (Pt, Pd)- рекомбинация. Для группы металлов со средним  Н (Fe, Ni) замедленность стадий разряда и рекомбинации соизмерима и в зависимости от условий процесса одна из них лимитирует скорость процесса.
Н (Fe, Ni) замедленность стадий разряда и рекомбинации соизмерима и в зависимости от условий процесса одна из них лимитирует скорость процесса.
Органические поверхностно-активные вещества (ПАВ) не только влияют на кинетику коррозии, но могут менять характер замедленной стадии. Молекулярные ПАВ (антраниловая кислота), связанные с поверхностью металла преимущественно химическими силами, влияют на  Н через изменение теплоты адсорбции Н-атомов и условий их взаимодействия. Такие добавки должны в первую очередь тормозить стадию рекомбинации. Напротив, катионные ПАВ (соли тетраалкиламмония), а также добавки со значительным дипольным моментом молекул, создавая электрический барьер для ионов водорода, тормозят стадию разряда. Анионные ПАВ (тиомочевина) могут облегчать стадию разряда, влияя на двойной электрический слой, и тормозить рекомбинацию Н-атомов за счет хемосорбции. В зависимости от соотношения указанных эффектов анионные ПАВ могут повышать или снижать
Н через изменение теплоты адсорбции Н-атомов и условий их взаимодействия. Такие добавки должны в первую очередь тормозить стадию рекомбинации. Напротив, катионные ПАВ (соли тетраалкиламмония), а также добавки со значительным дипольным моментом молекул, создавая электрический барьер для ионов водорода, тормозят стадию разряда. Анионные ПАВ (тиомочевина) могут облегчать стадию разряда, влияя на двойной электрический слой, и тормозить рекомбинацию Н-атомов за счет хемосорбции. В зависимости от соотношения указанных эффектов анионные ПАВ могут повышать или снижать  Н.
Н.
Экспериментальная часть
Цель работы: Определение характера замедленной стадии водородной деполяризации при кислотной коррозии металла без и в присутствии ПАВ.
Исследование влияния pH на скорость коррозии и защитное действие ингибиторов.
Оборудование, посуда, реактивы.
1. Установка для снятия поляризационных кривых с ячейкой – 1
2. Весы аналитические – 1.
3. Термостатный сосуд с крышкой – 1.
4. Склянка на 1 л – 1.
5. Стаканы или колбы на 100 мл – 6.
6. Пробирки – 25-30.
7. Мерный цилиндр на 200 мл – 1.
8. Образцы исследуемого металла для весовых измерений – 25-30.
для поляризационных измерений – 10.
9. Раствор серной или соляной кислоты (0,5 моль-экв/л)- 100-150 мл.
10. Ингибитор.
11. Секундомер или часы.
Методика выполнения работы
При выполнении работы необходимо провести коррозионные испытания и поляризационные измерения. Коррозионные испытания проводятся весовым методом.
1. Приготовить по 50 мл растворов кислоты 4-х концентраций
2. 25 мл оставить на контрольный опыт, в других 25 мл растворить ингибиторы.
3. Каждый из растворов (25 мл) разлить поровну в 3 пробирки, которые установить в водяной термостат.
4. Образцы металла предварительно взвесить на аналитических весах с точностью до 0,0001 г, погрузить в пробирки с кислотой (1 образец в пробирку, на каждый опыт- 3 образца).
5. После заданного времени образцы выгрузить, отмыть водопроводной и дистиллированной водой, высушить фильтровальной бумагой и повторно взвесить.
Методика поляризационных измерений
 Анодные и катодные поляризационные кривые снимаются одновременно в термостатированной ячейке с разделенными электродными пространствами на установке, схема которой представлена на рис.1. Ток, подаваемый на ячейку от выпрямителя (В), регулируется магазином сопротивлений (R) и регистрируется миллиамперметром (мА). Потенциалы исследуемых электродов - катода и анода (ИЭ) измеряются относительно электродов сравнения (ЭС) и пересчитываются на нормальный водородный электрод (НВЭ). Измерение потенциала производится при помощи потенциометра (П) или вольтметра.
Анодные и катодные поляризационные кривые снимаются одновременно в термостатированной ячейке с разделенными электродными пространствами на установке, схема которой представлена на рис.1. Ток, подаваемый на ячейку от выпрямителя (В), регулируется магазином сопротивлений (R) и регистрируется миллиамперметром (мА). Потенциалы исследуемых электродов - катода и анода (ИЭ) измеряются относительно электродов сравнения (ЭС) и пересчитываются на нормальный водородный электрод (НВЭ). Измерение потенциала производится при помощи потенциометра (П) или вольтметра.
| Электроды погружаются в ячейку и подключаются к измерительной и поляризующей системам. |
Необходимо следить, чтобы капилляры Луггина (КЛ) электролитических ключей (ЭК) располагались в непосредственной близости от ИЭ. Часть ЭК, обращенная к ячейке, заполняется исследуемым раствором, другая часть - насыщенным раствором КСl.Электроды выдерживаются в ячейке без поляризации 5 мин., затем измеряется Ес. Задаются ступенчато меняющиеся значения i (по указанию преподавателя) и после выдержки при каждом i в течение 2 мин, производится измерение потенциалов катода (Ек ) и анода (Еа). Каждая кривая снимается на новых электродах после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке. Каждую кривую следует воспроизводить не менее 2-3 раз. Электроды обезжириваются при кипячении в спирте, промываются в свежей порции спирта и высушиваются фильтровальной бумагой.
Поляризационные кривые снимаются в кислоте одной концентрации (по указанию преподавателя) чистой и с ингибитором.
Оформление результатов измерений
Форма заполнения рабочего журнала.
Для поляризационных измерений
Металл ______ рабочий раствор ______________
ПАВ ________ температура __________________
Таблица 1
| i, А/см2 | 1 опыт | 2 опыт | Средние значения | Значения Е по НВЭ | ||||
| Ек, В | Еа, В | Ек, В | Еа, В | Ек, В | Еа, В | Ек, В | Еа, В | |
Пересчет потенциалов на шкалу НВЭ осуществляется по формуле:
Еиэ/нвэ = Еэс/нвэ + Еиэ/эс
Еиэ/нвэ - потенциал ИЭ по шкале НВЭ
Еэс/нвэ - потенциал ЭС по шкале НВЭ (Справочник химика, т.3)
Еиэ/эс - потенциал ИЭ относительно ЭС, т.е. показания потенциометра. Необходимо учитывать знак всех Е.
Для весовых измерений:
металл __________кислота ___________________
температура _______ПАВ, СПАВ _________ моль/л
площадь образца (S) ____ см2, продолжительность испытания ( )____час.
)____час.
Таблица 2
| Скисл., моль/л | №№ образцов | Масса образца, г |  ,г ,г
|  , г
(г) , г
(г)
| j, г/см2час | lg j | pН | К | Z | |
| Нач. m1 | кон. m2 | |||||||||
Таблицы составляются для чистого и ингибированного растворов.
1. Рассчитать значения рН = -lg aH+ , где aH+ =Сf.
Значения f представлены в приложении. Для их определения необходимо пересчитать молярную концентрацию кислоты (C) на моляльную (См):
См = 1000 C /(1000d - C∙М),
где d – плотность раствора кислоты (Справочник химика т. 3), М – молекулярная масса кислоты.
2. Построить прямые lg j - рН и определить  .
.
3. Построить поляризационные кривые, найти тафелевы коэффициенты и рассчитать по формулам (9) и (2) значения  . Свести значения констант в таблицу.
. Свести значения констант в таблицу.
Таблица 4
| Среда | 
| 
| 
| 
| 
| 
| 
|
Примечание:  ,
, 
4. Сопоставляя значения  и
и  , определить характер замедленной стадии водородной деполяризации при коррозии металла в чистой кислоте и влияние на эту стадию ингибитора.
, определить характер замедленной стадии водородной деполяризации при коррозии металла в чистой кислоте и влияние на эту стадию ингибитора.
5. Определить защитное действие ингибиторов:
коэффициент торможения 
степень защиты 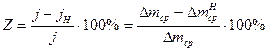 ,
,
где  и j относятся к чистой кислоте, а
и j относятся к чистой кислоте, а 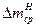 и jH - c добавкой ингибитора.
и jH - c добавкой ингибитора.
6. Построить графики К–рН, Z-рН и сформулировать выводы.
Контрольные вопросы
1. Стадии процесса водородной деполяризации.
2. Влияние природы металла и ПАВ на характер замедленной стадии
3. Электрохимическая коррозия с водородной деполяризацией.
4. Метод Антропова, его ограничения.
5. Методика эксперимента и принципы расчетов.
Дополнительные меры безопасности
Запрещается поправлять электроды и электролитические ключи в ячейке при включенном источнике тока. После снятия каждой кривой следует отключить источник тока, установить в исходное положение регулятор напряжения, сопротивления, переключатели регистраторов.
Приложение
Средние коэффициенты активности H2SO4 и HCl в водных растворах.
| Смв | H2SO4 | HCl | |||||||
| 100 | 200 | 250 | 300 | 100 | 200 | 250 | 300 | ||
| 0,5 1,0 1,5 2,0 3,0 4,0 5,0 6,0 7,0 | 0,181 0,153 0,147 0,149 0,173 0,215 0,275 0,350 0,440 | 0,162 0,137 0,131 0,132 0,151 0,184 0,231 0,289 0,359 | 0,154 0,130 0,124 0,124 0,141 0,171 0,212 0,264 0,326 | 0,147 0,123 0,117 0,118 0,132 0,159 0,196 0,242 0,297 | 0,769 0,830 0,927 1,053 1,401 1,911 2,597 3,615 5,025 | 0,762 0,816 0,907 1,024 1,345 1,812 2,431 3,337 4,574 | 0,757 0,809 0,897 1,009 1,316 1,762 2,352 3,206 4,365 | 0,753 0,753 0,885 0,993 1,267 1,686 2,272 3,075 4,159 | |






