Введение
По проекту международного стандарта коррозией называется химическое и (или) электрохимическое взаимодействие между металлическим материалом и окружающей средой, вызывающее изменение его свойств, что в большинстве случаев приводит к нарушению его функций.
Отличие электрохимической коррозии от химической состоит в протекании пространственно разделенных реакций окисления и восстановления, протекающих сопряженно, причем скорость каждой из них, кроме прочих факторов, зависит от электродного потенциала. Процесс коррозии включает протекание анодной реакции окисления металла и катодной реакции восстановления окислителя. Указанные реакции могут протекать на одних и тех же участках поверхности, либо на разных.
Электрохимическая коррозия возможна, когда нернстовский потенциал металла отрицательнее равновесного потенциала какого-либо окислительно-восстановительного процесса в данном растворе, т.е. 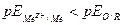 В качестве окислителей (катодных деполяризаторов) в водных средах обычно выступают
В качестве окислителей (катодных деполяризаторов) в водных средах обычно выступают 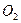 и
и 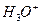 , а процессы коррозии называются протекающими соответственно с кислородной и водородной деполяризацией. Для определения термодинамической возможности протекания таких процессов необходимо рассмотреть диаграмму "потенциал-pH” характеризующую область термодинамической стабильности воды, рис.1.
, а процессы коррозии называются протекающими соответственно с кислородной и водородной деполяризацией. Для определения термодинамической возможности протекания таких процессов необходимо рассмотреть диаграмму "потенциал-pH” характеризующую область термодинамической стабильности воды, рис.1.
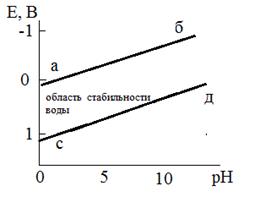 Рисунок 1
Рисунок 1
|  Рисунок 2
Рисунок 2
|
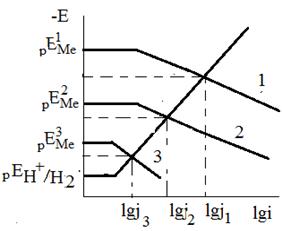 Рисунок 3
Рисунок 3
| 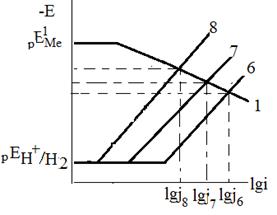 Рисунок 4
Рисунок 4
|
Реакции катодной деполяризации в кислой, нейтральной и щелочной среде имеют вид соответственно:
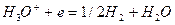 (1)
(1)

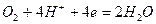 (2)
(2)
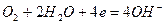 (3)
(3)
Выражения для равновесных потенциалов описываются уравнениями (4) и (5):
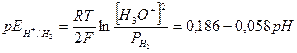 (4)
(4)
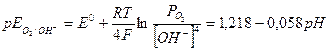 (5)
(5)
Выражения отвечают условиям: 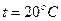 ,
, 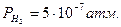
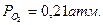 , т.е. Р – парциальное давление соответствующего газа в атмосфере.
, т.е. Р – парциальное давление соответствующего газа в атмосфере.
Уравнениям (4) и (5) соответствуют прямые aб и cд. Если 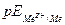 находится в области, расположенной ниже линии cд, металл в отсутствии посторонних окислителей не подвергается коррозии. Если
находится в области, расположенной ниже линии cд, металл в отсутствии посторонних окислителей не подвергается коррозии. Если 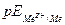 лежит в области между aб и cд, металл корродирует с кислородной деполяризацией. И наконец, если
лежит в области между aб и cд, металл корродирует с кислородной деполяризацией. И наконец, если 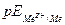 находится выше прямой aб, коррозия металла происходит со смешанной кислородно-водородной деполяризацией.
находится выше прямой aб, коррозия металла происходит со смешанной кислородно-водородной деполяризацией.
Здесь рассмотрена термодинамическая возможность электрохимической коррозии, которая предпочтительна для процессов с кислородной деполяризацией. Информация о скорости процесса может быть получена на основании кинетических измерений.
Различие процессов коррозии с кислородной и водородной деполяризацией состоит в том, что первый протекает обычно при диффузионном контроле, а второй, особенно в кислых средах, - при электрохимическом. Замедленность транспортных стадий при кислородной деполяризации обусловлена его малой растворимостью, отсутствием миграции, относительно низким коэффициентом диффузии, наличием только естественной конвекции. Для 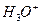 -деполяризации указанные ограничения не играют существенной роли. Исключение составляют нейтральные и щелочные среды, где возможно установление предельного диффузионного тока по
-деполяризации указанные ограничения не играют существенной роли. Исключение составляют нейтральные и щелочные среды, где возможно установление предельного диффузионного тока по 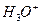 - ионам и катодный процесс будет протекать также по реакции (6):
- ионам и катодный процесс будет протекать также по реакции (6):
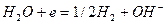 (6)
(6)
Если процесс коррозии протекает с катодным контролем, т. е. его скорость определяется в большей степени реакцией восстановления окислителя и стационарный потенциал коррозии 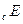 близок к
близок к 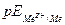 , то указанное различие кислородной и водородной деполяризации играет существенную роль. Если коррозия с кислородной деполяризацией происходит в условиях предельного диффузионного тока по кислороду, т.е.
, то указанное различие кислородной и водородной деполяризации играет существенную роль. Если коррозия с кислородной деполяризацией происходит в условиях предельного диффузионного тока по кислороду, т.е. 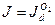 , то ее скорость не зависит от природы основного металла и катодных включений, от площади анодных участков, а существенно зависят от перемешивания. Независимость тока коррозии от природы основного металла (
, то ее скорость не зависит от природы основного металла и катодных включений, от площади анодных участков, а существенно зависят от перемешивания. Независимость тока коррозии от природы основного металла (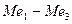 ) и катодных включений (
) и катодных включений (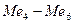 ) иллюстрирует рис.2.
) иллюстрирует рис.2.
Напротив, при коррозии с водородной деполяризацией в условиях кинетического контроля скорость процесса существенно зависит от природы основного металла (рис.3), катодных включений (рис.4), от площади катодных и анодных участков.
Экспериментальная часть
Задание 1
Цель работы: Определение скорости коррозии с водородной деполяризацией. Выяснение влияния примесей в металлена процесс коррозии.
Оборудование, посуда, реактивы
1. Установка для определения скорости коррозии объемным методом.
2. Весы аналитические.
3. Склянка на 1 л.
4. Образцы исследуемых металлов.
5. Раствор соляной или серной кислоты (0,01 – 1,0 моль/л).
6. Секундомер или часы.
7. Мерный цилиндр на 200мл.
Методика выполнения работы
Скорость коррозии определяется весовым и объемным методом. Установка для определения скорости коррозии по объему выделившегося водорода имеет следующий вид (рис.5).
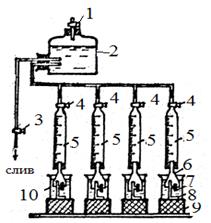 Рисунок 5
Рисунок 5
| 1,3,4 - краны 2 - бутыль-ресивер 5 - бюретка 6 - воронка 7 - образец металла 8 - держатель образца. 9 - подставка 10 - стакан |
1. Образцы цинка с добавками (3%) кадмия, олова, свинца зачистить наждачной (бумагой, обезжирить при кипячении в спирте, промыть в свежей порции спирта и высушить на фильтровальной бумаге.
2. Взвесить образцы с точностью до 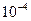 г.
г.
3. Заполнить бутыль-ресивер 2 до верхней метки водой через к ран I при
закрытых кранах 3 и 4.
4. Закрыть кран I и открыть кран 3.
5. Подготовленные образцы 7 навесить на держатели8, установить в стаканы
10 и разместить их так, чтобы они находились в воронках 6.
6. С каждым из элементов установки проделать следующие операции:
6.1. Залить в каждый стакан по 150 мл раствора кислоты
6.2. Осторожно открыть кран 4, быстро и равномерно заполнять бюретку до верхнего деления (50 мл).
6.3. Закрыть кран4, после заполнения всех бюреток закрыть кран 3.
6.4. В течение первых 5 минут ежеминутно, а затем через каждые 5-10 минут снимать показания мениска в бюретке. Продолжительность опыта 1-1,5 часа. В конце опыта измерить линейкой расстояние от уровня жидкости в стакане до мениска в бюретке.
6.5. По окончании опыта, открыв краны I и 4, слить остатки кислоты из бюретки в стакан, быстро выгрузить образец, промыть его водопроводной и дистиллированной водой, высушить фильтровальной бумагой и повторно взвесить на тех же весах.
7. При открытых кранах I и 4 промыть бюретки оставшейся в бутыли 2 водой.
Обработка результатов измерений
Форма заполнения отчета
Таблица
| Материал образца | |||||||
| Площадь образца S, см2 | |||||||
Начальная масса 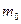 , г. , г.
| . | ||||||
Время от начала опыта 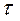 , мин , мин
| Количество выделившегося водорода V | ||||||
| см3 | см3/ см2 | см3 | см3/ см2 | см3 | см3/ см2 | ||
…
Конечная масса образца 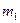 , г.
Объемный показатель коррозии , г.
Объемный показатель коррозии 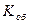 , см3/ см2ч
Массовый показатель коррозии , см3/ см2ч
Массовый показатель коррозии 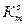 , г/ м2ч , г/ м2ч
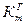 , г/ м2ч
Расхождение величины , г/ м2ч
Расхождение величины 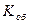 и и 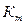 , , 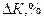
| |||||||
2. Построите график 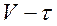 .
.
3. Рассчитать объемный показатель коррозии:
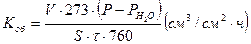 (7)
(7)
V- объем водорода, выделившегося за время испытаний ( ),
),
 - время опыта (ч)
- время опыта (ч)
Т - температура (К)
Р- давление (мм рт. ст.); 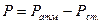 ;
; 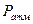 - атмосферное давление;
- атмосферное давление; 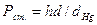 - разряжение, создаваемое столбом жидкости; h - расстояние от уровня жидкости в стакане до мениска в бюретке (мм),d - плотность раствора кислоты (см. приложение, табл.3);
- разряжение, создаваемое столбом жидкости; h - расстояние от уровня жидкости в стакане до мениска в бюретке (мм),d - плотность раствора кислоты (см. приложение, табл.3); 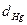 — плотность ртути;
— плотность ртути; 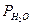 - давление насыщенного водяного пара (мм) (см. приложение, табл.1)
- давление насыщенного водяного пара (мм) (см. приложение, табл.1)
4. Рассчитать массовый показатель коррозии (через объемный):
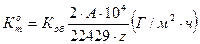 (8)
(8)
А- атомнаямасса металла(цинка)
z - валентность металла.
5. Рассчитать массовый показатель коррозии из гравиметрических измерений:
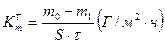 (9)
(9)
6. Определить расхождение массового и объемного показателей коррозии (при помощи величин 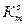 и
и 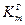 ):
):
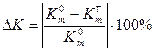 (10)
(10)
7. Сопоставить показатели коррозии с водородным перенапряжением на металлах примесей (константы “а" и "в") (см-приложение, табл.2).
8. Сделать выводы.
Задание 2.
Цель работы: Определение скорости коррозии с водородной деполяризацией. Выяснение влияния природы и концентрации примесей в растворе на процесс коррозии.
Оборудование, посуда, реактивы
1. Установка для определения скорости коррозии объемным методом
2. Весы аналитические
3. Секундомер или часы
4. Склянка на 1-2 л
5. Цинковые образцы - 6 шт
6. Раствор 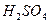 или
или 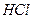 (0.01-1.0 моль/л) — 0,6 л,
(0.01-1.0 моль/л) — 0,6 л,
7. Растворы солей 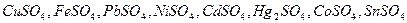 (конечная концентрация в рабочем растворе 0,01-0 ,05 моль-экв/л)
(конечная концентрация в рабочем растворе 0,01-0 ,05 моль-экв/л)
8. Мерный цилиндр на 200 мл.
Методика выполнения работы
В качестве примесей, содержащихся в агрессивной среде, взяты соли металлов, более электроположительных, чем цинк. При погружении цинка в такие растворы происходит реакция цементации:
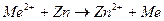 (11)
(11)
Выделяющийся на цинковом образце металл является более или менее эффективным катодом для реакции водородной деполяризации по сравнению с цинком. Это связано с разным водородным перенапряжением цинка и контактно осажденным металлом. Схема установки и обработка результатов, как и в задании 1.
Занятие 3.
Цель работы: Снятие катодной поляризационной кривой. Расшифровка катодной поляризационной кривой.
Оборудование, посуда, реактивы
1. Установка для снятия поляризационных кривых с ячейкой – 1
2. Вращающийся дисковый электрод – I
3. Секундомер или часы
4. Склянка на 0,5-1,0 л — I
5. Стаканы или широкогорлые колбы на 100мл – 2
6. Мерный цилиндр
7. Образцы исследуемых металлов - 28.
8. 1%-й раствор хлорида натрия
9. Перекись водорода.
Методика выполнения работы
Снять катодные поляризационные кривые
- на неподвижном электроде в растворе 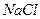 ;
;
- на вращающемся электроде в растворе 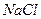 ;
;
- на неподвижном электроде в растворе 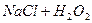 ;
;
- то же в растворе 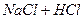 ;
;
Значения плотностей тока, концентраций 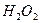 и
и 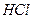 , число оборотов диска, металлы - по указанию преподавателя.
, число оборотов диска, металлы - по указанию преподавателя.
1. Поляризационные кривые снимаются в термостатированной ячейке с разделенными электродными пространствами на установке, схема которой представлена на рис.6.
 Рисунок 6 Рисунок 6
| Ток, подаваемый на ячейку от источника тока (И), регулируется магазином сопротивлений (R) и регистрируется миллиамперметром (mA). |
Потенциал исследуемого электрода (ИЭ), который является катодом, измеряется относительно электрода сравнения (ЭС) и пересчитывается на нормальный водородный электрод (НВЭ).
Измерение потенциала производится при помощи вольтметра (В).
2. Электрод погружается в ячейку и подключается к измерительной и поляризующей системам. Необходимо следить, чтобы капилляр Луггина (КЛ) электролитического ключа располагался в непосредственной близости от ИЭ. Часть ЭК, обращенная к ячейке, заполняется исследуемым раствором, другая часть насыщенным раствором 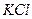 . Электрод выдерживается в ячейке без поляризации 5 мин., затем изменяется
. Электрод выдерживается в ячейке без поляризации 5 мин., затем изменяется 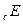 . Задаются ступенчато меняющиеся значения i и после выдержки при каждом i в течение 2 мин. производится измерение потенциала катода. Каждая кривая снимается на вновь защищенном электроде после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке. Каждую кривую следует воспроизводить не менее 2-3 раз.
. Задаются ступенчато меняющиеся значения i и после выдержки при каждом i в течение 2 мин. производится измерение потенциала катода. Каждая кривая снимается на вновь защищенном электроде после замены электролита в ячейке. Заполнение ЭК можно производить только при изменении состава раствора в ячейке. Каждую кривую следует воспроизводить не менее 2-3 раз.
3. Перед снятием каждой кривой дисковый электрод защищается тонкой наждачной бумагой и промывается спиртом. Затем высушивается фильтровальной бумагой.
Обработка результатов измерений
1. Форма заполнения рабочего журнала.
Условия опыта:
металл______, раствор_____________________
температура____  , скорость вращения диска________________об/мин.
, скорость вращения диска________________об/мин.
Таблица
| i, А/ см2 | Значения Е, В | |||
| 1-й опыт | 2-й опыт | Среднее значение | Значение по НВЭ | |
| 1 | 2 | 3 | 4 | 5 |
Пересчет потенциалов на шкалу НВЭ производится с учетом знаков Е по формуле:
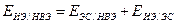 (12)
(12)
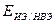 - потенциал ИЭ по шкале НВЭ
- потенциал ИЭ по шкале НВЭ
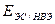 - потенциал электрода сравнения по НВЭ(справочник химика, т.3)
- потенциал электрода сравнения по НВЭ(справочник химика, т.3)
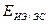 - потенциал ИЭ относительно ЭС, т.е. показания вольтметра.
- потенциал ИЭ относительно ЭС, т.е. показания вольтметра.
2. Построить поляризационные кривые в координатах Е-i и Е-lgi, проанализировать различные участки кривых и прежде всего области предельных токов (рис.7).
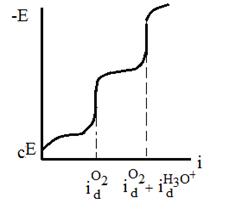
Рисунок 7
3. Если на кривой одна область предельного тока, то суждение о природе деполяризации может быть получено на основании влияния на величину 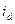 рН раствора. Если при добавлении
рН раствора. Если при добавлении 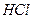 произойдет увеличение
произойдет увеличение 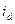 , то этот ток отвечает диффузии ионов
, то этот ток отвечает диффузии ионов 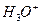 . Если изменения
. Если изменения 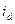 не произойдет, то в качестве катодного процесса следует рассматривать восстановление молекул кислорода. Величина
не произойдет, то в качестве катодного процесса следует рассматривать восстановление молекул кислорода. Величина 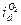 может быть снижена добавкой сульфита. Перекиси водорода может отвечать своя величина
может быть снижена добавкой сульфита. Перекиси водорода может отвечать своя величина 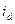 . Значения
. Значения 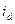 не должны практически зависеть от природы металла электрода.
не должны практически зависеть от природы металла электрода.
4. Сделать выводы.
Задание 4.
Цель работы: Исследование зависимости скорости коррозии с кислородной деполяризацией от времени. Исследование влияния регуляторов содержания кислорода и ингибиторов на скорость коррозии с кислородной деполяризацией.
Оборудование, посуда, реактивы
1. Установка с ячейкой для измерения скорости коррозии по методу Киша и Сетеи - I
2. Секундомер или часы - I
3. Склянка на 1 л — I
4. Стаканы на 100 мл – 4
5. Мерный цилиндр на 200 мл - I
6. Образцы исследуемых металлов - 2
7. Раствор 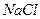 (30 мг/л) +
(30 мг/л) + 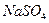 (70 мг/л)
(70 мг/л)
8. Нитрит натрия, гидразин, сульфит натрия, фосфат натрия.
Методика выполнения работы
Непрерывное определение j осуществляется путем измерения во времени уменьшения количества деполяризатора. Принцип измерения заключается в компенсировании кислорода, расходуемого при коррозии, кислородом, получаемым электролитически. В этом случае величина j рассчитывается по количеству электричества, затраченного на выделение кислорода. Схема установки представлена на рис.8..
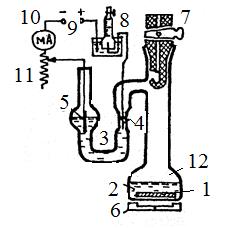 Рисунок 8
Рисунок 8
| 1 - образец исследуемого металла 2 - исследуемый раствор 3 - U -образный электролизер 4 – Pt—анод 5 - Ni –катод 6 - магнитная мешалка 7 - кран 8 - газовый кулонометр 9 - источник электрического питания 10 - регистратор тока 11 - регулятор тока 12 - сосуд |
1. Залить в сосуд 12 исследуемый раствор (30-40 мл).
2. Термостатировать сосуд в течение 10 мин.
3. Зачистить образец I наждачной бумагой, обезжирить растворителем, высушить фильтровальной бумагой и загрузить в сосуд 12 с исследуемым раствором.
4. Электролизер 3 заполнить 20%-ным раствором 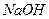 так, чтобы при открытом кране 7 поверхность щелочи в правом колене находилась и контакте с электродом 4.
так, чтобы при открытом кране 7 поверхность щелочи в правом колене находилась и контакте с электродом 4.
5. Закрыть кран 7, подключить ячейку к электрической схеме, включить магнитную мешалку 6 и увеличить число оборотов электрода I до появления на поверхности жидкости воронки. При коррозии кислород из жидкости 8 и газовой фазы расходуется, создается разряжение и происходит повышение уровня щелочи в правом колене сосуда 3. При этом щелочь контактирует с анодом 4 и начинается электролиз с выделением 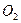 . В результате этого в сосуде повышается давление и происходит выдавливание щелочи из капилляра вблизи электрода4, что приводит к размыканию электрической цепи.
. В результате этого в сосуде повышается давление и происходит выдавливание щелочи из капилляра вблизи электрода4, что приводит к размыканию электрической цепи.
6. Показания газового кулонометра снимать каждые 5 мин. в течение 1 часа, затем в сосуд 12 добавить 5 мл раствора гидразина или сульфата натрия, продолжив измерение в течение 0,5 часа, затем добавить еще 5 мл раствора нитрита или фосфата натрия и продолжить измерения еще 0,5-1,0 час.
7. Выключить мешалку, отключить ячейку от электрической цепи.
Металл, добавка, ее концентрация - по заданию преподавателя.
Обработка результатов измерений
1. Форма заполнения рабочего журнала.
Условия опыта:
Металл ________, Основной раствор _____________
Температура t____ 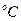 , Поверхность образцаS_____ см2
, Поверхность образцаS_____ см2
Таблица
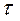 , мин. , мин.
| V(кул-ра), см3 | Q(пр.), Кл |
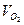 (погл), cм3 (погл), cм3
| Коб, 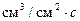
| К, г/ см2ч | К | Z,% |
| t1=5 | |||||||
| t2=10 | |||||||
| tn=60 | |||||||
| Добавка | |||||||
| tn+1=65 | |||||||
| tn+2=70 | |||||||
| tm=95 |
2. Занести показания кулонометра V ( см3 ) в таблицу.
3. Рассчитать количество пропущенного через электролизер электричества 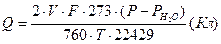 (13)
(13)
4. Рассчитать количество поглощенного в ячейке в результате протекания коррозии кислорода:
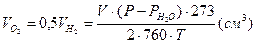 (14)
(14)
Примечание: См. пояснения к п. 3 задания 1.
5. Построить графики зависимости V, Q и 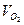 от
от 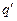 .
.
6. Если графики для каждого состава раствора представляют собой прямые линии, то истинные скорости коррозии (объемный и массовый показатели) в каждый момент времени и для каждого временного интервала совпадают со средними показателями:
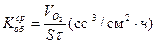 (15)
(15)
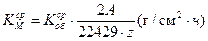 (16)
(16)
В этом случае следует рассчитать только средние показатели скорости для чистого раствора и с добавками.
7. Если графики 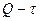 и
и 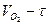 представляют собой кривые, расчеты по формулам (15) и (16) следует производить для каждого 5-минутного интервала. В этом случае
представляют собой кривые, расчеты по формулам (15) и (16) следует производить для каждого 5-минутного интервала. В этом случае 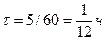 , а вместо
, а вместо 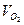 подставлять разность значений
подставлять разность значений 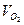 в конце и в начале каждого 5-минутного интервала.
в конце и в начале каждого 5-минутного интервала.
8. Рассчитать K и Z:
- по средним показателям 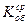 или
или 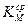 рассчитать
рассчитать 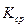 и
и 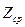 :
:
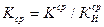 (17)
(17)
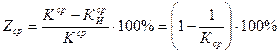 (18)
(18)
где 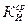 - относится к раствору с добавкой;
- относится к раствору с добавкой;
- при нелинейности графиков 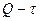 и
и 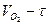 рассчитать значения K и Z для каждого 5-минутного интервала и построить графики
рассчитать значения K и Z для каждого 5-минутного интервала и построить графики 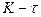 и
и 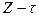 . При расчетах по формулам (17) и (18) взять значения
. При расчетах по формулам (17) и (18) взять значения 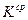 для интервала
для интервала 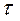 , предшествующего введению добавки.
, предшествующего введению добавки.
Контрольные вопросы
1. Определение коррозии.
2. Электрохимический механизм коррозии.
3. Термодинамическая возможность электрохимической коррозии.
4. Типы катодных процессов при коррозии, их сопоставительная характеристика.
5. Методика эксперимента и принципы расчетов.
Дополнительные меры безопасности
1. В связи с накоплением водорода категорически запрещаются работа с открытым огнем вблизи рабочих установок.
2. При выполнении заданий 3 и 4 запрещается поправлять электроды и электролитические ключи при включенном источнике питания.
Приложения
Таблица 1. Зависимость давления насыщенного водяного пара от температуры
t, 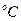
| 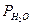 , мм рт.ст. , мм рт.ст.
|
t, 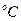
|  , мм рт.ст. , мм рт.ст.
|
| 9.2 9.8 10.6 11.2 12.0 12.8 13.6 14.5 16.6 16.5 17.6 | 18.7 19.8 21.1 22.4 23.8 25.2 26.7 28.3 30.0 31.8 33.7 |
Таблица 2. Значение тафелевых констант "а” и “b” для катодного выделения водорода на некоторых металлах в I M  при 25°С
при 25°С
| Me | a, B | b | Me | a, B | b | Me | a, B | b |
| Ag Al Сd Co Cu | 0.95 1.00 1.40 0.62 0.87 | 0.10 0.10 0.12 0.14 0.12 | Fe Hg Ni Pb Pt | 0.70 1.41 0.63 1.56 0.10 | 0.12 0.11 0.11 0.11 0.03 | Sb Sn Ti W Zn | 1.00 1.20 0.82 0.43 1.24 | 0.11 0.13 0.14 0.10 0.12 |
Таблица 3. Плотность растворов кислот при 20°С
| 
| ||||||
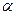
| С, моль/л | 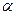
| С, моль/л | 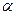
| С, моль/л | 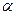
| С, моль/л |
| 1.000 | 0.0987 0.3745 0.6547 0.939 1.227 1.520 1.817 2.118 2.421 | 1.045 | 2.725 3.029 3.333 3.638 3.944 4.253 4.565 4.878 5.192 | 1.000 | 0.0266 0.1783 0.3372 0.4983 0.6613 0.8250 0.9856 1.152 1.317 | 1.090 | 1.484 1.652 1.820 1.990 2.161 2.857 3.033 3.211 3.391 |






