Химия – это область естествознания, наука о веществах, их составе, строении, свойствах и превращениях (рис.1).
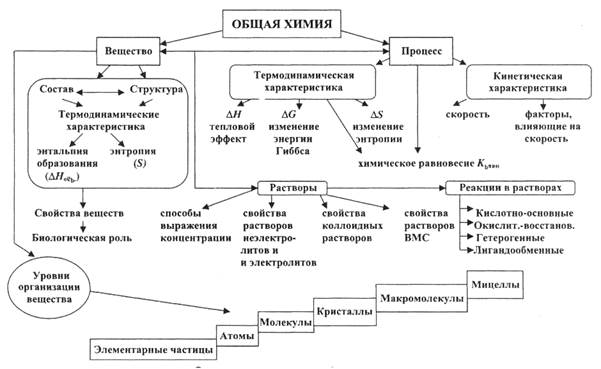
Рис.1.Основные понятия общей химии.
Атом – электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекула – отдельная электронейтральная частица, которая образуется при возникновении ковалентных связей между атомами одного или нескольких элементов и определяет химические свойства вещества.
Химический элемент – совокупность атомов с одинаковым положительным зарядом ядра. Все элементы делят на металлы и неметаллы. К неметаллам относят 22 элемента: водород, бор, углерод, кремний, азот, фосфор, мышьяк, кислород, серу, селен, теллур, галогены и благородные газы, к металлам – все остальные элементы. Химические элементы могут иметь несколько форм существования: в виде свободных атомов, простых и сложных веществ, а также ионов и радикалов.
Вещество – форма материи, состоящая из частиц, которые имеют массу покоя, например, атомов, молекул, ионов(в отличие от частиц поля, не имеющих массы покоя).
Вещества, образованные атомами одного химического элемента, называют простыми,а двух и более – сложными.
Один и тот же химический элемент может образовывать несколько простых веществ. Это явление называют аллотропией,а различные простые вещества, образованные одним элементом, – аллотропными модификациями. Причиной аллотропии может быть как разное число атомов в молекуле (например, модификации кислорода – кислород О2 и озон О3), так и разное строение кристаллических форм (например, модификации углерода: алмаз – с тетраэдрической кристаллической решеткой, графит – с плоскостной, карбин – с линейной).
Вещества могут иметь один и тот же качественный и количественный состав (т. е. одинаковые молекулярные формулы), но разное строение, а, следовательно, разные свойства. Это явление называют изомерией,а вещества – изомерами (например, роданид аммония NH4SCN и тиомочевина (NH2)2CS).
Радикалы – это атомы или группировки атомов, имеющие, по меньшей мере, один неспаренный электрон (свободную валентность). Радикалы образуются, если молекулу разделить на атомы (или группы атомов) так, чтобы каждый (или каждая) получил по электрону из общей электронной пары. Радикалы в целом электронейтральны, так как имеют одинаковое число электронов и протонов.
Ионы – частицы, у которых наблюдается дисбаланс между положительным зарядом ядра и числом электронов.
Отдавая электроны, атомы превращаются в положительные ионы – катионы: Na0 – 1е →Na+. Это ионы металлов Меn+, водорода Н+, аммония NН4+ и др.
Присоединяя электроны, атомы превращаются в отрицательные ионы – анионы:Cl0 +1е→ Cl-1. Это простые анионы неметаллов: Н - (гидрид-анион), S2-(сульфид-анион) и др.; сложные по составу анионы: ОН - (гидроксид-анион), SO42- (сульфат-анион), SO32- (сульфит-анион) и др.
Химические формулы – это способ отражения химического состава вещества. Химическая формула обозначает одну молекулу вещества или один моль этого вещества. По химической формуле можно также определить качественный состав вещества, число атомов каждого элемента в 1 моль вещества и рассчитать его относительную молекулярную и молярную массы. Виды химических формул:
1) Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество: атомы, ионы или группы атомов (например, простейшие формулы этена и пропена совпадают – СН2).
2) Молекулярная (истинная) формула отражает качественный состав и число составляющих вещество частиц (например, С2Н4– этен и С3Н6 – пропен), но не показывает порядок связи частиц в веществе, т. е. его структуру.
3) Структурная (графическая) формула отражает порядок соединения частиц, т. е. связи между ними (например, структурная формула молекулы оксида серы (VI): О – S=О).
Число природных и синтезированных веществ составляет более 20 млн. Каждое из них при данных условиях обладает определенной совокупностью физических и химических свойств.
Физические свойства веществ: агрегатное состояние (твердое (тв.), жидкое (ж.), газообразное (г.)), температура кипения, температура плавления, плотность (ρ), выраженная в г/см3, кг/дм3 и др., растворимость (например, выраженная в г/100г Н2О), цвет, запах, вкус и др.
Способность данного вещества при определенных условиях или при взаимодействии с другими веществами образовывать новые вещества называется его химическими свойствами.
Химические реакции –превращения одних веществ в другие.
Химическое уравнение– это условная запись химической реакции с помощью химических знаков и формул в стехиометрических соотношениях. Коэффициенты в уравнении реакции – числа, которые показывают мольные соотношения участвующих в реакции веществ. Если в уравнении указывают тепловой эффект в расчете на 1 моль реагента или продукта, то такое уравнение реакции называют термохимическим.






