РАЗДЕЛ 2. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Основные формулы
1. Основное уравнение молекулярно-кинетической теории газов
Р = (n m0<υкв>2)/3 = (2/3)n<Wк>,
Р = nkT,
где Р – давление; n – число молекул в единице объема; m0 – масса одной молекулы газа; < υкв > – средняя квадратичная скорость молекулы; k –постоянная Больцмана; Т – абсолютная температура.
2. Концентрация молекул
n = N/V,
где N – число молекул, содержащихся в данной системе; V – объем.
3. Средняя кинетическая энергия поступательного движения молекулы
<Wк> = (3/2) kT.
4. Средняя кинетическая энергия молекулы
<W> = (i/2) kT,
где i – число степеней свободы молекулы.
5. Средняя квадратичная скорость молекулы
<υкв> =  =
=  ,
,
где k – постоянная Больцмана; Т – абсолютная температура; m0 – масса молекулы; μ – молярная масса; R – универсальная газовая постоянная.
6. Средняя арифметическая скорость молекулы
<υ> =  =
= 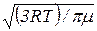 .
.
7. Наиболее вероятная скорость молекулы
υв = 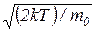 =
=  .
.
8. Количество вещества
n = m/ μ = N/NA,
где m – масса вещества; μ – его молярная масса; N – число молекул; NA – число Авогадро.
9. Уравнение состояния идеального газа (уравнение Менделеева –Клапейрона)
PV = (m/μ) × RT,
где Р – давление газа в сосуде; V – объем сосуда; m – масса газа, содержащегося в данном сосуде; μ – молярная масса газа; R – универсальная газовая постоянная; Т – абсолютная температура.
10. Изотермический процесс (Т = const, m = const)
P1V1 = P2V2.
11. Изохорический процесс (V = const, m = const)
P = P0 (1+ at) или P1/P2 = T1/T2,
где t – температура по шкале Цельсия; T – температура по шкале Кельвина; a – температурный коэффициент.
12. Изобарический процесс (Р = const, m = const)
V = V0(1+ at) или V1/V2 = T1/T2.
13. Работа расширения газа:
в общем случае
A =  ;
;
при изобарическом процессе
A = P DV;
при изотермическом процессе
A = ν R T ln(V2/V1);
при адиабатическом процессе
A = – ν СV ΔТ,
где DV – изменение объема; R – универсальная газовая постоянная; ν – количество вещества; С V – теплоемкость при постоянном объеме; DТ – изменение температуры.
14. Внутренняя энергия идеального газа
U = (ν R T)(i/2) = ν СV Т,
где i – число степеней свободы молекулы.
15. Удельные теплоемкости газа:
при постоянном объеме
сv =(i/2) (R/μ),
при постоянном давлении
ср =(i+2/2) (R/μ).
16. Уравнение Майера для удельных теплоемкостей
ср – сv = R/μ.
17. Уравнение Пуассона
(P V)γ = const,
где γ = Ср / Сv = (i + 2)/ i, Ср,Сv – молярные теплоемкости при постоянном давлении, объеме.
18. Связь между удельной (с) и молярной (С) теплоемкостями
c = С/μ.
19. Уравнение теплового баланса
Q = c m (t2 – t1),
где Q – количество теплоты, необходимое для нагревания тела массой m от температуры t1 до температуры t2; c – удельная теплоемкость вещества.
20. Теплота плавления
Q = l m,
где l – удельная теплота плавления вещества.
21. Теплота парообразования
Q = r m,
где r – удельная теплота парообразования вещества.
22. Первый закон термодинамики
Q = DU + A,
где Q – количество теплоты, сообщенное термодинамической системе; DU – изменение внутренней энергии системы; А – работа, совершенная системой против внешних сил.
23. Коэффициент полезного действия цикла Карно
h = (Q1 – Q2)/Q1 =(T1 – T2) /T1,
где Q1 – количество теплоты, полученное от нагревателя; Q2 – количество теплоты, переданное холодильнику; Т1 – абсолютная температура нагревателя; Т2 – абсолютная температура холодильника.
24. Разность энтропий двух состояний В и А
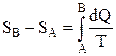 .
.
25. Закон распределения молекул по скоростям (закон Максвелла)
DN = N × f(u) × Du
f(u) = (4/  )
)  u2,
u2,
где ΔN – число молекул, относительные скорости которых лежат в интервале от u до (u + Δu); u =υ/υв – относительная скорость, где υ – данная скорость,
υв – наиболее вероятная скорость молекул; Δu – величина интервала относительных скоростей, малая по сравнению со скоростью u.
26. Барометрическая формула
Ph= P0 e(–μgh/RT),
где Ph – давление газа на высоте h; P0 – давление на высоте h = 0; g – ускорение свободного падения.
27. Средняя длина свободного пробега молекул газа
<λ> = <υ>/<z> = 1/( πσ2n),
πσ2n),
где < υ > – средняя арифметическая скорость; < z > – среднее число столкновений каждой молекулы с остальными в единицу времени; σ – эффективный диаметр молекулы; n – число молекул в единице объема.
28. Общее число столкновений всех молекул в единице объема за единицу времени
Z = (1/2) <z> n.
Примеры решения задач
Пример 1. Определить плотность воздуха при давлении 830 мм рт. ст. и температуре 17 °С.
 Решение. Для решения задачи необходимо перевести данные в единицы международной системы СИ. Давление воздуха равно 830 мм рт. ст. Это значит, что давление воздуха равно давлению у основания ртутного столба высотой 830 мм, а оно рассчитывается по формуле
Решение. Для решения задачи необходимо перевести данные в единицы международной системы СИ. Давление воздуха равно 830 мм рт. ст. Это значит, что давление воздуха равно давлению у основания ртутного столба высотой 830 мм, а оно рассчитывается по формуле
 ,
,
где Р – давление; ρ – плотность жидкости; g – ускорение свободного падения; h – высота столба жидкости.

Переведем температуру в градусы Кельвина:

Молярная масса воздуха

Плотность газа определяется отношением его массы к объему:
 .
.
Из уравнения Менделеева – Клапейрона выразим плотность:
 ,
,

Пример 2. В баллоне объемом 40 литров находится кислород при температуре 300 К. Когда часть кислорода израсходовали, давление в баллоне понизилось на 100 кПа. Определить массу израсходованного кислорода. Температура газа в баллоне не изменилась.
Решение. Массу израсходованного кислорода можно определить как разность масс газа до работы с баллоном и после работы с баллоном:

В общем виде изменение массы газа определяется по формуле

Решая последнее уравнение, мы получим Dm < 0. Это говорит о том, что масса газа в баллоне уменьшается. В предложенной задаче мы определяем убыль массы газа, а не изменение массы.
Считая кислород в баллоне идеальным газом, мы можем для описания его состояния использовать основное уравнение газового состояния – уравнение Менделеева – Клапейрона

Это уравнение дает возможность выразить значения масс в начальном и конечном состояниях кислорода:

По условию задачи

Определим убыль массы газа:

Масса израсходованного газа Dm = 0.051 кг.
Пример 3. Средняя длина свободного пробега молекулы углекислого газа при нормальных условиях равна 40 нм. Какова средняя арифметическая скорость молекул? Сколько столкновений в секунду испытывает молекула?
Решение. Средняя арифметическая скорость <u> молекул определяется по формуле

где m – масса одного киломоля газа.
Выразим числовые значения R и m в системе СИ и подставим в формулу:


Число столкновений молекулы в секунду < z > зависит от средней скорости молекулы< u > и средней длины ее свободного пробега < l > и выражается формулой

Пример 4. Какое количество теплоты поглощают 200 г водорода, нагреваясь от 0 до 100 °С при постоянном давлении? Каков прирост внутренней энергии газа? Какую работу совершает газ?
Решение. Количество теплоты Q, поглощаемое газом при изобарическом нагревании, определяется по формуле

где m – масса нагреваемого газа; ср – удельная теплоемкость газа при постоянном давлении; DT – изменение температуры газа.
Как известно,
 ,
,
где i – число степеней свободы молекулы газа; R – универсальная газовая постоянная; m – масса одного киломоля газа.
Подставив выражение сp в Q, получим

Выразим величины, входящие в эту формулу, в единицах системы СИ: m = 200 г =0.2 кг; i = 5, т. к. водород – газ двухатомный.
 ;
;
 .
.
Подставим эти значения в формулу Q и произведем вычисление:

Внутренняя энергия газа выражается формулой
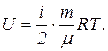
Следовательно, изменение внутренней энергии

Подставив сюда числовые значения в системе СИ, получим
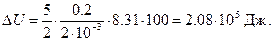
Работу расширения газа найдем по формуле, выражающей первое начало термодинамики,
Q = DU + A,
откуда
A = Q – DU.
Подставив значение Q и DU, найдем
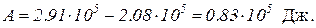
Работу, совершаемую газом, можно определить также по формуле

Подставив числовые значения, получим

Пример 5. Нагреватель тепловой машины, работающей по циклу Карно, имеет температуру 200 °С. Какова температура охладителя, если за счет каждой килокалории тепла, полученной от нагревателя, машина совершает работу 1680 Дж. Потери на трение и теплоотдачу не учитываются.
Решение. Температуру охладителя можно найти, использовав выражение для термического КПД машины, работающей по циклу Карно,

где Т1 – абсолютная температура нагревателя; Т2 – абсолютная температура охладителя.
Отсюда
Т2 = Т1 (1 – h).
Термический КПД тепловой машины есть коэффициент использования теплоты. Он выражает отношение количества теплоты, которое превращено в работу А, к количеству теплоты Q1, которое получено рабочим телом тепловой машины из внешней среды (от нагревателя), т. е.

Найдем температуру охладителя

Выразим все величины в системе СИ и вычислим температуру охладителя:
Q1 = 1 ккал = = 4.19×103 Дж;
Т1 = 200 + 273 = 473 К;
 .
.
Пример 6. Найти изменение энтропии при нагревании 100 г воды от
0 до 100 °С и последующем превращении воды в пар той же температуры.
Решение. Найдем отдельно изменение энтропии  при нагревании воды и изменение энтропии
при нагревании воды и изменение энтропии  при превращении воды в пар. Полное изменение энтропии выразится суммой
при превращении воды в пар. Полное изменение энтропии выразится суммой  и
и  .
.
Как известно, изменение энтропии выражается общей формулой

При бесконечно малом изменении dT температуры нагреваемого тела затрачивается количество теплоты
dQ = mcdT,
где m – масса тела; c – его удельная теплоемкость.
Запишем формулу для вычисления энтропии при нагревании воды:

Вынеся за знак интеграла постоянные величины и произведя интегрирование, получим

Произведем вычисления в системе СИ:
m = 100 г = 0.1 кг;

Т1=273 К;
Т2=100+273=373 К;

При вычислении изменения энтропии во время превращения воды в пар той же температуры постоянная температура T может быть вынесена за знак интеграла. Вычислив интеграл, получим

где Q – количество теплоты, переданное при превращении нагретой воды в пар той же температуры;
Q = lm,
где l – удельная теплота парообразования.
Таким образом, изменение энтропии
 .
.
Выразим числовые значения величин в системе СИ:
 ;
;
m = 0.1 кг;
T = 373 K.
Произведем арифметические действия:
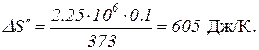
Полное изменение энтропии при нагревании воды и последующем превращении ее в пар

Пример 7. Какая часть молекул водорода, находящегося при температуре 400 К, обладает скоростями, отличающимися от наиболее вероятной скорости не выше чем на 5 м/с?
Решение. Распределение молекул по относительным скоростям выражается уравнением

Здесь N – полное число молекул газа; f (u) – функция распределения Максвелла; u = υ/υв, где υ – данная скорость, υв – наиболее вероятная скорость.
Поскольку в задаче речь идет о наиболее вероятной скорости, надо считать υ = υв. Следовательно, u = 1 и уравнение примет более простой вид:

Отсюда найдем ту часть молекул, относительные скорости которых лежат в интервале Δu:
 . (1)
. (1)
Прежде чем производить расчеты по (1), необходимо убедиться в том, что выполняется условие Δu<<u. Так как u = υ/υв, то
Δu = Δυ/υв. (2)
Чтобы вычислить Δu по (2), найдем сначала наиболее вероятную скорость по формуле

Подставив это значение в (2) и имея в виду, что Δ υ=10 м/с, поскольку в задаче идет речь о скоростях, лежащих в интервале от (υв – 5 м/с) до (υв + 5 м/с), получим Δu = 1/182.
Теперь сделаем подстановку в формулу (1):
 Δu=
Δu= 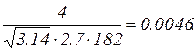
Пример 8. На какой высоте давление воздуха составляет 75 % от давления на уровне моря? Температуру считать постоянной и равной 0 °С.
Решение. Воспользуемся барометрической формулой
 ,
,
где p – давление на высоте слоя газа h; p0 – давление на высоте h = 0; μ – молярная масса газа; T – его абсолютная температура.
Итак, по условию задачи
p = 3p0/4= p0 e–μgh/RT,
откуда
e–μgh/RT = 3/4,
–μgh/RT = ln(3/4),
следовательно,
h = (–RT ln(3/4))/(μg).
Вычислим результат:
h = (–8.31∙273∙ln(3/4))/(0.029∙9.8) = 2296.4 м.
Задачи для самостоятельного решения
1. Средняя квадратичная скорость молекул некоторого газа при нормальных условиях равна 1272 м/с. Какое количество молекул содержится в 1 г этого газа? (Ответ: 1.432 1023.)
2. Кинетическая энергия поступательного движения молекул азота, находящегося в баллоне объемом 0.820 м3, равна 0.949 × 105 Дж, а средняя квадратичная скорость его молекул равна 0.313 × 105 м/с. Найти давление, под которым находится азот. (Ответ: 7.712 104 Па.)
3. Найти среднюю арифметическую скорость молекул газа, плотность которого при давлении 618 мм рт. ст. равна 61.778 г/л. (Ответ: 58.2 м/с.)
4. Найти энергию теплового движения молекул аммиака, находящихся в баллоне объемом 53 л при давлении 44 кПа. (Ответ: 6.996 × 103 Дж.)
5. В баллоне, объем которого 1 л, находится водород при температуре минус 49 °С. Давление водорода 283 кПа. Найти число молекул водорода, скорости которых лежат в интервале от 1.19 км/с до 1.21 км/с. (Ответ: 1.081 × 1021.)
6. Определить температуру газообразного азота, при которой скоростям V1 = 300 м/с и V2 = 2V1 соответствуют одинаковые значения функции распределения Максвелла f (V). (Ответ: 328 К.)
7. Определить относительное число молекул газа, скорости которых отличаются не более чем на 0.90 % от наивероятнейшей. (Ответ: 1.494 × 10–2.)
8. Определить среднее значение полной кинетической энергии молекулы водяного пара при температуре 511 К. (Ответ: 2.116 × 10–20 Дж.)
9. С помощью распределения Максвелла по скоростям получить соответствующее распределение молекул по кинетическим энергиям и определить наиболее вероятное значение кинетической энергии при температуре 698 К для молекул гелия. (Ответ: 4.816 × 10–21 Дж.)
10. Определить полную энергию молекул воздуха в единице объема, находящихся на высоте 2.50 км над уровнем моря. Температуру воздуха по высоте считать постоянной и равной минус 8 °С. Давление воздуха на уровне моря равно 766 мм рт. ст.(Ответ: 2.083·105 Дж.)
11. Азот, занимавший объем 23 литра под давлением 347 кПа, изотермически расширился до объема 115 литров. Определить работу расширения газа. (Ответ: 1.284 × 104 Дж.)
12. Водород массой 83 г нагрели на 479 К, причем газу была передана теплота 162 кДж. Найти изменение внутренней энергии водорода. (Ответ: 4.130 × 105 Дж.)
13. Вычислить величину отношения удельных теплоемкостей для газовой смеси, состоящей из 3 кмоль кислорода и 2 кмоль углекислого газа. Газы считать идеальными. (Ответ: 1.37.)
14. Азот нагревался при постоянном давлении, причем ему была сообщена теплота 17 кДж. Какую работу совершил при этом газ? (Ответ:
4.857 × 103 Дж.)
15. Найти работу, совершаемую одним молем ван-дер-ваальсовского газа (азота) при изотермическом расширении его от объема 8 м3 до объема 19 м3 при температуре 361 К. (Ответ: 2,603 × 106 Дж.)
16. В закрытом сосуде объемом 28 л находятся равные массы аргона и азота при нормальных условиях. Какое количество тепла нужно сообщить этой газовой смеси, чтобы нагреть ее на 47 °С? (Ответ: 103 Дж.)
17. Кислород массой 195 г нагревают изобарически, при этом температура газа увеличивается от 76 до 288 °С. Найти изменение энтропии газа. (Ответ: 84.1 Дж/К.)
18. Один киломоль кислорода совершает прямой цикл Карно в интервале температур от 27 до 180 °С. Известно, что отношение максимального за цикл давления к минимальному равно 39. Определить работу, совершаемую газом за цикл. (Ответ: 2.82 ·106 Дж.)
19. В теплоизолированном сосуде находится 107 молей гелия и 82 г льда. В начальный момент температура льда 232 К, гелия – 330 К. Сосуд закрыт подвижным поршнем. Определить изменение энтропии при переходе к равновесию. (Ответ: 24.3 Дж/К.)
20. В двух баллонах, соединенных трубкой с краном, находится 4 кг азота и 8 кг углекислого газа. Определить изменение энтропии системы после открытия крана и установления равновесия. Известно, что температуры и давления газов до смешения были одинаковы.(Ответ: 1.85 ·103 Дж/К.)
Контрольная работа № 2
Студент-заочник должен решить восемь задач того варианта, номер которого совпадает с последней цифрой шифра его зачетной книжки (см. табл. 2).
Таблица 2
| Номер варианта | Номер задачи | |||||||
201. Найти отношение среднеквадратичных скоростей молекул неона и кислорода при одинаковых температурах.
202. Найти число молекул водорода в 1 см3, если давление равно 51 мм рт. ст., а средняя квадратичная скорость его молекул при данных условиях равна 248 м/с.
203. Найти среднюю квадратичную скорость молекул кислорода при температуре 22 °С.
204. Во сколько раз средняя квадратичная скорость пылинки, взвешенной в воздухе, меньше средней квадратичной скорости молекул азота? Масса пылинки 0.0899 мкг.
205. В сосуде объемом 5 л находится 20 г кислорода под давлением 489 мм рт. ст. Найти среднюю квадратичную скорость молекул газа.
206. В сосуде находится 65 г кислорода. Найти число молекул, находящихся в сосуде.
207. В сосуде объемом 3 л находится 58 г кислорода. Найти плотность газа.
208. Средняя квадратичная скорость молекул некоторого газа равна 1226 м/с. Давление газа равно 0.856 × 106 Н/м2. Найти плотность газа при этих условиях.
209. Найти среднюю квадратичную скорость молекул газа, плотность которого при давлении 1082 мм рт. ст. равна 0.511 мг/см3.
210. Найти массу одного киломоля газа, плотность которого при давлении 1146 мм рт. ст. и температуре 83 °С равна 0.604 мг/см3.
211. Найти кинетическую энергию теплового движения молекул, находящихся в 1 г окиси азота при температуре 258 °С.
212. Чему равна энергия вращательного движения молекул, содержащихся в 1 кг азота при температуре 241 °С?
213. Чему равна энергия теплового движения молекул двухатомного газа, заключенного в сосуд объемом 18 л и находящегося под давлением 7.8 МН/м2?
214. Кинетическая энергия поступательного движения молекул азота равна 2.5 МДж, а средняя квадратичная скорость его молекул равна 500 м/с. Найти массу азота в баллоне.
215. Двухатомный газ массой 3.373 кг находится под давлением 0.177 МН/м3 и имеет плотность 0.909 кг/м3. Найти энергию теплового движения молекул газа при этих условиях.
216. Какой энергией теплового движения обладает газ, занимающий объем 86 см3 при давлении 23 мм рт. ст.? Молекулы газа двухатомные.
217. Какой должен быть наименьший объём баллона, который вмещает 0.5 кг кислорода, если его стенки при температуре 27°С выдерживают давление 106 Па. Ответ дать в литрах.
218. Найти массу воздуха, заполняющего аудиторию высотой 6.851 м и площадью пола 346 м2. Давление воздуха 1202 мм рт. ст., а температура помещения 6 °С. (Массу одного киломоля воздуха принять равной 29 кг.)
219. Вычислить среднюю кинетическую энергию поступательного движения молекулы кислорода при температуре 104 °С.
220. В баллоне, объем которого 1.540 м3, находится газ, состоящий из смеси углекислого газа и паров воды. Температура газа 247 °С, число молекул углекислого газа 0.518 × 1023, число молекул паров воды 0.364 × 1023. Вычислить давление газовой смеси.
221. При некоторой температуре скорости молекул однородного газа имеют следующие значения: средняя – 450 м/с, среднеквадратичная – 486 м/с и наиболее вероятная – 398 м/с. Концентрация газа при данных условиях равна 1.90 × 1025 м–3. Определить число ударов молекул за единицу времени об единицу площади сосуда.
222. Определить кинетическую энергию, приходящуюся на одну степень свободы молекулы однородного газа при температуре 738 К. Молярная масса газа 2 кг/кмоль.
223. Определить полную кинетическую энергию всех молекул кислорода, находящегося под давлением 98.8 кПа в сосуде, объем которого равен 2 л.
224. Определить число степеней свободы газа, если среднее значение полной кинетической энергии одной молекулы при нормальных условиях равно 94.185 × 10–22 Дж.
225. Средняя квадратичная скорость некоторого двухатомного газа равна 670 м/с. Масса газа 0.20 кг. Определить кинетическую энергию поступательного движения (всех) молекул данного газа.
226. Атмосферное давление на поверхности Земли 0.1 МПа. На сколько изменится давление при подъеме наблюдателя на высоту 119 м? Температуру воздуха считать постоянной и равной 290 К. (Массу одного киломоля воздуха принять равной 29 кг.)
227. Определить массу двухатомного газа, если средняя квадратичная скорость его молекул равна 850 м/с, а энергия вращательного движения его молекул равна 16.5 кДж.
228. Средняя энергия вращательного движения молекулы некоторого двухатомного газа при определенных условиях равна 5.44 × 10–21 Дж, а средняя арифметическая скорость молекул при этих условиях равна 603 м/с. Определите массу молекулы этого газа.
229. На какой высоте давление воздуха составляет 0.5 от давления на уровне моря, которое равно 1 МПа? Температуру считать постоянной по высоте и равной 283 К. Ответ дать в километрах.
230. Какая часть молекул водорода при 0°С обладает скоростями от 2000 м/с до 2100 м/с?
231. Давление воздуха у основания Останкинской башни 745 мм рт. ст. Каково будет показание барометра при подъеме на башню, если ее высота 540 м? Температуру воздуха считать одинаковой по высоте и равной 24 °С.
232. У поверхности Земли концентрация молекул азота в 2,6 раза меньше концентрации кислорода. На какой высоте концентрации этих газов станут равными? Среднюю температуру атмосферы считать равной минус 28 °С.
233. В кабине вертолета барометр показывает 359 мм рт. ст. На какой высоте летит вертолет, если на взлетной площадке барометр показывал 740 мм рт. ст.? Температуру воздуха считать одинаковой по высоте и равной 15 °С.
234. У поверхности Земли число молекул гелия меньше, чем число молекул углекислого газа, в 6560 раз. На какой высоте число молекул гелия будет во столько же раз больше, чем число молекул углекислого газа? Температуру воздуха считать по высоте постоянной и равной 17 °С.
235. Определить потенциальную энергию пылинок, взвешенных в воздухе на некоторой высоте от пола, если их концентрация на этом уровне в 2 раза меньше, чем у поверхности пола. Температура воздуха 14 °С.
236. Определить массу одной из пылинок, взвешенных в воздухе, если в толщине слоя воздуха 3 см их концентрация различается на 35 % при температуре 22 °С.
237. Какова концентрация молекул воздуха на высоте 1.70 км, если атмосферное давление на уровне моря 749 мм рт. ст.? Температуру воздуха по высоте считать постоянной и равной минус 4 °С.
238. Определить энергию поступательного движения молекул воздуха в 1 м3, находящихся на высоте 2.5 км над уровнем моря. Температуру считать по высоте постоянной и равной минус 13°С. Давление на уровне моря равно 760 мм рт. ст. Молярную массу воздуха принять равной 29·10-3 кг.
239. Определить среднюю квадратичную скорость молекул воздуха, если известно, что их концентрация на высоте 5.60 км в 2 раза меньше, чем у поверхности Земли.
240. В длинном вертикальном сосуде находится однородный газ, масса которого 320 г, молярная масса 40 кг/кмоль. Определить концентрацию молекул у дна сосуда площадью 1 м2. Температура газа по высоте одинакова и равна 29 °С. Высота сосуда 30 м.
241. Определить работу адиабатического расширения водорода массой 1 кг, если температура газа понизилась на 10 К.
242. Водород массой 11 г был нагрет на 17 К при постоянном давлении. Определить работу расширения газа.
243. Три киломоля многоатомного газа нагреваются на 27 °С в условиях свободного расширения в вакуум. Найти количество тепла, сообщенного газу.
244. В закрытом сосуде объёмом 28 л находится азот при нормальных условиях. Какое количества теплоты необходимо сообщить, чтобы нагреть его на 50°С.?
245. Чему равна удельная теплоемкость при постоянном объеме некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна 6.831 кг/м3?
246. Найти для кислорода отношение удельной теплоемкости при постоянном давлении к удельной теплоемкости при постоянном объеме.
247. Какое количество тепла надо сообщить 2 кг кислорода, чтобы нагреть его на 28 °С при постоянном давлении?
248. Шесть киломолей азота, находящегося при нормальных условиях, расширяется адиабатически от объема V1 до объема V2 = 5V1. Найти изменение внутренней энергии газа.
249. Найти удельную теплоемкость при постоянном объеме для газовой смеси, масса киломоля которой равна 31 кг, а отношение удельных теплоемкостей (ср/с v) = 1.63.
250. При изотермическом расширении водорода массой 63 г, имевшего температуру 576 К, объем газа увеличился в три раза. Определить работу расширения газа.
251. Азот массой 655 г был нагрет на 79 К при постоянном давлении. Какую работу совершил газ?
252. Водород массой 82 г был нагрет на 99 К при постоянном давлении. Сколько теплоты поглотил при этом газ?
253. В цилиндре под поршнем находится кислород массой 3 кг при температуре 129 °С. Кислород расширился адиабатически, увеличив свой объем в 13 раз. Найти температуру в конце адиабатического расширения.
254. Для некоторого газа удельные теплоемкости оказались:
ср = 7.246 кДж/(кг × К) и сv = 4.348 кДж/(кг × К). Чему равна масса одного киломоля этого газа?
255. Какая доля теплоты, подводимой к идеальному газу, расходуется на увеличение внутренней энергии газа? Газ одноатомный, процесс изобарический.
256. Какая доля теплоты, подводимой к идеальному газу при изобарическом процессе, расходуется на работу расширения? Газ двухатомный.
257. Кислород, занимавший объем 52 л при давлении 363 кПа, адиабатически расширяется до объема 162 л. Определить работу расширения газа.
258. Кислород массой 8 кг занимает объем 5 м3 и находится под давлением 5 атм. Газ был нагрет сначала при постоянном давлении до объема 24 м3, а затем при постоянном объеме до давления 24 атм. Найти изменение внутренней энергии газа.
259. Азот адиабатически расширяется так, что давление уменьшается
в 9 раз, и затем изотермически сжимается до первоначального давления. Начальная температура азота 355 К. Найти температуру газа в конце процесса.
260. Начальное давление неона равно 1 кПа, начальный объем 92 м3. Газ адиабатно расширился так, что его объем возрос в 15 раз. Найти конечное давление.
261. Мотор сообщает 1 Дж механической энергии холодильнику, поглощающему тепло из морозильной камеры при температуре минус 19 °С и передающему его окружающему воздуху, имеющему температуру 15 °С. Определить изменение энтропии морозильной камеры, считая, что холодильник работает по обратному циклу Карно.
262. У тепловой машины, работающей по прямому циклу Карно, температура нагревателя в 1,76 раза больше температуры холодильника. За один цикл машина производит работу 67 кДж. Вычислить работу, затрачиваемую за цикл на изотермическое сжатие рабочего вещества.
263. Идеальная тепловая машина, работающая по циклу Карно, получает за каждый цикл от нагревателя 2520 Дж теплоты. Температура нагревателя 400 К, температура холодильника 300 К. Найти количество теплоты, отдаваемого холодильнику за один цикл.
264. Идеальная холодильная машина, работающая по обратному циклу Карно, совершает за один цикл работу, равную 37 кДж. При этом она берёт теплоту от тела с температурой минус 10°С и передаёт теплоту телу с температурой 17°С. Найти количество теплоты, отнятого от холодного тела за один цикл.
265. Тепловая машина работает по циклу Карно. Температуры нагревателя и холодильника соответственно 555 и 331 К. Рабочим телом служит воздух массой 16 кг. Известно, что давление воздуха в конце изотермического расширения равно давлению в начале адиабатического сжатия и цикл протекает 54 с. Определить тепловую мощность, подводимую к машине.
266. Идеальная холодильная машина работает как тепловой насос по обратному циклу Карно. При этом она берёт теплоту от воды с температурой 3°С и передаёт её воздуху с температурой 27°С. Найти коэффициент h — отношение теплоты, переданной за некоторый промежуток времени воздуху к работе машины за это же время.
267. КПД паровой машины составляет 48 % от КПД. тепловой машины, работающей по циклу Карно между теми же температурами. Температура пара, поступающего из котла в паровую машину, 262 °С, температура конденсатора 94 °С. Определить мощность паровой машины, если она потребляет за 12 часов 10875 МДж энергии.
268. Двухатомный идеальный газ совершает цикл Карно, при этом на каждый киломоль этого газа при адиабатическом сжатии затрачивается работа 2627 кДж. Температура нагревателя равна 461 К. Определить КПД цикла. Ответ дать в процентах.
269. Цикл состоит из двух изотерм (Т1 = 778 К, Т2 = 356 К) и двух изобар (р1/р2 = 8). Определить КПД цикла, если рабочим веществом служит идеальный газ, число степеней свободы молекул которого равно 5. Ответ дать в процентах.

|
270. Найти КПД тепловой машины, работающей по циклу, изображенному на рисунке. Рабочее тело — одноатомный идеальный газ.
271. Найти изменение энтропии при плавлении 1 кг льда, находящегося при 0°С.
272. Кусок льда массой 790 г, имеющий температуру 180 К, превращается в пар при температуре 373 К. Определить изменение энтропии при этом процессе. Считать теплоемкости воды и льда равными соответственно 4.19 и 1.8 кДж/(кг × К). Давление атмосферное. Удельная теплота плавления минус 0.335 МДж/кг, удельная теплота парообразования 2.26 МДж/кг.
273. Два баллона объемами 5 и 16 м3 соединяются трубкой с краном.
В первом баллоне находится 22 кг воздуха при температуре 28 °С, во втором – 60 кг воздуха при температуре 96 °С. Найти изменение энтропии системы после открывания крана и достижения равновесия, если система находится в термостате.
274. Кислород массой m = 32 г увеличил свой объем в n = 2 раза один раз изотермически, другой — адиабатически. Найти изменение энтропии в каждом из указанных процессов.
275. Два сосуда с водой соединены короткой трубкой с краном. В первом сосуде находится 25 кг воды, нагретой до 322 К, во втором – 71 кг воды, имеющей температуру 320 К. Найти изменение энтропии системы после открывания крана и установления равновесного состояния. Система заключена в теплоизолирующую оболочку.
276. Найти изменение энтропии при изобарическом расширении азота массой 28 г от объёма V 1 = 5 л до объёма V 2 = 10 л.
277. Тепловой двигатель работает по циклу, состоящему из изотермического, изобарического и адиабатического процессов. При изобарическом процессе рабочее вещество – воздух – массой 6 кг нагревается от температуры 61 K до температуры 418 K. Определить изменение энтропии рабочего вещества при изотермическом сжатии.
278. Найти изменение энтропии при изотермическом расширении 12 г водорода от 105 Па до 0.5·105 Па.
279. В результате нагревания 28 г азота его абсолютная температура увеличилась в 1.2 раза, а энтропия увеличилась на 5.3 Дж/К. При каких условиях производилось нагревание (при постоянном объеме или при постоянном давлении)?
280. В результате нагревания 28 г азота его абсолютная температура увеличилась в 2 раза, а энтропия увеличилась на 14.4 Дж/К. При каких условиях производилось нагревание (при постоянном объеме или при постоянном давлении)?






