Лекция № 2.
I. Предмет термодинамики
Объектом исследования термодинамики является система, которая представляет собой тело или группу тел, мысленно выделяемых из окружающей среды и имеющих границу раздела со средой.
Термин термодинамика дословно означает «движение теплоты». Он сохранился исторически, т.к. в настоящее время не отражает сущности рассматриваемых в термодинамике явлений. Термодинамика не изучает само движение, скорость передачи теплоты и работы, она лишь сопоставляет различные состояния систем и выясняет возможности самопроизвольного перехода из одного состояния в другое. Классическая термодинамика рассматривает только макросистемы и не принимает во внимание свойства и поведение отдельных молекул.
В термодинамике изучают:
1. Тепловые эффекты, сопровождающие физические и химические изменения термодинамической системы, а также работу, совершаемую в результате этих изменений;
2. Зависимость тепловых эффектов и работы от условий их протекания;
3. Условия, необходимые для самопроизвольного протекания процессов и предельные равновесные состояния, к которым приводят эти процессы.
В основе термодинамических выводов лежат законы термодинамики, которые сами ниоткуда выведены быть не могут, представляют собой умозаключения, обобщающие опыт человечества и оправдываются следствиями, вытекающими из них.
Термодинамические системы могут быть следующими:
• Гомогенная – система, в которой каждое свойство ее (параметр) имеет одно и то же значение во всех точках объема или меняется плавно от точки к точке.
• Гетерогенная – такая система, которая состоит из нескольких гомогенных систем, отделенных друг от друга поверхностью раздела фаз, на которой свойства меняются скачком.
Пример:
I II III
твердая соль NaCl / насыщенный раствор NaCl / насыщенный пар
NaCl граница 1 H2O + NaCl граница 2 H2O
'(
Na+ + Cl-
ρтв > ρр-ра > ρпара

Таким образом, химический состав и плотность меняются скачкообразно..
• Фаза – гомогенная часть гетерогенной системы, имеющая одинаковые свойства во всех точках всего объема или совокупность отдельных гомогенных частей с одинаковыми свойствами.
• Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией в форме работы или теплоты.
• Закрытая система – не обменивается с окружающей средой веществом.
• Открытая система – обменивается веществом с окружающей средой.
• Адиабатная система – не имеет теплообмена с окружающей средой.
I закон термодинамики
I закон термодинамики рассматривается как следствие закона сохранения и превращения энергии.
• Энергия – мера движения материи.
• Движение – неотъемлемое свойство (атрибут) материи.
Формы движения и соответствующие им виды энергии весьма многообразны. При превращении одних видов энергии в другие всегда наблюдается эквивалентность. Первоначальной формой закона сохранения и превращения энергии был закон эквивалентности превращения энергии (установлен опытным путем):
При превращении одной формы движения в другую энергия исчезнувшего и появившегося движения эквивалентны между собой. Т.е. энергия исчезнувшего движения находится в постоянном количественном отношении к энергии возникшего движения. Это отношение не зависит от условий.
Более поздней формой закона эквивалентных отношений является закон сохранения энергии:
Энергия (Е) не разрушается и не возникает из ничего при всех процессах и явлениях. Суммарная энергия всех частей материальной системы, участвующей в данном процессе не увеличивается и не уменьшается, а остается постоянной.

|
Формы движения материи очень разнообразны, а формы перехода энергии (движения) могут быть разделены на 2 группы:
I. Формы передачи энергии путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путем теплопроводности. Мерой передачи Е в таком случае является теплота (Q).
II. Все виды передачи Е, общей чертой которых является перемещение макроскопических масс под действием каких-либо сил, например: перемещение тел в поле тяготения. Мерой передачи таким способом энергии является работа (A).
Теплота и работа – формы передачи энергии, а не самостоятельные виды энергии.
В термодинамике принято считать теплоту, переданную системе положительной (+), а работу – положительной ту, которую совершает сама система.
Пусть система совершает циклический процесс *, и к концу его возвращается в исходное положение. При этом она получила теплоту и совершила работу, но на разных стадиях цикла Q и A могут быть (+) и (-). Согласно закону сохранения энергии, система, вернувшаяся в исходное состояние, обладает точно таким же запасом энергии, как и перед циклом. Следовательно, вся полученная теплота во время цикла должна расходоваться на совершение работы. Т.е. в цикле:
| A = Q |
* Циклический процесс – процесс, в котором системе изменяет свои свойства и к концу которого возвращается в исходное состояние.
Формулировка I закона термодинамики:
Невозможно построить такую машину, которая, совершая произвольное число раз один и тот же циклический процесс, приводила бы к накоплению энергии в изолированной системе.
То есть вечный двигатель I рода невозможен.
Для того чтобы вывести математическую формулировку I закона термодинамики рассмотрим некий циклический процесс перехода тела из состояния 1 в состояние 2. В цикле А = Q.
 а) 1
а) 1  2
2
А = А1 + А2 Q = Q1 + Q2
Q1 + Q2 = А1 + А2
A2 + A1 = Q1 + Q2
A1 – Q1 = Q2 – A2
б) Заменим путь «б» путем «в» 1  2
2
Q1 + Q3 = A1 + A3
A1 – Q1 = Q3 – A3
в) Заменим путь «в» путем «г» 1  2
2
A2 + A4 = Q1 + Q4
A1 – Q1 = Q4 – A4
Или в общем виде
| Const = Q – A |
Опыт показывает, что Const может быть меньше, больше или равна нулю: Const ≤ 0 или Const ≥ 0.
а) Const > 0, следовательно, Q > A (поглощенная теплота больше совершенной работы, в этом случае избыток теплоты по сравнению с работой поглощается системой и идет на пополнение внутренней энергии).
б) Const < 0, Q < A (в этом случае работа совершается системой не только за счет поглощения теплоты, но и за счет внутренних запасов энергии).
Абсолютную величину внутренних запасов энергии определить невозможно, но ее изменение можно рассчитать путем определения поглощенной теплоты системой и совершенной ей работы.
Интегральная форма I закона термодинамики:
| Q – A = ∆U |
или
| Q = A + ∆U |
∆U – изменение абсолютной величины внутренней энергии.
• Теплота, поглощенная системой расходуется только на совершение работы и изменение внутренней энергии системы.
Дифференциальная форма I закона термодинамики:
| δQ = δA + dU |
- δQ и δА – бесконечно малое количество теплоты или работы (элементарные Q и А);
- ∆U – бесконечно малое изменение внутренней энергии;
- «d» - знак полного дифференциала, записывается только с функцией состояния, которой является внутренняя энергия U, т.к. ее изменение не зависит от пути процесса;
- Q и А в общем случае не являются функциями состояния, т.к. разные пути связаны с разными величинами Q и А.
• Внутренняя энергия ( U) системы включает в себя кинетические энергии всех частиц, из которых состоит система, а также потенциальную энергию их взаимодействия между собой. Кинетическая энергия частиц складывается из энергии поступательного, вращательного и колебательного движения.
Внутренняя энергия не включает в себя кинетическую энергию движения системы как целого и потенциальную энергию нахождения системы в пространстве.
Внутренняя энергия (U) системы, находящейся в данном состоянии имеет одно определенное значение и не зависит от того, каким изменениям подвергалась система до перехода в это состояние. При бесконечно малом изменении состояния системы внутренняя энергия также изменяется на бесконечно малую величину. Следовательно, ∆U – однозначная, непрерывная и конечная функция состояния системы.
В изолированной системе (Q = 0; А = 0): ∆U = 0, т.е. U = Const.
Лекция №3
Приложение I закона термодинамики к идеальным газам
Идеальные газы – газы, в которых отсутствуют какие- либо взаимодействия между частицами, и которые подчиняются 2-м закономерностям:
I. Уравнение Менделеева – Клапейрона (уравнение состояния идеального газа):
| PV = nRT |
Для одного моль идеального газа:
| PV = RT |
II. Закон Гей – Люссака – Джоуля: внутренняя энергия является функцией температуры
| U = f (T) |
 ;
;  ;
; 
Состояние реального газа приближается к идеальному при малых давлениях и высоких температурах.
Рассмотрим изменение состояния идеального газа в разных процессах. Так как элементарная работа расширения
δА = PdV,
то δQ = dU + PdV.
- Изотермический процесс (Т = const).
T = const  U = f (T) = const
U = f (T) = const  ∆U = 0.
∆U = 0.
I закон термодинамики: δQ = δA = PdV.
Интегрируем:  ;
;  ;
;
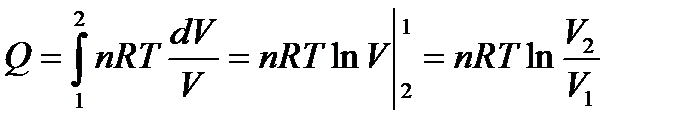

|

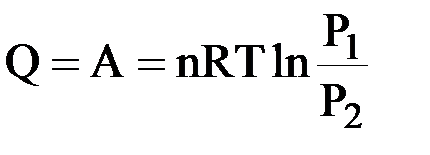
|
- Изохорный процесс (V = const).
Так как V = const, то dV = 0; δA = PdV = 0.
I закон термодинамики: δQV = dU.
Дифференцируем по температуре:  .
.
Для 1 моль идеального газа:
| δQV = dU = CVdT |
Интегрируем:  .
.
Для 1 моль идеального газа: QV = U2 – U1 = CV(T2 – T1);
Для n моль идеального газа:
| QV = nCV (T2 – T2) |
CV – мольная теплоемкость при постоянном объеме (то количество теплоты, которое необходимо сообщить идеальному газу, чтобы 1 моль его нагреть на 1°С при V = const).
СV зависит от температуры и в большом (сотни градусов) температурном интервале ее нельзя считать const.
Эмпирические температурные ряды теплоемкости:
СV = a + b T + c T2 + …
или
СV = a' + b' T + c' T2 + …,
где a, b, c, a', b', c' – эмпирические температурные коэффициенты.
Для большого температурного интервала:

|
3. Изобарный процесс (Р = const).
δQ = dU + PdV
• теплота в изобарном процессе.
Если Р = const, то вносим Р под знак дифференциала:
δQ = dU + d(PV) = d(U + PV),
| U + PV = H |
Тогда δQ = dH.
Из термодинамики нельзя определить абсолютное значение Н; можно определить только изменение энтальпии, т.к. выражение для «Н» содержит внутреннюю энергию. По этой же причине Н является функцией состояния системы, т.е. ее изменение не зависит от пути процесса:
δQP = dH 
|
Продифференцируем по температуре:
 - мольная теплоемкость при постоянном давлении.
- мольная теплоемкость при постоянном давлении.
| δQP = dH = CPdT |
Интегрируем: 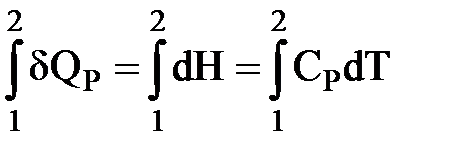 ,
,
| QP = (H2 – H1) = CP(T2 – T1) |
| QP = ∆H = nCP(T2 – T1) |
- для n моль идеального газа в небольшом температурном интервале.

|
- для n моль идеального газа в большом температурном интервале.
• Работа при Р = const:
| δA = PdV |
| A = P∆V |
 ;
;
- интегральная форма.
• Связь между СР и СV:
 Ó
Ó
| СP –CV = R |

|


- Адиабатический процесс (δQ = 0).
I закон термодинамики: 0 = δA + dU; δA = -dU = -nCVdT
| A = -∆U = nCV(T1 – T2) |
- для небольшого температурного интервала.

|
- для большого температурного интервала.
PV  const const
|
Уравнение адиабаты:
γ = СP/CV.
Лекция № 4.






