Цель работы: познакомиться с адиабатическим процессом, определить показатель адиабаты для воздуха.
Оборудование: баллон с клапаном, компрессор, манометр.
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Адиабатический процесс – это процесс, протекающий в термодинамической системе без теплообмена с окружающей средой. Термодинамической системой является система, содержащая огромное количество частиц. Например, газ, число молекул которого сравнимо с числом Авагадро 6,02∙1023 1/моль. Хотя движение каждой частицы подчиняется законам Ньютона, но их так много, что решить систему уравнения динамики для определения параметров системы невозможно. Поэтому состояние системы характеризуют термодинамическими параметрами, такими как давление P, объем V, температура T.
Согласно первому началу термодинамики, являющемуся законом сохранения энергии в термодинамических процессах, теплота Q, подводимая к системе, расходуется на совершение работы А и на изменение внутренней энергии Δ U
Q = A + D U. (1)
Теплота – это количество энергии хаотического движения, передаваемое термодинамической системе. Подвод теплоты приводит к повышению температуры:  , где n – количество газа, С − молярная теплоемкость, зависящая от вида процесса. Внутренняя энергия идеального газа − это кинетическая энергия молекул. Она пропорциональна температуре:
, где n – количество газа, С − молярная теплоемкость, зависящая от вида процесса. Внутренняя энергия идеального газа − это кинетическая энергия молекул. Она пропорциональна температуре:  , где Cv – молярная теплоемкость при изохорическом нагревании. Работа элементарного изменения объема силами давления равна произведению давления на изменение объема: dA = PdV.
, где Cv – молярная теплоемкость при изохорическом нагревании. Работа элементарного изменения объема силами давления равна произведению давления на изменение объема: dA = PdV.
Для адиабатического процесса, происходящего без теплообмена (Q = 0), работа совершается за счет изменения внутренней энергии, A = − D U. При адиабатическом расширении работа газа положительна, поэтому внутренняя энергия и температура понижаются. При сжатии – наоборот. Все быстро протекающие процессы можно достаточно точно считать адиабатическими.
Выведем уравнениеадиабатического процесса идеального газа. Для этого применим уравнение первого начала термодинамики для элементарного адиабатического процесса dA= − dU, котороепринимает вид РdV =−n СvdT. Добавим к этому дифференциальному уравнению еще одно, полученное дифференцированием уравнения Менделеева–Клапейрона (PV=νRT): PdV +VdP =nR dT. Исключая в двух уравнениях один из параметров, например, температуру, получим соотношение для двух других параметров  . Интегрируя и потенцируя, получим уравнение адиабаты через давление и объем:
. Интегрируя и потенцируя, получим уравнение адиабаты через давление и объем:
P V g = const.
Аналогично:
T V g -1 = const, P g -1 T--g = const. (2)
Здесь 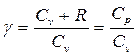 – показатель адиабаты, равный отношению теплоемкостей газа при изобарическом и изохорическом нагревании.
– показатель адиабаты, равный отношению теплоемкостей газа при изобарическом и изохорическом нагревании.
Получим формулу для показателя адиабаты в молекулярно-кинетической теории. Молярная теплоемкость по определению это количество теплоты, необходимое для нагревания одного моля вещества на один Кельвин  . При изохорическом нагревании теплота расходуется только на повышение внутренней энергии
. При изохорическом нагревании теплота расходуется только на повышение внутренней энергии 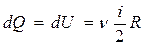 . Подставив теплоту, получим
. Подставив теплоту, получим 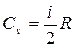 .
.
Приизобарическом нагревании газа в условиях постоянного давления дополнительно часть теплоты расходуется на работу изменения объема 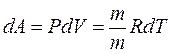 . Поэтому количество теплоты, (dQ = dU + dA) полученное при изобарическом нагревании на один Кельвин будет равно
. Поэтому количество теплоты, (dQ = dU + dA) полученное при изобарическом нагревании на один Кельвин будет равно  . Подставив в формулу теплоемкости, получим
. Подставив в формулу теплоемкости, получим 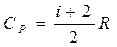 .
.
Тогда показатель адиабаты может быть определен теоретически по формуле
 . (3)
. (3)
Здесь i – число степеней свободы молекул газа. Это число координат, достаточное для определения положения молекулы в пространстве или число составляющих компонентов энергии молекулы. Например, для одноатомной молекулы кинетическая энергия может быть представлена как сумма трех компонентов энергии, соответствующих движению вдоль трех осей координат, i = 3. Для жесткой двухатомной молекулы следует добавить еще два компонента энергии вращательного движения, так как энергия вращения относительно третьей оси, проходящей через атомы, отсутствует. Итак, для двухатомных молекул i = 5. Для воздуха как для двухатомного газа теоретическое значение показателя адиабаты будет равно g = 1,4.
Показатель адиабаты можно определить экспериментально методом Клемана – Дезорма. В баллон нагнетают воздух, сжимая до некоторого давления Р 1 , немного больше атмосферного. При сжатии воздух несколько нагревается. После установления теплового равновесия баллон на короткое время открывают. В этом процессе расширения 1–2 давление падает до атмосферного Р 2 =Ратм, а исследуемая масса газа, которая до этого занимала часть объема баллона V 1, расширяется, занимая весь баллон V 2 (рис.1). Процесс расширения воздуха (1−2) происходит быстро, его можно считать адиабатическим, происходящим по уравнению (2)
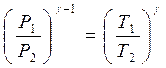 . (4)
. (4)
В адиабатическом процессе расширения воздух охлаждается. После закрытия клапана охлажденный воздух в баллоне через стенки баллона нагревается до температуры лаборатории Т 3 = Т 1. Это изохорический процесс 2–3
 . (5)
. (5)
Решая совместно уравнения (4) и (5), исключая температуры, получим уравнение,  , из которого следует определить показатель адиабаты γ. Датчик давления измеряет не абсолютное давление, которое записано в уравнениях процессов, а избыточное над атмосферным давлением. То есть Р 1 = Δ Р 1+ Р 2, и Р 3 =Δ Р 3+ Р 2. Переходя к избыточным давлениям, получим
, из которого следует определить показатель адиабаты γ. Датчик давления измеряет не абсолютное давление, которое записано в уравнениях процессов, а избыточное над атмосферным давлением. То есть Р 1 = Δ Р 1+ Р 2, и Р 3 =Δ Р 3+ Р 2. Переходя к избыточным давлениям, получим  . Избыточные давления невелики по сравнению с атмосферным давлением Р 2. Разложим члены уравнения в ряд по соотношению
. Избыточные давления невелики по сравнению с атмосферным давлением Р 2. Разложим члены уравнения в ряд по соотношению  . После сокращения на Р 2 получим для показателя адиабаты расчетную формулу
. После сокращения на Р 2 получим для показателя адиабаты расчетную формулу

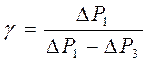 . (6)
. (6)
Лабораторнаяустановка (рис. 2) состоит из стеклянного баллона, который сообщается с атмосферой через клапан Атмосфера. Воздух накачивается в баллон компрессором при открытом кране К. После накачивания, во избежание утечки воздуха, кран закрывают.
ВЫПОЛНЕНИЕ РАБОТЫ
1. Включить установку в сеть 220 В.
Открыть кран баллона. Включить компрессор, накачать воздух до избыточного давления в диапазоне 4 –11 кПа. Закрыть кран баллона. Выждать 1,5 –2 мин, записать величину давления Δ Р 1 в таблицу.
2. Повернуть клапан Атмосфера до щелчка, клапан откроется и захлопнется. Произойдет адиабатический сброс воздуха с понижением температуры. Следить за повышением давления в баллоне по мере нагрева. Измерить наивысшее давление Δ Р 3 после установления теплового равновесия. Результат записать в таблицу.
Повторить опыт не менее пяти раз, изменяя исходное давление в диапазоне 4–11 кПа.
| Δ Р 1, кПа | |||||
| Δ Р 3, кПа | |||||
| γ |
Выключить установку.
3. Произвести расчеты. Определить показатель адиабаты в каждом опыте по формуле (6). Записать в таблицу. Определить среднее значение показателя адиабаты < γ >
4. Оценить случайную погрешность измерения по формуле для прямых измерений
 . (7)
. (7)
5. Записать результат в виде g = < g > ± dg. Р = 0,9. Сравнить результат с теоретическим значением показателя адиабаты двухатомного газа g теор = 1,4.
Сделать выводы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте определение адиабатического процесса. Запишите первое начало термодинамики для адиабатического процесса. Объясните изменение температуры газа при адиабатических процессах сжатия и расширения.
2. Выведите уравнение адиабатического процесса для параметров давление – объем.
3. Выведите уравнение адиабатического процесса для параметров давление – температура.
4. Дайте определение числа степеней свободы молекул. Как зависит внутренняя энергия идеального газа от вида молекул?
5. Как осуществляются процессы с воздухом в цикле Клемана – Дезорма, как изменяются давления и температуры в процессах?
6. Выведите расчетную формулу для экспериментального определения показателя адиабаты.




