Функции:
ü сохранение крови в жидком состоянии;
ü препятствует распространению тромба местом повреждения сосуда, т. е направлена на сохранение свертываемости крови во времени и пространстве.
Во времени
Данная система ограничивает время существования активных фелков-ативаторов и обеспечивается антикоагулянтной системой (системой протеина С).
Системой протеина активируется тромбином (в поврежденном сосуде тромбин активирует свертывание, а в неповрежденном - тормозит свертывание).
Тромбин синтезирует образование двух мембранных комплексов на эндотелии неповрежденных сосудов. На поверхности мембран их эндотелия находится белок тромбомодулин, являющийся рецептором тромбина.
Тромбомодулин - интегральный белок цитоплазматической мембраны, обнаруживается только в эндотелиальных клетках.
Тромбин соединяется с мембраной неповрежденных клеток и образует комплекс (первый), который состоит из тромбомодулина (Тм), тромбина (Т) и Са2+.
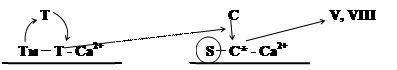 Второй мембранный комплекс включает в себя протеин С и его активатор - белок S, и Са2+.
Второй мембранный комплекс включает в себя протеин С и его активатор - белок S, и Са2+.
Протеин С - профермент, содержит остатки глутаминовой кислоты, активируется частичным протеолизом под действие первого мембранного комплекса.
Под действием тромбина протеин С (циркулирующий в крови) присоединяется к неповрежденным мембранам и в присутствии белка S активируется и расщепляет (инактивирует) V и VIII факторы, которые являются белками-активаторами ферментов.
В пространстве
Ограничение распространения тромба местом повреждения сосуда.
Осуществляется путем ингибирования факторов свертывания крови, которые являются ферментами.
Ингибиторы:
1) Антитромбин III (основной)
Составляет 80-90% от общего числа подобных веществ.
Активатор - гепарин.
Связывает факторы-ферменты (II, IX, X, XII) и снижает их активность.
Также активирует урокиназу, плазмин, калликреин.
Но не инактивирует сериновые протеазы.
Действует только на ферменты, циркулирующие в крови.
Но не действует на ферменты, находящиеся в составе мембранных комплексов.
Дефект антитромбина III приводит к тромбозам и эмболии сосудов.
2) Антиконвертин
Ингибитор ферментов внешнего пути свертывания крови.
Связывается с тканевым фактором, в результате чего не происходит активация инициирующего комплекса. Поэтому антиконвертин называют также ингибитором тканевого фактора.
3) α-макроглобулин
Взаимодействует с активными сериновыми протеазами и подавляет их протеолитическую активность.
4) Оксалат, ЭДТА
Связывают ионы кальция.
5) Природные антикоагулянты
Расщепляют ферменты, участвуют в свертывании крови.
Например, гегрудин, находящийся в слюне пиявки.
Кроме этого, с недостатком функционирования факторов (VII, IX, XI) связано заболевание - гемофилия.
С недостатком функционирования печени в синтезе факторов или присутствием антивитамина К связаны многие заболевания.
ТЕМА 12
СОЕДИНИТЕЛЬНАЯ ТКАНЬ
Соединительные ткани - ткани, у которых мало клеток и много межклеточного вещества = межклеточного матрикса.
Они составляют около 50% всех тканей.
Клетки:
· фибробласты
· остеобласты
· хондробласты
· и т.д.
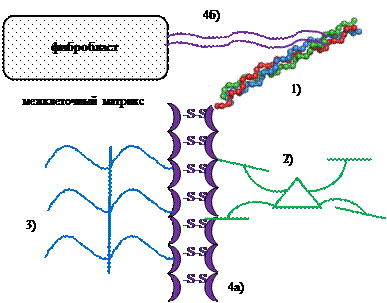 Межклеточный матрикс (состоит из четырех компонентов):
Межклеточный матрикс (состоит из четырех компонентов):
1) коллагеновые волокна
Коллаген - основной белок соединительной ткани (КГБ - коллагеновый белок)
Функция:
ü придание нерастяжимости
ü прочность на разрыв
2) эластин
Функция:
ü эластичность ткани
ü растяжимость
3) протеогликаны (ПГ) и гликозаминогликаны (ГАГ)
Функция:
ü рессорная (амортизационная)
ü защитная
4) неколлагеновые белки гликопротеиновой природы (НКБ)
а) фибронектин - адгезивный белок - соединяет компоненты межклеточного маткрикса
б) интегрин - рецепторный белок - соединяет клетки с компонентами межклеточного матрикса
Функции межклеточного матрикса:
ü участвует в пролиферации и дифференциации клеток
ü соединяет клетки между собой в растяжимых органахα
ü образует "каркас" органов
ü придает тканям прочность.
Коллаген
30% от всех белков организма.
Существует 19 типов коллагена в зависимости от тканей:
· I - связки, сухожилия, кости, зубы, кожа
· II - хрящевая ткань
· III - сосуды. кожа эмбриона
· IV - базальная мембрана
· и т.д.
 Коллагеновое волокно состоит из фибрилл. Фибрилла - из микрофибрилл. Микрофибрилла - из тропоколлагенов, которые соединены друг за другом на расстоянии 34 нм, а в соседних участках смещены на 1/4. Это придает коллагеновому волокну прочность на разрыв.
Коллагеновое волокно состоит из фибрилл. Фибрилла - из микрофибрилл. Микрофибрилла - из тропоколлагенов, которые соединены друг за другом на расстоянии 34 нм, а в соседних участках смещены на 1/4. Это придает коллагеновому волокну прочность на разрыв.
Тропоколлаген состоит из трех ппц - α1 и α2 четырех типов. Каждая цепь закручена влево, а потом между собой закручена в правую суперспираль. Это придает нерастяжимость.

 Следовательно, тропоколлаген - структурная единица коллагенового волокна.
Следовательно, тропоколлаген - структурная единица коллагенового волокна.
Состав коллагенового волокна:
а) каждая третья аминокислота - глицин (т.к. только ее маленький радикал может поместиться внутри тройной спирали);
б) содержит гидроксипролин (ПроОН) - образует водородные связи внутри спирали, стабилизируя ее;
в) гидроксилизин - участвует в образовании прочной ковалентной связи между отдельными тропоколлагенами → дополнительная прочность и нерастяжимость.
Биосинтез коллагена
Осуществляется в основном фибробластами. Проходит в 4 этапа:
1) синтез препро-α-цепей
2) внутриклеточные модификации
3) секреция
4) внеклеточные модификации.
1) Синтез препро-α-цепей
1. На рибосомах синтезируются препро-α-цепи. Одновременно происходит гидроксилирование пролина и лизина. Ферменты: пролин- и лизингидроксилаза. Участвует Fе2+ и витамин С. При недостатке витамина С нарушается первый этап синтеза коллагена и, следовательно, нарушается структура соединительной ткани.
2. При помощи сигнального пептида (который отщепляется при этом) про-α-цепи попадают в эндоплазматический ретикулум.
2) Внутриклеточные модификации
3. Под действием ферментов гликозилтрансфераз к некоторым остаткам гидроксилизина присоединяются остатки глюкозы и глюкозы+галактозы.
При сахарном диабете, когда глюкоза не поступает в инсулинзависимые ткани, гликозилирование нарушается и, следовательно, нарушается синтез коллагена.
4. Под действием N-концевого пептида формируется тройная суперспираль протропоколлагена. При этом между гидроксилизинами образуются водородные связи, которые ее стабилизируют.
5. Протропоколлаген поступает в аппарат Гольджи, где упаковывается в секреторные гранулы.
3) Секреция
6. В межклеточном матриксе отщепляются N- и С-концевые пептиды. Образуется тропоколлаген.
4) Внеклеточные модификации
7. Под действием лизилоксидазы (витамин В6, Сu2+) между лизинами тропоколлагена соседних участков образуются прочные связи. Образовалась микрофибрилла → фибрилла → коллагеновое волокно.














Синтез коллагена повышается при заживлении ран, понижается с возрастом. Нарушение синтеза коллагена может быть связано с различными причинами (чаще генетическими) - коллагенозы.
Разрушение коллагена
Время полужизни - несколько недель.
Разрушается при помощи коллагеназ. Они используют Zn2+ и, следовательно, являются матриксными металлопротеазами (ММП). Они расщепляют тройную спираль.
Эластин
Эластин - белок соединительной ткани, который придает ей растяжимость.
Период жизни - 75 лет.
Эластин - основной структурный компонент волокон, которые содержатся в тканях, обладающих значительной эластичностью (кровеносные сосуды, связки, легкие).
Содержит около 800 аминокислотных остатков, из них примерно 70% - гидрофобные с небольшими радикалами (глицин, валин, аланин, лейцин, пролин); гидроксипролина мало; гидроксилизина нет. Также отсутствует цистеин, метионин, триптофан.
В состав эластина входит лейциннорлейцин (образован двумя остатками лейцина) и десмозин (4 остатка лейцина). Эти структуры связывают молекулы между собой.
Протеогликаны (ПГ) и гликозаминогликаны (ГАГ)
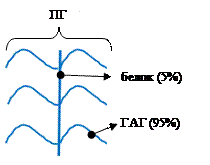 ПГ - основное вещество межклеточного матрикса, которое состоит из 5% белков и 95% углеводов.
ПГ - основное вещество межклеточного матрикса, которое состоит из 5% белков и 95% углеводов.
Углеводная часть = ГАГ = гетерополисахарид = мукополисахарид.
Функция:
ü ПГ (ГАГ) - полианионы (много отрицательных групп), которые связывают ионы натрия, задерживающие воду. Следовательно, ПГ поддерживают тургор тканей;
ü отрицательно заряженные группы ПГ и ГАГ противодействуют сжатию (они отталкиваются). Следовательно, выполняется рессорная функция в хрящах и суставах;
ü выполняют роль молекулярного сита, препятствую распространению микроорганизмов;
ü образуют фильтрационный барьер в почках (т.к. они отрицательно заржены, то препятствуют прохождению других отрицательно заряженных ионов).
Биосинтез протеогликанов
ПГ синтезируются на рибосомах ЭПР.
Сначала синтезируется белковая часть, и к ней по ОН-группе серина сначала присоединяется линкерный участок (инициирующий, затравка), который состоит из ксилозы-галактозы-галактозы.
К нему присоединяются по очереди моносахара (доноры моносахаридов - УДФ-производные (глюкоза_УДФ-глюкуронат)).
Одновременно происходит сульфатирование углеводов (присоединение серной кислоты).
По окончанию сульфатирования синтез прекращается.
Синтезированные ГАГ поступают в аппарат Гольджи, где упаковываются в секреторные гранулы и поступают в межклеточный матрикс.
ГАГ делятся на 5 групп:
1) особая - гиалуроновая кислота. Только она может находиться в несвязанном с белками состоянии (в свободном виде). Находится в стекловидном теле, суставной жидкости, пупочном канатике.
Линейный полисахарид, повторяется последовательность глюкуроновой кислоты с N-ацетилгликозамином.

2) хондроитинсульфат
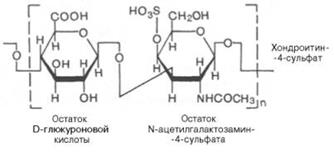
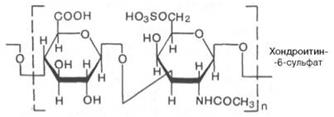
3) кератансульфат (находится в роговице)
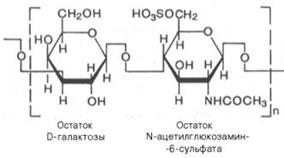
4) дерматансульфат (находится в коже)

5) гепарин (синтезируется в тучных клетках)

 Неколлагеновые белки гликопротеиновой природы (НКБ)
Неколлагеновые белки гликопротеиновой природы (НКБ)
Фибронектин - состоит из 2 ппц, соединенных фисульфидными связями. Каждая цепь состоит из 7-8 участков (домены). В каждом домене находится фермент трансглутаминаза, при помощи которой фибронектин связывает компоненты межклеточного матрикса.
Интегрин - состоит из 2 ппц (α и β), которые пронизывают мембрану клетки 1 раз.
Выполняют рецепторную функцию, передают информацию от межклеточного матрикса в клетки. Следовательно, выполняют адгезивную функцию, т.к. соединяют клетку с компонентами межклеточного матрикса.






