Белки – это высокомолекулярные соединения, состоящие из α-аминокислотных остатков, которые соединены между собой пептидными связями.
Пептидные связи расположены между α-карбоксильной группой одной аминокислоты и аминогруппой другой, следующей за ней, α-аминокислоты.
Функции белков (аминокислот):
1) пластическая (основная функция) – из аминокислот синтезируются белки мышц, тканей, гемм, карнитин, креатин, некоторые гормоны и ферменты;
2) энергетическая
а) в случае избыточного поступления в организм с пищей (>100 г)
б) при длительном голодании
Особенность:
Аминокислоты, в отличие от жиров и углеводов, не депонируются.
Количество свободных аминокислот в организме – около 35 г.
Общее содержание -15 кг.
Источники белка для организма:
· белки пищи (основной источник)
· белки тканей
· синтезированные из углеводов.
Азотистый баланс
Т.к. 95% всего азота организма принадлежит аминокислотам, то о их обмене можно судить по азотистому балансу – соотношение поступающего азота и выделенного с мочой.
ü Положительный – выделяется меньше, чем поступает (у детей, беременных, в период выздоровления после болезни);
ü Отрицательный – выделяется больше, чем поступает (пожилой возраст, период длительного заболевания);
ü Азотистое равновесие – у здоровых людей.
Т.к. белки пищи – основной источник аминокислот, то говорят о «полноценности белкового питания».
Все аминокислоты делятся на:
· заменимые (8) – Ала, Гли, Сер, Про, Глу, Глн, Асп, Асн;
· частично заменимые (2) – Арг, Гис (синтезируются медленно);
· условно заменимые (2) – Цис, Тир (могут синтезироваться при условии поступления незаменимых – Мет → Цис, Фен →Тир);
· незаменимые (8) – Вал, Иле, Лей, Лиз, Мет, Тре, Фен, Тпф.
В связи с этим выделяются белки:
ü Полноценные – содержат все незаменимые аминокислоты
ü Неполноценные – не содержат Мет и Тпф.
Переваривание белков
Особенности:
1) Белки перевариваются в желудке, тонком кишечнике
2) Ферменты – пептидазы (расщепляют пептидные связи):
а) экзопептидазы – по краям с C-N-концов
б) эндопептидазы – внутри белка
3) Ферменты желудка и поджелудочной железы вырабатываются в неактивном виде – проферменты (т.к. они бы переваривали собственные ткани)
4) Ферменты активируются частичным протеолизом (отщепление части ппц)
5) Некоторые аминокислоты подвергаются гниению в толстом кишечнике
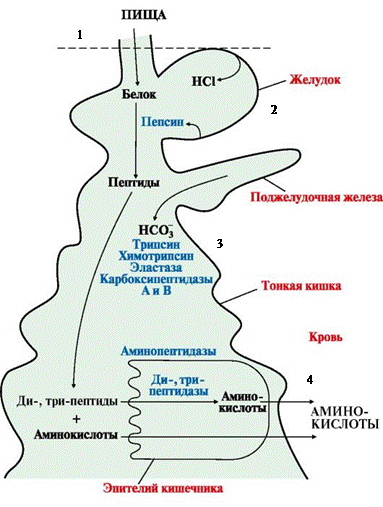 |
1. В ротовой полости не перевариваются.
2. В желудке на белки действует пепсин (эндопептидаза). Он расщепляет связи, образованные аминогруппами ароматических аминокислот (Тир, Фен, Тпф).

Пепсин вырабатывается главными клетками в виде неактивного пепсиногена.
Обкладочные клетки вырабатывают соляную кислоту.
Функции HCl:
ü Создает оптимум рН для пепсина (1,5 – 2,0)
ü Активирует пепсиноген
ü Денатурирует белки (облегчает действие фермента)
ü Бактерицидное действие
Активация пепсиногена
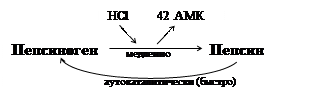 Пепсиноген под действием HCl превращается в активный пепсин путем отщепления 42 аминокислот медленно. Затем активный пепсин быстро активирует пепсиноген (аутокаталитически).
Пепсиноген под действием HCl превращается в активный пепсин путем отщепления 42 аминокислот медленно. Затем активный пепсин быстро активирует пепсиноген (аутокаталитически).
Таким образом, в желудке белки расщепляются на короткие пептиды, которые поступают в кишечник.
3. В кишечнике на пептиды действуют ферменты поджелудочной железы.
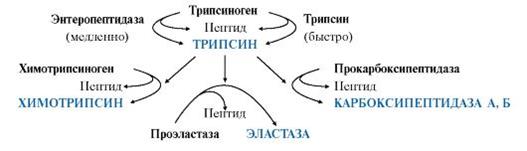
Активация трипсиногена, химотрипсиногена, проэластазы, прокарбоксипептидазы
В кишечнике под действием энтеропептидазы активируется трипсиноген. Затем активированный из него трипсин активирует все остальные ферменты путем частичного протеолиза (химотрипсиноген → химотрипсин, проэластаза → эластаза, прокарбоксипептидаза → карбоксипептидаза).
Трипсин расщепляет связи, образованные карбоксильными группами Лиз или Арг.
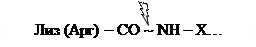
 Химотрипсин – между карбоксильными группами ароматических аминокислот.
Химотрипсин – между карбоксильными группами ароматических аминокислот.
Эластаза - связи, образованные карбоксильными группами Ала или Гли.
Карбоксипептидаза расщепляет карбоксильные связи с С-конца.
Таким образом, в кишечнике образуются короткие ди-, трипептиды.
4. Под действием ферментов кишечника они расщепляются до свободных аминокислот.
Ферменты – ди-, три-, аминопептидазы. Они не обладают видовой специфичностью.
Образовавшиеся свободные аминокислоты всасываются вторично активным транспортом с Na+ (против градиента концентрации).
5. Некоторые аминокислоты подвергаются гниению.
Гниение – ферментативный процесс расщепления аминокислот до малотоксичных продуктов с выделением газов (NH3, СН4, СО2, меркаптан).
Значение: для поддержания жизнедеятельности микрофлоры кишечника (при гниении Тир образует токсичные продукты фенол и крезол, Тпф – индол и скатол). Токсичные продукты поступают в печень и обезвреживаются.
Катаболизм аминокислот
Основной путь – дезаминирование – ферментативный процесс отщепления аминогруппы в виде аммиака и образования безазотистой кетокислоты.
· Окислительное дезаминирование
· Неокислительное (Сер, Тре)
· Внутримолекулярное (Гис)
· Гидролитическое
Окислительное дезаминирование (основное)
А) Прямое – только для Глу, т.к. для всех остальных ферменты неактивны.
Протекает в 2 стадии:
1) Ферментативное
2) Спонтанное
В итоге образуется аммиак и α-кетоглутарат.
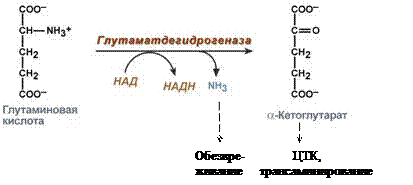 |
Б) Непрямое – для всех остальных аминокислот (16).
Цель – получить Глу.
Протекает через трансаминирование.
Трансаминирование – ферментативный перенос аминогруппы с аминокислоты на α-кетокислоту (почти всегда α-кетоглутарат).
В результате образуется Глу, которая идет на процесс дезаминирования, и какая-то другая кетокислота.
Ферменты – аланинаминотрансфераза (АЛТ), аспартатаминотрасфераза (АСТ).
Кофермент – пиридоксальфосфат ← вит. В6.
  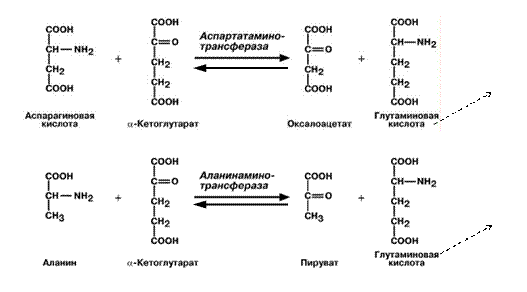 |
Функции трансаминирования:
ü Т.к. реакция обратимая, служит для синтеза заменимых аминокислот;
ü Начальный этап катаболизма (трансаминирование не является катаболизмом, т.к. количество аминокислот не меняется);
ü Для перераспределения азота в организме;
ü Участвует в малат-аспартатном челночном механизме переноса водорода в гликолизе (6 реакция).
Для определения активности АЛТ и АСТ в клинике для диагностики заболеваний сердца и печени измеряют коэффициент де Ритиса:
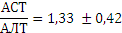
При 0,6 – гепатит,
1 – цирроз,
10 – инфаркт миокарда.
Декарбоксилирование аминокислот – ферментативный процесс отщепления карбоксильной группы в виде СО2 от аминокислот.
В результате образуются биологически активные вещества – биогенные амины.
Ферменты – декарбоксилазы.
Кофермент – пиридоксальфосфат ← вит. В6.
| Аминоксилота | Биогенный амин | Функция |
| Глу | ГАМК | Тормозной медиатор ЦНС |
| Тир | Дофамин; адреналин, норадреналин | |
| Гис | Гистамин | 1.Медиатор аллергических реакций. 2.Расширяет сосуды. 3.Активирует выработку HCl в желудке |
| Тпф | Ацетилхолин | Медиатор |
| Цис | Таурин | Образует парные ЖчК, участвует в эмульгировании жиров. |
После оказания действия биогенные амины обезвреживаются 2 путями:
1) Метилирование (добавление CH3; донор - SAM);
2) Окисление с отщеплением аминогруппы в виде NH3 (фермент MAO – моноаминоксидаза).
ТЕМА 9






