Тема 1. Уравнение состояния идеального газа.
Состояние системы задается термодинамическими параметрами – совокупностью физических величин, характеризующих свойства термодинамической системы, например, давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемая уравнением состояния.
Для идеального газа уравнением состояния является уравнение Клапейрона – Менделеева:
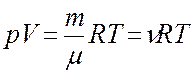 ,
,
где m – масса газа, 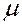 – молярная масса (масса одного моля вещества),
– молярная масса (масса одного моля вещества),
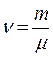 – количество вещества,
– количество вещества,
R – универсальная газовая постоянная, 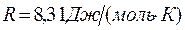 .
.
(Идеальным называется такой газ, в котором считается, что собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда, в котором он находится, силы взаимодействия между молекулами газа отсутствуют, а столкновения между молекулами газа абсолютно упругие.)
Исходя из уравнения Клапейрона – Менделеева и понятия концентрации n (n – число молекул в единице объема: 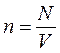 , где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
, где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
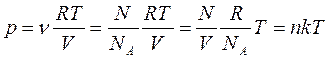 , то есть
, то есть 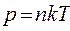 ,
,
где 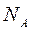 – постоянная Авогадро – число молекул в одном моле вещества,
– постоянная Авогадро – число молекул в одном моле вещества,
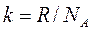 ,
, 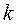 – постоянная Больцмана.
– постоянная Больцмана.
Тема 2. Термодинамические процессы. Изопроцессы.
Любое изменение в системе, связанное с изменением ее термодинамических параметров, называется термодинамическим процессом.
Из уравнения Клапейрона – Менделеева следует, что 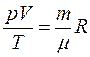 , то есть для данной массы газа
, то есть для данной массы газа  в любом термодинамическом процессе, что является объединенным газовым законом.
в любом термодинамическом процессе, что является объединенным газовым законом.
Если в термодинамическом процессе один из параметров газа (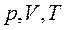 ) не изменяется, то такой процесс называется изопроцессом.
) не изменяется, то такой процесс называется изопроцессом.
Процесс, протекающий при постоянном давлении, называется изобарным. Из объединенного газового закона для изобарного процесса следует:
 (уравнение изобарного процесса).
(уравнение изобарного процесса).
Процесс, протекающий при постоянном объеме, называется изохорным. Из объединенного газового закона для изохорного процесса следует:
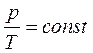 (уравнение изохорного процесса).
(уравнение изохорного процесса).
Процесс, протекающий при постоянной температуре, называется изотермическим. Для изотермического процесса:
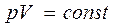 (уравнение изотермического процесса).
(уравнение изотермического процесса).
Тема 3. Основное уравнение молекулярно-кинетической теории
Идеального газа.
Основное уравнение молекулярно-кинетической теории идеального газа связывает термодинамические параметры газа с параметрами, характеризующими движение его молекул. Так, давление газа, как следствие соударений молекул газа со стенками сосуда, определяется, согласно основному уравнению молекулярно-кинетической теории идеального газа, кинетической энергией поступательного движения молекул газа.
 При выводе основного уравнения молекулярно-кинетической теории идеального газа полагают, что соударения молекул газа со стенками сосуда являются абсолютно упругими. Тогда, при соударении одна молекула газа массой m 0, движущаяся перпендикулярно стенке сосуда со скоростью
При выводе основного уравнения молекулярно-кинетической теории идеального газа полагают, что соударения молекул газа со стенками сосуда являются абсолютно упругими. Тогда, при соударении одна молекула газа массой m 0, движущаяся перпендикулярно стенке сосуда со скоростью  , передает ей импульс
, передает ей импульс 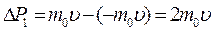 .
.
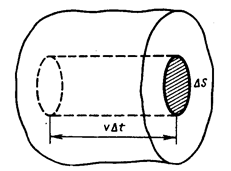
Выделив на стенке сосуда элементарную площадку D S (рис. 1), определяют давление газа p на эту площадку. Построив цилиндр с основанием D S и высотой 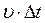 (рис. 1), учитывают, что число молекул, способных за время D t достигнуть площадки D S соответствует Рис. 1
(рис. 1), учитывают, что число молекул, способных за время D t достигнуть площадки D S соответствует Рис. 1
1/6 части всех N молекул, содержащихся в объеме выделенного цилиндра (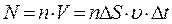 , где n – концентрация молекул). Коэффициент 1/6 учитывает, что из всех N молекул, движущихся хаотично вдоль трех (x, y, z) взаимно перпендикулярных направлений, только их 1/6 часть движется по направлению к площадке D S. Тогда число ударов молекул, движущихся в данном направлении, о площадку D S за время D t будет равно:
, где n – концентрация молекул). Коэффициент 1/6 учитывает, что из всех N молекул, движущихся хаотично вдоль трех (x, y, z) взаимно перпендикулярных направлений, только их 1/6 часть движется по направлению к площадке D S. Тогда число ударов молекул, движущихся в данном направлении, о площадку D S за время D t будет равно: 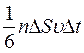 .
.
При столкновении с площадкой D S эти молекулы передадут ей импульс D P:
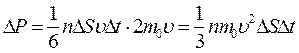 ,
,
что соответствует, согласно второму закону Ньютона, действию силы F:
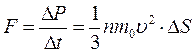 .
.
Тогда давление газа, оказываемое им на стенки сосуда:
 .
.
Однако, молекулы газа движутся с различными скоростями  ,
, 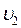 ,….
,…. 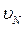 , что можно учесть в полученной формуле, введя понятие средней квадратичной скорости движения молекул
, что можно учесть в полученной формуле, введя понятие средней квадратичной скорости движения молекул  :
:
 , тогда
, тогда 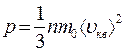 .
.
Так как 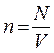 , а
, а 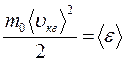 – средняя кинетическая энергия движения одноатомной молекулы, то получим:
– средняя кинетическая энергия движения одноатомной молекулы, то получим:
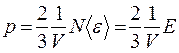 ,
,
где Е – суммарная кинетическая энергия всех молекул газа,  .
.
Таким образом, получены два эквивалентных уравнения:
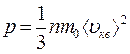 и
и 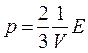 ,
,
связывающие кинематические параметры движения отдельных молекул газа с термодинамическими параметрами газа в целом, каждое из которых называют основным уравнением молекулярно-кинетической теории идеального газа.
Из сравнения между собой уравнений 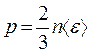 и
и 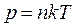 следует, что
следует, что
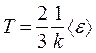 ,
,
то есть еще одно уравнение, связывающее термодинамический параметр газа (Т) со средней кинетической энергией молекулы одноатомного газа 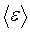 .
.
С другой стороны, величина средней кинетической энергии молекул газа 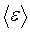 определяется температурой газа Т (для случая одноатомного газа):
определяется температурой газа Т (для случая одноатомного газа):
 .
.






