«адача 1. Ќапишите уравнени€ реакций образовани€ всех возможных кислых и основных солей: Fe(OH)3 + H3PO4 →
–ешение: ислые или основные соли образуютс€ при неполной нейтрализации многоосновной кислоты (кислые) или многокислотного основани€ (основные).
“рехосновна€ отрофосфорна€ кислота H3PO4 может образовать три вида солей: средн€€ соль - ортофосфаты, с кислотным основанием PO43-, и два вида кислых солей - дигидроортофосфаты - Ќ2PO4- и гидроортофосфаты- ЌPO42-.
“рехкислотное основание гидроксид железа (III) может образовать 4 вида солей: средн€€ соль Ц с катионом железа (III) Fe3+, и три вида основных солей Ц с катионом гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза (III) Fe(OH)2+. ¬озможно и образование смешанной соли с катионами гидрокосжелеза (III) Fe(OH)2+ и дигидроксожелеза(III).
“аким образом, теоретически можно предсказать, что могут быть образованы 2 вида кислых солей и 3 вида основных.
ƒл€ образовани€ кислых солей необходимо, чтобы основание было в избытке, то есть мольное отношение  . “о есть, возможны варианты
. “о есть, возможны варианты  ,
,  и
и  . ¬ соответствие с этим напишем эти три уравнени€.
. ¬ соответствие с этим напишем эти три уравнени€.
2Fe(OH)3 + H3PO4 → [ Fe(OH)  Fe(OH)2] PO4 + 3H2O
Fe(OH)2] PO4 + 3H2O
ортофосфатгидроксодигидроксожелеза (III)
3Fe(OH)3 + 2H3PO4 → [ Fe(OH)]3 (PO4)2 + 6H2O
ортофосфатгидроксожелеза (III)
3Fe(OH)3 + H3PO4 → [ Fe(OH)2]3 (PO4) + 3H2O
ортофосфатдигидроксожелеза (III)
ƒл€ образовани€ кислых солей необходимо, чтобы в реакционной среде кислота была в избытке. “о есть, возможны варианты  и
и  и
и  . ¬ соответствие с этим напишем эти три уравнени€.
. ¬ соответствие с этим напишем эти три уравнени€.
Fe(OH)3 + 2H3PO4 → Fe[HPO4  H2PO4] + 3H2O
H2PO4] + 3H2O
гидроортофосфатдигидроортофосфатжелеза (III)
2Fe(OH)3 + 3H3PO4 → Fe2 (ЌPO4)3 + 6H2O
ортофосфатгидроксожелеза (III)
Fe(OH)3 + 3H3PO4 → Fe (Ќ2PO4)3 + 6H2O
ортофосфатдигидроксожелеза (III)
≈сли студент затрудн€етс€ в определении структуры или брутто формулы образовавшейс€ соли, то можно прибегнуть к схематической формы решени€ задачи. –ассмотрим пример образовани€ гидроортофосфатдигидроортофосфатжелеза (III) взаимодействием одной моли Fe(OH)3 и двух молей H3PO4.
 H Ц O
H Ц O

 H Ц O Ц P=O H Ц O
H Ц O Ц P=O H Ц O


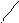
 O Ц H H Ц O O P=O
O Ц H H Ц O O P=O


 Fe Ц O Ц H + H Ц O → Fe Ц O + 3H2O
Fe Ц O Ц H + H Ц O → Fe Ц O + 3H2O

 O Ц H H Ц O Ц P=O ќ
O Ц H H Ц O Ц P=O ќ
 H Ц O H Ц O Ц P=O
H Ц O H Ц O Ц P=O
H Ц O
«адача 2. »ме€ в распор€жении только калий, воду, воздух и фосфор, получите максимальное число минеральных удобрений.
–ешение.
2 + 2Ќ2ќ → 2 ќЌ + Ќ2 
¬оздух →N2 (78%) + ќ2 (21%)
N2 + 3Ќ2  2NH3
2NH3 
N2+ O2  2NO2
2NO2
2NO + O2→ 2NO2
4NO2 + O2+ 2H2O → 4HNO3
HNO3+ NH3→ NH4NO3 (нитрат аммони€ или аммиачна€ селитра)
4– + 5ќ2 → 2–2ќ5
–2ќ5 + 3Ќ2ќ → 2Ќ3–ќ4
2Ќ3–ќ4 + 3NH3 → (NH4 )Ќ2–ќ4 + (NH4 )2Ќ–ќ4 (аммофос)
Ќ3–ќ4 + 3 ќЌ → 3Ќ2ќ + 3–ќ4 (ортофосфат кали€)
ќЌ + HNO3→ NO3 (нитрат кали€ или калийна€ селитра)
«адача 3. Ќа примере ортофосфата гидроксокальци€ покажите химизм последовательного перехода основной соли в кислую (дигидроортофосфата кальци€). Ќазовите все соли.
|
|
|
–ешение.
(—аќЌ)3–ќ4 + 2Ќ3–ќ4→ 6Ќ2ќ + —а3(–ќ4)2
ортофосфата гидроксокальци€ ортофосфата кальци€
—а3(–ќ4)2 + Ќ3–ќ4 → 3—аЌ–ќ4
гидроортофосфат кальци€
—аЌ–ќ4 + Ќ3–ќ4 → —а(Ќ2–ќ4)2
дигидроортофосфат кальци€
«адача 4. »меютс€ отдельные пробирки с растворами хлоридов алюмини€, аммони€, кальци€ и железа (II). ѕо каким признакам и химическими превращени€ми можно установить содержание каждой пробирки? ѕриведите уравнени€ химических реакций.
–ешение: ќтбираем некоторую часть от этих растворов и помещаем их в пронумерованные (1,2, 3 и 4) пробирки.
о всем 4 пробиркам по порци€м добавл€ем раствор гидроксида натри€. ¬ трех из этих пробирок постепенно, по мере добавлени€ гидроксида натри€, по€вл€етс€ осадок. ѕри этом, допустим в пробирке є1 осадок имеет зеленоватую окраску, котора€ при сто€нии буреет. —ледовательно, в этой пробирке находилс€ железа (II).
FeCl2 + 2NaOH → Fe(OH)2  + 2NaCl
+ 2NaCl
зеленый
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 
коричневый
¬ пробирке є2 выпал белый осадок, который в избытке щелочи не раствор€етс€. —ледовательно, в пробирке є2 находилс€ раствор хлорида кальци€. —аCl2 + 2NaOH → —а(OH)2  + 2NaCl
+ 2NaCl
белый
¬ пробирке є3 выпал белый осадок, который в избытке щелочи растворилс€. —ледовательно, в пробирке є3 находилс€ раствор хлорида алюмини€. AlCl3 + 3NaOH → Al(OH)3  + 3NaCl
+ 3NaCl
белый
Al(OH)3 + NaOH (изб.) → Na[Al(OH)4]
¬ пробирке є 4, где не выпал осадок, по методу исключени€, находилс€ хлорид аммони€. ƒл€ проверки, содержимое пробирки слегка нагреваем. ѕри этом по€вл€етс€ характерный запах аммиака, а мокра€ лакмусова€ индикаторна€ бумаг синеет от паров аммиака.
NH4Cl + NaOH→ NH4OH + NaCl
NH4OH  NH3
NH3  + H2O
+ H2O
ƒоказано, что в пробирке є4 находилс€ раствор хлорида аммони€.
«адача5. аким одним реактивом можно распознать кристаллические вещества сульфита натри€, сульфида натри€, нитрита натри€ карбоната кальци€ и карбоната натри€, наход€щиес€ в отдельных банках без этикеток? ѕриведите химизм процессов установлени€ химического состава этих веществ.
–ешение: Ѕерем пронумерованные пробирки (є1-5), и из банок с соответствующими номерами, отсыпаем несколько кристаллов вещества. ¬се пробирки до половины заполн€ем водой и во все пробирки медленно добавл€ем концентрированный раствор серной кислоты.
ƒопустим, что в пробирке є1, где находилась водна€ суспензи€ нерастворимого в воде вещества. ѕри добавлении серной кислоты наблюдаетс€ бурное выделение газа, осадок в начале раствор€етс€ и со временем, после прекращени€ выделени€ осадка, образуетс€ белый, мелкодисперсный осадок. Ёти наблюдени€ позвол€ют заключить, что в банке є1 находитс€ карбонат кальци€ (мел или известн€к).
—а—ќ3 + Ќ2SO4 → —а SO4 + [Ќ2—ќ3]*
[Ќ2—ќ3] → —ќ2  + Ќ2O
+ Ќ2O
* ¬ химии квадратными скобками изображают химически неустойчивые при обычных услови€х соединени€.
ƒопустим, в пробирке є 2 наблюдаетс€ выделение бесцветного газа, не обладающим характерным запахом. —ледовательно, в пробирке є2 находитс€ карбонат натри€.
Na2—ќ3 + Ќ2SO4 → Na2SO4 + Ќ2O + —ќ2 
ƒопустим, в пробирке є3 наблюдаетс€ выделени€ газа с характерным едким запахом, который на воздухе буреет. —ледовательно, в банке є3 находитс€ нитрит натри€.
2NaNO2+ Ќ2SO4 → Na2SO4 + [ЌNO2]
[ЌNO2] → NO  + Ќ2O
+ Ќ2O
2NO + O2 → 2NO2 
бурый газ
ƒопустим, в пробирке є 4 выдел€етс€ газ, с характерным непри€тным запахом тухлых €иц. ѕри этом раствор мутнеет и со временем выпадает желтый порошок.
|
|
|
Ќаблюдение показывают, что в банке є 4 находитс€ сульфид натри€.
Na2S + Ќ2SO4 → Na2SO4 + H2S 
запах тухлых €иц
3H2S+ Ќ2SO4→ 4Ќ2ќ + 4S 
желтый порошок
¬ последней пробирке наблюдаютс€ выделение газа c резким запахом горелых спичек. —ледовательно, в банке є5 находитс€ сульфит натри€.
Na2Sќ3 + Ќ2SO4 → Na2SO4 + [H2Sќ3]
[H2Sќ3] → SO2  + Ќ2ќ
+ Ќ2ќ
¬арианты задач по теме 1.1
1. ¬ыведите формулы кислот следующих ангидридов: (—Ќ3—ќ)2ќ; SO3; N2O5; –2ќ5; N2O3; –2ќ3; SO2; MnO3; Mn2O7; As2O5; As2O3; Cl2O3; Cl2O7. Ќазовите эти кислоты.
2. ¬ыведите формулы ангидридов, зна€ формулы следующих кислот: H2MoO4; H2Cr2O7; HNO3; HBO2; HMnO4.
3. —оставьте формулы средних и кислых бариевых солей следующих кислот: H2SO4; H2S; H3PO4; H2SO3; H2C2O4; H2Cr2O7. Ќазовите эти соли.
4. »зобразите графические формулы следующих солей: MgSO3; Ca(HCO3)2; Na2HPO4; (CuOH)2SO4; (CuOH)2CO3; KAl(SO4)2; KFe[Fe(CN)6]. Ќазовите эти соли.
5. ќпределите класс и назовите слои: Al(OH)Cl2; (CuOH)2CO3; Bi(OH)2NO3; ZnOHCl; Ca3(PO4)2; CaHPO4; Ca(H2PO4)2.
6. Ќазовите следующие соли железа и напишите их графические формулы: Fe2(SO4)3; FeOHCl; [Fe(OH)]2SO4; FeHPO4; FeOHSO4.
7. —оставьте формулы следующих солей: дигидрофосфат кальци€, гидрокарбонат кальци€, сульфат гидроксоальюмини€, сульфит бари€, сульфид бари€, гидросульфид бари€.
8. —оставьте формулы и назовите все соли которые могут быть образованы при взаимодействии гидроксида железа (III) с ортофосфорной кислотой.
9. —оставьте графические формулы следующих солей: Al2S3; AlOHCl2; Al(OH)2Cl; Al2(SO4)3; AlOHSO4; KAl(SO4)2.
10. Ќазовите следующие соли: Na2S; KClO3; CuS; FePO4; MgOHCl; Al4(P2O7)3; KH3P2O7; (MgOH)2CO3.
11. акие оксиды можно получить, разлага€ при нагревании следующие вещества: Fe(OH)3, Cr(OH)3, Pb(NO)3, H2SiO3, H2SO4, H3PO4, Ca(HCO3)2. Ќапишите уравнени€ реакций.
12. Ќапишите уравнени€ реакций образовани€ всех возможных кислых солей:
а) KOH + H2SO3 → б) Ca(OH)2 + H3PO4 →
в) KOH + H3PO4 → г) NaOH + H2S →
д) KOH + CO2 → е) Ba(OH)2 + H2SO4 →
13. Ќапишите уравнени€ реакций образовани€ всех возможных основных солей:
а) јl(OH)3 + HNO3 → б) Mg(OH)2 + HCl →
в) Cu(OH)2 +HNO3 → г) Bi(OH)3 + HNO3 →
д) Fe(OH)3+ H2SO4 → е) Al (OH)3 + H2SO4 →
14. Ќапишите реакции образовани€ всех солей, образовавшиес€ при взаимодействии гидроксида железа (III) c ортофосфорной кислотой. Ќазовите эти соли.
15. Ќапишите реакции образовани€ всех солей, образовавшиес€ при взаимодействии гидроксида железа (II) c ортофосфорной кислотой. Ќазовите эти соли.
16. Ќа примере сульфата дигидроксожелеза (III) покажите химизм последовательного перехода основной соли в кислую (гидросульфат железа III).
17. Ќа примере сульфата гидроксожелеза (II) покажите химизм последовательного перехода основной соли в кислую (гидросульфат железа II).
18. Ќа примере дигидроортофосфатажелеза(III) покажите химизм последовательного перехода кислой соли в основную (ортофосфат дигидроксожелеза III).
19. Ќа примере гидроортофосфатажелеза (II) покажите химизм последовательного перехода кислой соли в основную (ортофосфат гидроксожелеза II).
20. ѕереведите в средние следующие соли: гидрокарбонат натри€, хлорид годроксоцинка, нитрат дигидроксовисмута, гидрокарбонат кальци€, гидроскльфит магни€, гидросульфид бари€, гидросульфат кали€.
21. Ќапишите уравнени€ реакций дл€ следующих превращений: Zn → ZnSO4 Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3→ ZnO.
22. Ќапишите уравнени€ реакций дл€ следующих превращений:
Al → AlPO4 → [Al(OH)2]3PO4 →Al(OH)3 → Na[Al(OH)4] → [Al(OH)]3(PO4)2 → [Al(OH)2]3PO4 → Al(H2PO4)3 → Al2(HPO4)3 → AlPO4.
Ќазовите все указанные соли.
|
|
|
23. »сход€ из серы, кали€, воды и воздуха синтезируйте максимальное количество солей.
24. »ме€ в распор€жении только кальций, фосфор, воздух и воду синтезируйте максимальное количество минеральных удобрений.
25. ѕочему различный пор€док смешивани€ сульфата алюмини€ и гидроксида натри€ приводит к различным результатам?
26. аким одним реактивом можно распознать хлориды магни€, аммони€ и алюмини€, наход€щиес€ в разных пробирках?
27. ќсуществить превращени€:
а) NaCl → Na→ NaOH→ Na2CO3→ NaHCO3 → Na2CO3
б) CaCO3→ Ca(HCO3)2 CaCO3 → CaO → Ca(OH)2→ Ca(OCl)2
28. ќсуществить превращени€:
N2 → NH3 → NH4NO3 → NH4OH→ [Ag(NH3)2]Cl → AgCl → Ag
29. »меютс€ отдельные пробирки с растворами хлоридов аммони€, алюмини€, магни€, железа(II) и железа (III). ѕо каким признакам и химическими превращени€ми можно установить содержание каждой пробирки? ѕриведите уравнени€ химических реакций.
30. »меютс€ 4 банки кристаллических веществ: карбоната натри€, сульфида натри€, сульфита кали€ и сульфата аммони€. акими химическими превращени€ми можно определить содержание каждой банки?
ќсновные законы химии
—техиометрические законы






