ЛАБОРАТОРНА РОБОТА № 1
Тема: Мінеральні речовини.
Дослід 1.1. Якісне визначення мінеральних речовин
Принцип методу. До складу всіх клітин і тканин організму входять вуглець, кисень, водень і азот, які утворюють основну масу органічної речовини. Проте в організмі е також сірка, хлор, фосфор, натрій, калій, магній, залізо та інші елементи, які містяться в органічних і неорганічних сполуках. Для їх виявлення досліджувану тканину мінералізують спочатку до утворення вуглеподібного залишку, а потім до повного озолення.
Якісне визначення мінеральних речовин засноване на їх взаємодії з певними сполуками, продукти реакції яких можуть виявлятися у вигляді характерних осадів або забарвлених розчинів.
Матеріали та реактиви. М'язи, кров або молоко; 20 %-й розчин винної кислоти; 10 %-й розчин гідропіроантимонату калію; 5 %-й та 10 %-й розчини азотної кислоти; 2 %-й розчин азотнокислого срібла; 10 %-й розчин роданіду калію або амонію; 5 %-й розчин гексаціано-(П)-ферату калію; концентрований та 4 %-й розчини аміаку; 5 %-й розчин і льодяна оцтова кислота; 4 %-й розчин оксалату амонію [(NН4)2С2О4]; насичений розчин молібдату амонію; магнезіальна суміш - 10 г МgС12, 14 г NН4С1 та 25 мл NН4ОН розчиняють у 175 мл води; 1 %-й розчин пероксиду водню; 1 %-й розчин гваякола; 0,5 %-й розчин соляної кислоти; фільтри паперові.
Обладнання. Штатив із пробірками, піпетки, крапельниці, газовий пальник, фарфорова ступка.
Хід роботи. А. Досліджуваний матеріал (5 г) нагрівають у тиглі на полум'ї газового пальника до утворення вуглеподібної маси та припинення виділення диму. Після охолодження тигля утворену масу кілька разів екстрагують невеликими порціями гарячої води. Водні витяжки фільтрують через фільтрувальний папір. Фільтрат використовують для таких реакцій:
а) виявлення іонів К+ — до 0,5 мл фільтрату додають кілька краплин розчину винної кислоти; утворюється кислий виннокислий калій (білий кристалічний осад)
КС1 + С4Н6О6 ® С4Н5О6¯ + НС1;
б) виявлення іонів Na+ - до 0,5 мл водної витяжки мінералізату додають кілька краплин розчину гідропіроантимонату калію; при цьому утворюється білий кристалічний осад гідропіроантимонату натрію
2NаСI + К2Н2Sb2О7 + Nа2Н2Sb2O7 + 2КС1;
в) виявлення іонів С1- - до 0,5 мл фільтрату, підкисленого кількома краплинами 10 %-го розчину азотної кислоти, додають краплинами розчин азотнокислого срібла; при цьому утворюється білий осад хлориду срібла
НС1 + АgNOз ® АgСІ¯ + НNО3.
Б. Немінералізовану тканину, що залишилася на фільтрі після екстрагування водою, висушують і прокалюють у тиглі до повного озолення. Золу розчиняють у 5 мл розчину соляної кислоти; розчин фільтрують. У фільтраті виявляють фосфати кальцію та магнію, а також солі заліза (III). Фільтрат використовують для таких реакцій:
а) виявлення іонів Ре3+, І спосіб - до 0,5 мл солянокислого розчину золи додають кілька краплин розчину роданіду калію; при цьому утворюється роданід заліза (III), і виникає червоне забарвлення
FеСІ3 + 3КСNS ® Fе(СNS)з¯ + ЗКС1;
II спосіб - до 0,5 мл солянокислого розчину золи додають розчин жовтої кров'яної солі (К4[Fе(СN)6]) до появи синього забарвлення; утворюється гексаціано-(ІІ)-ферат заліза
4FеС1з + ЗК4[Fе(СN)6] ® Fе4[Fе(СN)6]3¯ + 12КС1;
б) виявлення іонів Мg2+, Са2+ та РО3 — зазначені іони утворюються під час нейтралізації 40 мл солянокислого розчину золи 4%-м розчином аміаку до появи ледь помітної каламуті, потім додають розчин оцтової кислоти до розчинення утвореної каламуті; із цього оцтовокислого розчину у вигляді осаду можна одержати кальцій, додаючи розчин оксалату амонію
СаС12 + (NH4)2С2О4® СаС2О4¯ + 2NН4С1;
осад оксалату кальцію СаС2О4 відфільтровують, і з фільтра, куди заздалегідь вносять концентрований аміак, осаджують магній у вигляді фосфорноамонійномагнієвої солі (білий кристалічний осад)
МgНРО4 + NН4ОН ® МgNН4РО4 ¯+ Н2О;
одержаний осад відфільтровують, до фільтрату додають магнезіальну суміш; при цьому осаджується фосфорна кислота
(NН4)2НРО4 + МgSО4 + NН3 ® МgNН4РО4 ¯ + (NН4)2SО4;
для виявлення фосфорної кислоти використовують обидва осади фосфорноамонійномагнієвої солі, їх злегка промивають водою й розчиняють на фільтрі в 20 мл 5 %-ї азотної кислоти. Утворений розчин нагрівають у 5 - 10 мл насиченого розчину молібдату амонію; при цьому випадає жовтий осад фосфорномолібденовокислого амонію:
Н3РО4 + 12(NН4)2МоО4 +21HNO3 ®
(NН4)3РО412МоО3¯ + 21NН4NОз + 12Н2О.
В. Виявлення іонів Сu2+. До 10 г досліджуваного матеріалу у фарфоровій ступці додають 1 мл розчину пероксиду водню та 2 мл льодяної оцтової кислоти, старанно гомогенізують і залишають на 10 хв. Потім додають 1 мл розчину роданіду калію або амонію та 1 мл розчину гваякола. За зміною забарвлення визначають наявність міді. Якщо суміш набуває синьо-зеленого кольору, це свідчить про наявність слідів міді, якщо інтенсивного синього - то мідь міститься в значній кількості.
Дослід 1.2. КІЛЬКІСНЕ ВИЗНАЧЕННЯ МІНЕРАЛЬНИХ РЕЧОВИН
1. Визначення хлоридів у сечі за методом Мора
Принцип методу. Хлориди осаджуються титрованим розчином азотнокислого срібла за наявності індикатора хромовокислого калію, який реагує з азотнокислим сріблом після осадження всього хлору сечі й утворює з сріблом осад оранжево-червоного кольору. Реакція відбувається за рівняннями:
NaCI + AgNO3®AgCI¯NaNO3;
2AgNO3+K2CrO4®Ag2CrO4¯+2KNO3
Кількість азотнокислого срібла, витраченого під час титрування на утворення осаду хлориду срібла, еквівалентна кількості хлору.
Матеріали та реактиви. Сеча; 5 %-й розчин хромовокислого калію; розчин азотнокислого срібла (0,1 моль/л).
Обладнання. Колби об'ємом 50 мл, піпетки, крапельниці, бюретки.
Хід роботи. В одну колбу (дослід) наливають 1 мл сечі, яка не повинна містити білків і вуглеводів, і 5 мл дистильованої води, у другу
(контроль) – 6 мл води. В обидві колби додають по три краплини розчину хромовокислого калію (індикатор) і титрують розчином азотнокислого срібла. Випадає білий осад хлориду срібла. Титрування продовжують до утворення оранжево-червоного осаду.
Зазначимо, що 1 мл розчину азотнокислого срібла (0,1 моль/л) відповідає
3,55 мл хлору або 5,85 мл хлориду натрію (молекулярна маса хлору дорівнює 35,5, а хлориду натрію — 58,5).
Кількість хлоридів (хлориду натрію), г, у 1 л сечі розраховують за формулою:
С= (А — В) ×f ×3,55(5,85) 1000/1000,
де А - В - різниця результатів титрування досліджуваного та контрольного зразків у 1 мл 0,1 моль/л розчину азотнокислого срібла; f - коефіцієнт поправки на 0,1 моль/л розчин азотнокислого срібла.
2.Визначення кальцію молока за методом де Ваарда
Принцип методу. Сполуки кальцію становлять близько 1/5 загальної кількості мінеральних речовин молока (в коров'ячому молоці— 140 %, молоці жінки, що годує немовля,— 34 %). У сироватці крові їх міститься 10 %.
Кальцій осаджується щавлевокислим амонієм. Утворений осад щавлевокислої солі розчиняють у сірчаній кислоті, при цьому вивільняється еквівалентна кількість щавлевої кислоти, яку відтитровують марганцевокислим калієм. Реакція відбувається у такій послідовності:
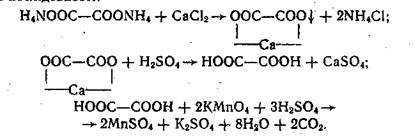
Кількість марганцевокислого калію, витраченого на титрування, еквівалентна вмісту кальцію в молоці.
Матеріали та реактиви. Розведене водою молоко (10: 1), 4 %-й розчин щавлевокислого амонію, 2 %-й розчин аміаку, 1 моль/л розчин сірчаної кислоти, 0,01 моль/л розчин марганцевокислого калію.
Обладнання. Центрифуга, водяна баня, пробірки, бюретки, піпетки, скляні палички.
Хід роботи. В одну центрифужну пробірку піпетками наливають 1 мл розведеного молока, у другу - 1 мл води. В обидві пробірки доливають по 0,5 мл розчину щавлевокислого амонію, перемішують скляною паличкою та залишають на ЗО хв, після чого центрифугують (10-15 хв за 600g). Прозору рідину над осадом обережно виливають, а в обидві пробірки з осадом додають по 4 мл розчину аміаку й знову центрифугують (10 хв за 600g). Після старанного видалення надосадової рідини до осадів обох пробірок додають по 1 мл розчину сірчаної кислоти. Скляними паличками вміст пробірок розмішують до повного розчинення осаду й ставлять на 5 хв (з паличками) на гарячу водяну баню. Гарячі розчини титрують розчином марганцевокислого калію, безперервно помішуючи паличками, до появи блідо-рожевого забарвлення, яке зберігається протягом 1 хв.
Зазначимо, що 1 мл 0,01 моль/л розчину КМпС>4 відповідає 0,2 мг кальцію. Кількість кальцію в молоці, %, обчислюють за формулою:
С = 0,2 (Л —В) 100/0,1,
де А-В - різниця результатів титрування досліджуваного та контрольного зразків у 1 мл 0,01 моль/л розчину КМпО4, 0,1 - вміст молока, мл, у 1 мл молочного розчину.
3. Визначення міді в сироватці крові за методом Шмідта.
Принцип методу. Під час взаємодії міді з комплексоутворювачем з'являється жовте забарвлення, інтенсивність якого пропорційна концентрації міді. Концентрація міді в сироватці крові людини становить 70-150 %
(15-25 мкмоль/л); вона входить в основному до складу церулоплазміну
(а2-глобуліни) й у невеликій кількості перебуває у вільному стані.
Матеріали та реактиви. Сироватка крові; 20 %-й розчин трихлороцтової кислоти; 4 %-й розчин пірофосфату натрію (На4?2О7); концентрований
(25 %-й) розчин аміаку; 1 %-й розчин диетилдітіокарбомату натрію.
Обладнання. Центрифуга, фотоелектроколориметр, колби об'ємом 50 мл, пробірки, піпетки.
Хід роботи. В одну центрифужну пробірку наливають 2 мл сироватки крові, в другу—2 мл дистильованої води (контроль). В обидві пробірки додають по 5 мл води, 3 мл розчину трихлороцтової кислоти, перемішують і через 10 хв центрифугують (30хв за 1000g). Одержану прозору надосадову рідину обережно деканту-ють. До 5 мл цієї рідини доливають 1 мл розчину пірофосфату натрію, 0,5 мл розчину аміаку; 1 мл розчину диетилдитіокарбомату натрію й струшують протягом 15-20 с. Такі ж реактиви додають і в контрольну пробірку.
Інтенсивність забарвлення визначають на фотоелектроколориметрі, використовуючи синій світлофільтр.
Вміст міді в сироватці крові, %, обчислюють за такою формулою:
С -Сдосл/^СТ»
де Eдосл — екстинкція досліджуваної проби; Ест — екстинкція стандартного розчину.
4. Визначення неорганічного фосфору м'язової тканини
Принцип методу. Метод заснований на здатності неорганічного фосфору, який можна виявити в безбілковому екстракті м'язової тканини, утворювати з розчином молібдату амонію в кислому середовищі амонійну сіль фосфорномолібденової кислоти - (МН4)зРО4- 12МоОз-6Н2О. Ця кислота внаслідок відновлення аскорбіновою кислотою, гідрохіноном тощо перетворюється на фос-форномолібденову синь, інтенсивність забарвлення якої пропорційна вмісту фосфору в досліджуваному матеріалі.
Матеріали та реактиви. М'язи; 10 %-й розчин трихлороцтової кислоти; 0,1 %-й розчин аскорбінової кислоти; розчин молібдату амонію (0,5 г чистого молібдату амонію розчиняють у 100 мл води, фільтрують, змішують із 100 мл 10 моль/л розчину сірчаної кислоти).
Обладнання. Центрифуга, фотоелектроколориметр, колби об'ємом 50 мл, фарфорова ступка, пробірки, піпетки, фільтри.
Хід роботи. Подрібнену на холоді м'язову тканину (2,5 г) розтирають у ступці з 10 мл розчину трихлороцтової кислоти. Утворену суспензію переносять у колбу, ополіскуючи ступку 20 мл розчину трихлороцтової кислоти й потім 10 мл води. Об'єм рідини, в колбі доливають водою до риски. Після старанного перемішування вміст колби центрифугують протягом 10 хв за 600g або фільтрують. У одну пробірку об'ємом 10 мл (досліджувана проба) наливають 2 мл фільтрату, у другу пробірку (контрольна проба) — 2 мл води. Потім у пробірки додають по 0,5 мл розчину молібдату амонію та по 1 мл розчину аскорбінової кислоти. Вміст пробірок добре перемішують і через 10 хв фотометрують із червоним світлофільтром.
Вміст неорганічного фосфору, мг, розраховують за такою формулою:
С = лс-50-ЮО/о-2-1000,
де х - концентрація фосфору в досліджуваному розчині, знайдена за калібрувальною кривою; 50 - об'єм суспензії тканини, мл; 2 - об'єм фільтрату, взятого для визначення, мл; а - наважка м'язів, г.
Вміст фосфору визначають за допомогою калібрувальної кривої. Для цього у мірні пробірки об'ємом 10 мл наливають по 2 мл стандартних розчинів, що містять 2-20 мкг фосфору, й додають усі потрібні для кольорової реакції реактиви. Одночасно готують контрольну пробу. Вміст пробірок перемішують і через 10 хв фотометрують. Потім будують калібрувальну криву.
На осі абсцис відкладають значення концентрації фосфору в стандартних розчинах і проводять прямі лінії паралельно осі ординат, а на осі ординат—відповідні значення екстракції щодо контролю й також проводять прямі лінії паралельно осі абсцис. Точку перетину проведених ліній сполучають. Утворюється калібрувальна крива. Для визначення вмісту фосфору в розчині невідомої концентрації знаходять його екстракцію й відкладають її значення на осі ординат. Потім проводять пряму лінію паралельно осі абсцис до перетину з калібрувальною кривою. З точки перетину проводять лінію, паралельну осі ординат. У точці перетину з віссю абсцис знаходять концентрацію фосфору, відповідну певній екстракції.
5. Визначення заліза в крові.
Принцип методу. Метод ґрунтується на здатності іонів заліза утворювати з роданистими солями сполуки, забарвлені в інтенсивно червоний колір. Реакція відбувається за рівнянням:
ЗШ4СН5 + РеСІз -*• Ре (€N5) 3 + ЗМН4С1.
Вміст заліза в організмі людини становить близько 3,5 г, з яких 2,5 г припадає на еритроцити. Кількість заліза в крові людини досягає 45—50 мг, причому головна більшість його входить до складу гемоглобіну.
Матеріали та реактиви. Кров; концентрована Н2ЗО4; 30 %-й розчин Н2О2; насичений розчин гШ4СК5; стандартний розчин тривалентного заліза: 0,248 г хімічно чистого Ре5О4-7Н2О розчиняють у невеликій кількості води, додають 10 мл концентрованої Н25О4 і по краплях 0,1 моль/л розчин КМпО4 до появи ледве помітного рожевого забарвлення, розчин переносять у мірну колбу об'ємом 1 л і доливають води до риски. Замість РеЗО4-7Н2О можна використати сіль Мора Ре(КН45О4)2-6Н2О (0,3516 г). Розчин готують за наведеною методикою. Обидва розчини містять по 0,05 мг заліза в 1 мл.
Обладнання. Фотоелектроколориметр, газовий пальник, колби об'ємом 25 мл, пробірки, піпетки.
Хід роботи. В пробірку вносять 0,1 мл крові, додають 0,5 мл концентрованої Н2ЗО4 і спалюють до появи білої пари сірчаної кислоти. Потім пробірку охолоджують, додають одну краплину розчину НгОг, знову спалюють до повного зникнення забарвлення розчину. Після охолодження розчин переносять у колбу об'ємом 25 мл, доливають до риски насичений розчин І^І^СМЗ, перемішують і через 10 хв колориметрують.
Одночасно з цим у другу колбу вносять 0,5 мл стандартного розчину заліза (0,025 мг), доливають до риски насичений розчин МН4СМ5, перемішують і через 10 хв використовують як стандарт.
Кількість заліза в 100 мл крові розраховують за формулою
С = 0,025£ст-10-100/£ж,
де ЕСІ — екстинкція стандартного розчину; £х — екстинкція досліджуваної проби; 0,025, 10, 100 — коефіцієнти.
ЛАБОРАТОРНА РОБОТА № 2
Тема: Якісні реакції моносахаридів.
Дослід 2.1. Загальна реакція на вуглеводи з α-нафтолом.
Принцип методу
Кольорову реакцію з α-нафтолом (Моліш, 1886 р.) дають всі вуглеводи, проте кетози - вільні або зв'язані в дисахаридах і полісахаридах - реагують більш інтенсивно. Поява забарвлення обумовлена розщепленням молекули вуглевода під дією концентрованої сірчаної кислоти з утворенням, в числі інших продуктів, фурфурола або його похідних, які вступають в реакцію конденсації з α-нафтолом, утворюючи забарвлені сполуки.
Забарвлений продукт гексози і α-нафтола має таку будову:


Матеріали. Вуглеводи (сахара, крохмаль, целюлоза); нафтол (10% розчин в спирті або хлороформі); концентрована сірчана кислота.
Хід роботи
Дослід проводять одночасно з кількома вуглеводами. Наливають в пробірку 0,5 мл води і вносять в неї невелику кількість досліджуваного вуглеводу. Потім додають 2 краплі розчину α-нафтолу. Після цього, нахиливши пробірку, обережно приливають по стінці 1-1,5 мл концентрованої сірчаної кислоти; важкий шар кислоти повинен опуститись на дно пробірки, не змішуючись з водним шаром. На кордоні шарів швидко утворюється червоно-фіолетове кільце; при збовтуванні суміш розігрівається і забарвлюється, а при розведенні її з водою виділяються забарвлені хлоп'я.
Якщо вуглеводів в суміші нема, фіолетове кільце не утворюється, але рідина може стати зеленою або жовтою.
Дослід 2.2. Якісна реакція на дезоксирибозу із дифеніламіном.
Принцип реакції
Під час нагрівання дезоксипентоз у кислому середовищі утворюється фурфуроловий спирт, оксилевулиновий альдегід і подібні хромогени, які, конденсуючись із дифеніламіном.утворюють забарвлені в синій колір сполуки.
Матеріали та реактиви. Розчин дезоксирибози 0,2%-й; 1%-й розчин дифеніламіну.
Обладнання. Скляні палички, пробірки хімічні, піпетки градуйовані, штатив для пробірок, водяна баня, годинник.
Хід роботи
В пробірку наливають 1 мл розчину дифеніламіну, перемішують і кип'ятять 10 хв. Спостерігають утворення сполук, забарвлених у синій колір.
Дослід 2.3. Якісна реакція на глюкозу з рідиною Фелінга.
Принцип реакції. В реактиві Фелінга іони міді (II) перебувають у вигляді комплексної сполуки з тартратами. Механізм реакції гексоз (у всіх редукуючих вуглеводів) із реактивом Фелінга такий же, як і в реакції Троммера. Перевагою реактива Фелінга є те, що мідь у разі надлишку реактиву не випадає у вигляді окису міді (II).

Матеріали та реактиви. Розчин глюкози (5 %-й), реактив Фелінга, який складається з двох розчинів. Для приготування першого розчину 200 г сегнетової солі та 150 г гідроксиду натрію розчиняють у дистильованій воді до об'єму 1 л. Для приготування другого розчину 40 г. перекристалізованого сульфату міді розчиняють у дистильованій воді до об'єму 1 л. Рівні об'єми першого та другого розчинів змішують перед роботою.
Обладнання. Скляні палички, пробірки, піпетки градуйовані, штатив для пробірок, пальник.
Хід роботи
В пробірку вносять 1 мл. розчину глюкози та 1 мл. реактиву Фелінга (суміші (по 0,5 мл.) першого та другого розчинів).Вміст пробірок перемішують і нагрівають у полум'ї пальника до кипіння. Спостерігають утворення червоного осаду геміоксиду міді.
Дослід 2.4. Дія лугів на моносахариди
Матеріали. Глюкоза, гідроксид натрія.
Хід роботи
В пробірку наливають 1-2 мл розчину глюкози, додають рівний об'єм 20-30 % розчину гідроксида натрія і обережно нагрівають до кипіння. Розчин жовтіє. При більш довгому нагріванні рідина набуває бурого кольору і потім осмолюється.
Дослід 2.5. Реакція Селіванова на фруктозу і буряковий цукор
Принцип реакції. Під час нагрівання фруктози та інших кетоз із соляною кислотою утворюється оксиметилфурфурол. Рівняння реакції за участю фруктози має такий вигляд:

Оксиметилфурфурол з резорцином утворюють сполуку (продукт конденсації), забарвлену у вишнево-червоний колір.
Матеріали та реактиви. Кристалічний резорцин, 2 %-й розчин фруктози, 20 %-й розчин соляної кислоти, глюкоза, сахароза.
Обладнання. Скляні палички, пробірки, піпетки градуйовані, штатив для пробірок, баня водяна, термометр лабораторний, лопаточка чи шпатель, годинник.
Хід роботи
В пробірку наливають по 3 мл розчинів досліджуваних сахарів, по 1 мл розчину соляної кислоти і декілька кристалів резорцину. Суміші нагрівають на водяній бані протягом 5-10 хв. до температури 80°С. В пробірці з фруктозою з'являється вишнево-червоне забарвлення. Розчини інших сахарів в цих умовах лише трохи жовтіють або рожевіють. Розчин глюкози, при нагріванні його до кипіння, забарвлюється в рожевий колір.
Дослід 2.6. Реакція Д-рибози (альдопентози) і Д-глюкози (альдогексози) з мінеральними кислотами. 
Принцип методу. Під дією концентрованих мінеральних кислот молекули вуглеводів поступово розщеплюються, утворюючи суміш продуктів: фурфурол і його похідні, левулінову і мурашину кислоти, а також гумінові речовини. Ці речовини забарвлені в темно-бурий або червоний колір, малорозчинні у воді і в умовах досліду виділяються на кордоні шарів рідин.
Кетози розщепляються кислотами швидше, ніж альдози. Дослід В можна використовувати для швидкої відміни фруктози від глюкози.
Матеріали. Сахара (глюкоза, фруктоза, D-рибоза, арабіноза, конц. НСІ, конц. H2SO4)
Хід роботи
А) В пробірці розчиняють декілька крупинок якого-небудь сахара в 1-2 мл води. До холодного розчину обережно, по стінці пробірки, приливають рівний об'єм концентрованої сірчаної кислоти. Сірчана кислота утворює нижній важкий шар під розчином сахара. На кордоні шарів поступово з'являється темно-буре кільце. Якщо при кімнатній температурі кільце не утворюється, злегка підігрівають вміст пробірки, не збовтуючи його.
Б) Невелику кількість глюкози кип'ятять 2-3 хв. з 2 мл концентрованої соляної кислоти. Потім розчин охолоджують і додають воду до 2/3 висоти пробірки. Повторюють цей же дослід, замінивши глюкозу фруктозою. Відмічають різку відмінність зовнішнього виду двох одержаних розчинів.
В) Невелику кількість альдопентози кип'ятять з 2-3 мл концентрованої соляної кислоти. При цьому відбувається дегідратація альдопентози і перехід її в фурфурол.
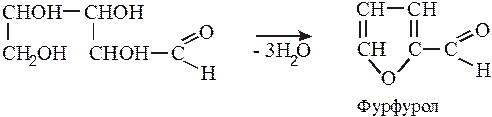
Фурфурол виявляють за допомогою додавання до продуктів реакції декілька крапель аніліну і оцтової кислоти.
Питання і вправи до лабораторної роботи
1. В чому полягає хімічна суть реакції вуглеводів з α-нафтолом?
2. Чому при взаємодії дезоксипентоз з дифеніламіном розчин забарвлюється?
3. Що являє собою реактив Фелінга?
4. При роботі з реактивом Фелінга перший і другий розчин змішують безпосередньо перед роботою. Чому це не можна робити заздалегідь?
5. В чому перевага метода визначення вуглеводів реактивом Фелінга над реакцією Троммера?
6. Яка реакція протікає при нагріванні альдоз і кетоз з мінеральними кислотами?
7. Яка роль резорцину при проведенні реакції вуглеводів з НСl?
Питання і вправи до теоретичної частини
1. Як класифікуються вуглеводи? В чому різниця між альдозами і кетозами? Наведіть рівняння реакцій, за допомогою яких можна довести будову моносахаридів?
2. В чому причина оптичної діяльності вуглеводів? Як визначити кількість стереоізомерів?
3. В чому різниця між формулами Фішера і Хеуорса? Наведіть приклади.
4. В чому полягає явище мутаротації?
5. Наведіть структурні формули D-рибози, D-арабінози, D-глюкози, D - маннози, D-ксилози, L-галактози, L-фруктози та схеми реакцій окиснення та відновлення їх.
6. Наведіть структурні формули найбільш важливих для біологічної системи дезоксівуглеводів в яких об’єктах вони сконцентровані.
ЛАБОРАТОРНА РОБОТА № 3
Тема: Кількісне визначення моносахаридів.
Дослід 3.1. Кількісне визначення фруктози.
Принцип методу
Визначення фруктози грунтується на реакції Селіванова. Швидкість утворення оксиметилфурфуролу в реакції фруктози з соляною кислотою під час нагрівання набагато більша, ніж у реакції за участю альдогексоз, що зумовлює специфічність реакції Селіва нова для фруктози.
Значення екстинкції розчину, який містить продукт конденсації, утвореного з фруктози оксиметилфурфуролу з резорцином, визначають калориметрично. Для кількісного визначення вмісту фруктози готують стандартний розчин фруктози (контроль).
Матеріали та реактиви. Досліджуваний розчин фруктози (10-100 мкг/мл), стандартний розчин фруктози (25 мкг/мл), 0,1 %-й розчин резорцину в 96 % -му етиловому спирті, 30 %-й розчин соляної кислоти.
Обладнання. Скляні палички, пробірки з пришліфованим повітряним зворотним холодильником, піпетки градуйовані, штатив для пробірок, водяна баня, годинник, термометр лабораторний, фотоелектрокалориметр.
Хід роботи
В одну пробірку з пришліфованим зворотним холодильником вносять 2 мл досліджуваного розчину фруктози (проба), в іншу - 2 мл стандартного розчину фруктози (контроль). Потім у обидві пробірки додають по 2 мл розчину резорцину й по 6 мл розчину соляної кислоти. Вміст пробірок перемішують і нагрівають на водяній бані протягом 10 хв. за температури 80°С Після нагрівання розчини охолоджують і калориметрують за 490 нм. Екстинкцію вимірюють проти розчину, що містить реактиви, використовуючи 2 мл дистильованої води замість розчину фруктози.
Масову концентрацію фруктози в досліджуваній пробі, мкг/мл, розраховують за формулою
С = С0Е1/Е2·V,
де Е1/Е2 - екстинкція досліджуваного та стандартного розчинів;
С0 - масова концентрація фруктози в стандартній пробі (25 мкг/мл) V - об'єм досліджуваного розчину (2 мл).
Цим методом можна визначити також масову концентрацію фосфорних ефірів фруктози – фруктозо - 1,6 - дифосфату та фруктозо - 6 - фосфату. Хід роботи такий же, як і під час визначення концентрації фруктози, але для розрахунку концентрації фруктозо - 1,6 - дифосфату знайдене значення вмісту фруктози слід помножити на 3,6, а фруктозо - 6 - фосфату − на 2,39. Ці поправки вводяться з урахуванням того, що в фруктозо - 1,6 - дифосфаті й фруктозо - 6 - фосфаті фруктоза становить 53 % і 60,5 %, а інтенсивність її кольорової реакції - 52,3 % і 69,2 %.
Дослід 3.2. Визначення вмісту вуглеводів методом ПХ. Метод розподільчої (радіальної) хроматографії на папері.
Принцип методу.
Метод розподільчої хроматографії на папері для розділення вуглеводів грунтується на відмінності коефіцієнтів розподілу окремих вуглеводів між двома рідинами, що не змішуються. Хроматографічний папір, який використовується як інертний носій, може утримувати в порах велику кількість нерухомої рідкої фази.
Коефіцієнт розподілу Rf, який визначається як співвідношення відстаней, що пройшов вуглевод та рухома фаза від точки старту, є характерною величиною для кожного вуглеводу за певних умов дослідів (склад розчинника, температура, сорт хроматографічного паперу).
Положення вуглеводів на папері визначають за допомогою кольорової реакції з резорцином. На рожевому фоні фруктоза має червоне забарвлення; ксилоза і арабіноза - синє; рамноза - жовте; галактоза, глюкоза, манноза - сіре.
Матеріали та реактиви. Вуглеводи (фруктоза, ксилоза); хроматографічний папір; розчинник - суміш бутанолу, СНзСООН, Н2О (4:1:5), свіжовиготовлений резорциновий реактив (до 10 мл 1% розчину резорцина в етанолі додають 90 мл 2н НСl). Розчинник готують, змішуючи всі компоненти в ділильній лійці. Після відстоювання суміш ділиться на два шари, нижній зливають і відкидають. Якщо розчинник, що залишився мутнішає, до нього додають декілька крапель СНзООН до освітлення.
Обладнання: Ексикатор чи чашка Петрі, пульверизатор, мікропіпетки, сушильна шафа, олівець, лінійка, годинник.
Хід роботи
Хроматографічний папір вирізають у формі кола, діаметр якого дорівнює діаметру ексикатора (чи чашки Петрі). Простим олівцем коло поділяють на сегменти, в центрі роблять невеликий отвір (0,6 – 1 см), у який вставляють згорнутий у трубочку фільтрувальний папір (гніт). Змінюючи товщину та довжину гноту, зануреного в розчинник, регулюють швидкість поширення розчинника на хроматографічному папері. В кожному сегменті позначають точку нанесення вуглеводів. На один із сегментів за допомогою мікропіпетки наносять суміш вуглеводів, на інший - таку ж кількість вуглеводів - стандартів. Потім хроматографічний папір висушують на повітрі протягом 10 хв. У ексикатор (чи чашку Петрі) наливають розчинник у такому об'ємі, щоб гніт був занурений у розчинник.
Колову хроматограму розташовують в ексикаторі (чи між двома половинками чашки Петрі). Хроматограма діаметром 12 см утворюється через 1 год, діаметром 20 см - через 2 год. Після завершення розподілу (фронт розчинника дійшов до встановленої відмітки) хроматограму висушують і проявляють, обприскуючи резорциновим реактивом із пульверизатора та прогрівають у сушильній шафі 10 хв за температури 85 - 90° С.
Вуглеводи ідентифікують. За допомогою лінійки визначають відстані, пройдені розчинником та вуглеводом, і розраховують значення коефіцієнта розподілу:
Rf = х/у,
де Rf - коефіцієнт розподілу;
x - відстань, пройдена вуглеводом;
у - відстань, пройдена розчинником.
Питання і вправи
до підготовки студентами лабораторних робіт
1. Як кількісно визначити фруктозу в розчинах?
2. Які фізичні методи використовують для ідентифікації моносахаридів?
3. Для яких цілей використовують ПХ?
Питання і вправи до теоретичної частини
1. Які продукти окислення глюкози мають фізіологічне значення?
2. Які найважливіші фізико-хімічні властивості фруктози?
3. Які найважливіші похідні фруктози знаходяться в організмі людини?
4. Як широко фруктоза розповсюджена в природі?
5. Що являють собою аміноцукри та яка їх біологічна роль?
6. Наведіть приклад альдонової кислоти.
7. Як утворюється альдарова кислота?
ЛАБОРАТОРНА РОБОТА №4
Тема: Властивостідисахаридів.
Дослід 4.1. Доведення наявності гідроксильних груп у дисахаридах
/мальтоза, лактоза, сахароза/
Принцип реакції.
Утворення легкорозчинних, інтенсивно зафарбованих і не розкладених лугами комплексних алкоголятів міді при взаємодії розчинів сахарів з гідроксидом міді /ІІ/ доводить присутність в молекулах сахарів декількох гідроксильних груп, розташованих поруч.
Ці комплексні іони обумовлюють інтенсивний блакитний або фіолетовий колір розчину.

Матеріали та реактиви. Розчини мальтози 2%, лактози 2%, сахарози 2%, гідроксиду натрію 10%, сульфату міді 1%.
Хід роботи
В пробірки наливають по 2 мл розчинів мальтози, лактози, сахарози. Потім у кожну з них додають 1 мл 10 %-го розчину гідроксида натрію і по декілька крапель 15 %-го водного розчину сульфата міді. Вміст пробірок струшують. Гідроксид міді, що утворився розчиняється, розчин набуває блакитного забарвлення, в зв’язку з утворенням алкоголятів міді мальтози, лактози і сахарози.
Дослід 4.2. Відношення дисахаридів /сахарози, мальтози, лактози/ до фелінгової рідини
Принцип реакції. Лактоза і мальтоза мають редукуючі властивості. При нагріванні одне з оксидних кілець у молекулі розривається і утворюється альдегідна група, яка окислюється до карбоксильної групи, а фелінгова рідина відновлюється з утворенням оксиду міді /І/:
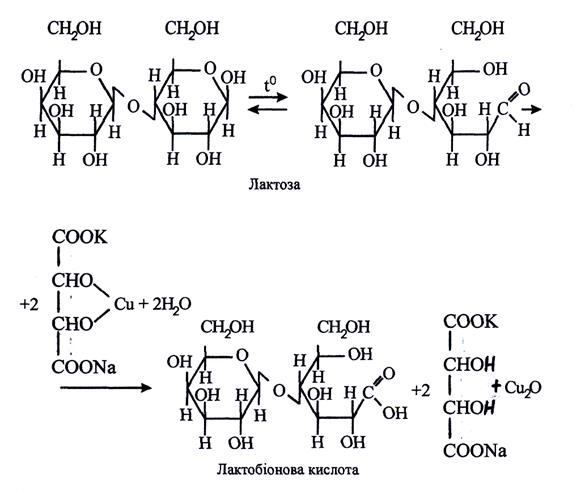
Також протікає реакція із мальтозою, яка в альдегідній формі вступає в реакцію за рахунок глікозидного гідроксила, що лишився.
У сахарозі зв'язок між залишками глюкози і фруктози утворений за рахунок двох глікозидних гідроксилів, тому вона не приймає участі в реакціях відновлення.
Матеріали та реактиви. Розчини сахарози, мальтози, лактози, фелінгова рідина.
Хід роботи
В три пробірки наливають по 1 мл фелінгової рідини. В одну додають 1 мл розчину сахарози, в другу - лактози і в третю - мальтози. Всі три пробірки нагрівають на киплячій водяній бані 1 - 2 хвилини. В пробірках з мальтозою і лактозою фелінгова рідина відновлюється з утворенням червоного осаду оксиду міді /І/. В пробірці з розчином бурякового цукру змін не відбувається, що вказує на те, що сахароза не приймає участі в реакціях відновлення, так як вона не має ні вільних глікозидних гідроксидів, ні карбонільних груп.
Дослід 4.3. Відношення дисахаридів /мальтози, лактози, сахарози/ до аміачного розчину оксиду срібла
Принцип реакції. Завдяки наявності вільної альдегідної групи в молекулі лактози /в залишку глюкози/ та мальтози /в другому залишку глюкози/ ці дисахариди мають редукуючі властивості й можуть брати участь в реакціях відновлення, зокрема, мальтоза та лактоза дають позитивну реакцію з аміачним розчином оксиду срібла.
Сахароза не має відновлюючих властивостей і дає негативну реакцію з аміачним розчином оксиду срібла.
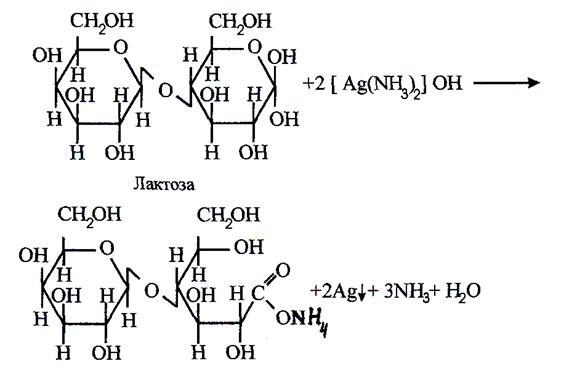
Матеріали та реактиви: аміачний розчин оксиду срібла, розчини лактози, мальтози, сахарози.
Хід роботи.
В три пробірки, вимиті гарячим розчином луги і водою, наливають по 3 мл аміачного розчину оксиду срібла. В одну з них доливають 2 мл розчину лактози, в другу - мальтози, в третю - сахарози. Всі три пробірки поміщають на декілька хвилин в стакан з водою, нагрітою до 80 - 90°С. Якщо стінки пробірки добре вимиті, то в першій і другій спостерігають осадження металічного срібла у вигляді блискучого дзеркального нальоту.
В пробірці з розчином сахарози змін не спостерігається.
Дослід 4.4. Гідроліз /інверсія/ сахарози.
Принцип реакції. В молекулі сахарози зв'язок між залишками глюкози та фруктози утворюється за рахунок двох глікозидних гідроксидів. Сахароза не має відновлюючих властивостей і дає негативну реакцію Троммера.
Після гідролізу сахарози /кіп'ятіння за наявності концентрованої соляної кислоти/ утворюються моносахариди, які можна виявити за допомогою реакції Троммера, а фруктозу - також за реакцією Селіванова.
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Матеріали та реактиви. Концентрована соляна кислота, 2%-й розчин сахарози, розчин гідроксиду натрію та сульфату міді, кристалічний резорцин.
Хід роботи
В дві пробірки наливають по 6 мл розчину сахарози. В одну з них додають ще дві краплі концентрованої соляної кислоти й нагрівають на киплячій водяній бані за Т = 100°С протягом 15 хв. Друга пробірка містить контрольний розчин сахарози. Потім беруть ще дві пробірки й в одну з них вносять 3 мл нейтралізованого гідролізату сахарози /з першої пробірки/, а в іншу - 3 мл контрольного розчину сахарози /з другої пробірки/. До вмісту цих пробірок додають по 1 мл розчину гідроксиду натрію та по п'ять крапель розчину сульфату міді. Потім пробірки нагрівають на водяній бані до кипіння /проводять реакцію Троммера/. У пробірці, яка містить гідролізат, утворюється червоний осад геміоксиду міді /позитивна реакція Троммера/, а в контрольній пробі цього немає /негативна реакція Троммера/.
Із гідролізатом сахарози, що залишився /3 мл/, і контрольним розчином сахарози проводять реакцію Селіванова на виявлення фруктози. Для цього в обидві пробірки додають по 1 мл розчину соляної кислоти та декілька кристалів резорцину. Вміст пробірок нагрівають на водяній бані протягом 5 - 10 хв. за температури 80°С. У пробірці, яка містить гідролізат сахарози, спостерігають появу вишнево-червоного забарвлення /позитивна реакція Селіванова/ й відсутність такого забарвлення в контрольній пробі.
Дослід 4.5. Якісна реакція на сахарозу з С0SО4.
Матеріали та реактиви. Розчин сахарози, гідроксиду натрію, сульфату кобальта /1:50/.
Хід роботи
В пробірку наливають 2 - 3 мл водного розчину сахарози, додають декілька крапель водного розчину /1:50/ сульфату кобальта і надлишок розчину гідроксиду натрію. З'являється фіолетовий колір. Реакція чутлива і дає позитивний результат при розведенні сахара 1:10000.
Дослід 4.6. Утворення карамелі.
Принцип реакції. Процес карамелізації дуже складний і пов'язаний з дегідратацією і утворенням полімерів. В залежності від температури і інших умов карамелізації утворюються продукти різного складу.
Матеріали та реактиви. Цукор кристалічний.
Хід роботи
В пробірку насипають 1 - 2 г цукру і обережно нагрівають до тих пір, доки цукор не розплавиться і не побуріє. Темний продукт, що утворився і є карамель.
Дослід 4.7. Виявлення молочного цукру у молоці.
Матеріали та реактиви. Молоко, концентрована оцтова кислота, гідроксид натрію, фелінгова рідина.
Хід роботи
Свіже молоко /25 мл/ розводять рівним об'ємом дистильованої води, добавляють 10 — 15 крапель концентрованої оцтової кислоти і збовтують. Казеїн і жир відфільтровують через фільтр. Фільтрат ділять на дві частини. До однієї додають гідроксид натрію до слаболужної реакції і фелінгову рідину. Суміш нагрівають. При цьому молочний цукор проявляє свою відновлюючу властивість – утворює червоний осад оксиду міді /І/.
До другої частини фільтрату додаємо концентрованої азотної кислоти і випаровуємо суміш досуха в фарфоровій чашці у витяжній шафі /!/. Галактоза, що утворилася під час гідролізу, окислюється до слизевої кислоти - кришталевий порошок, малорозчинний у холодній воді.

Питання до теоретичної частини
1. Що таке олігосахариди?
2. Які дисахариди відносять до редукуючих і чому?
3. Які дисахариди відносять до нередукуючих? Напишіть їх структурні формули.
4. В які типи реакцій вступають дисахариди?
5. Яка властивість дисахаридів покладена в основу їх класифікації?
6. Напишіть перспективні формули Хеуорса для сахарози, целобіози, мальтози і лактози.
Питання до експериментальної частини
1. Як довести наявність гідроксильних груп в дисахаридах?
2. Як довести, що дисахарид має редукуючі властивості?
3. Як провести гідроліз сахарози?
4. Що таке карамелізація?
5. Як виявити молочний цукор у молоці?
6. Які якісні реакції на сахарозу вам відомі?
7. Що таке реакція Троммера?
8. Що таке реакція "срібного дзеркала"?
9. Як якісно визначити дисахарид?
10. Як кількісно визначити дисахарид?
ЛАБОРАТОРНА РОБОТА № 5
Тема: Властивості полісахаридів
Дослід 5.1. Клейстеризація крохмалю і якісні реакції на нього
/з розчином йоду, гідроксидом барію, фелінговою рідиною/
Принцип реакції. Полісахариди різняться за хімічною природою моносахаридних одиниць, що повторюються, ступенем розгалуження та довжиною ланцюга. Полісахариди не містять вільних редукуючих груп, тому вони не мають відновлюючої здатності. Продуктами повного гідролізу полісахаридів за наявності кислот чи специфічних ферментів є моносахариди, які мають редукуючі властивості.
Матеріали та реактиви. Крохмаль, розчин Люголя, гідроксид барію, фелінгова рідина.
Хід роботи
Промитий сухий крохмаль (1 г) розтирають в ступці з 5 мл води. Суспензію виливають в стакан з 50 мл води, нагрівають до кипіння. Крохмаль розбухає. Утворюється майже прозорий розчин - крохмальний клейстер, з яким проводять подальші досліди.
а) До 5 мл охолодженого крохмального клейстеру додають 1 - 2 краплі розчину йоду в йодіді калію. Розчин забарвлюється в темно-блакитний колір. При нагріванні колір зникає, а при охолодженні знову з'являється.
б) Частину крохмального клейстеру замішують з концентрованим розчином гідроксиду барія і кип'ятять. При цьому відбувається осадження барієвої сполуки крохмаля, що вказує на наявність гідроксильних груп в молекулі крохмаля.
в) Невелику кількість крохмального клейстеру змішують з 2 - 3 мл фелінгової рідини і нагрівають до кипіння. Відновлення фелінгової рідини не відбувається, тому що крохмаль не має вільних глікозидних гідроксилів і карбонільних груп.
г) Невелику кількість крохмального клейстера на склі змішують з слиною. До суміші додають краплю розчину йоду. З’являється характерний для крохмалю темно-блакитний колір, який поступово через деякий час переходить у червоно-фіолетовий, потім в червоний, і, нарешті, в жовтий. Зміна кольору пояснюється реакцією гідролізу крохмаля під дією слини. Слина містить фермент птиалін, який енергійно каталізує гідроліз крохмаля до утворення дисахарида мальтози.
Дослід 5.2. В иявлення крохмаля у картоплі, кукурудзі, пшениці за допомогою розчину йоду.
Матеріали і реактиви. Розчин йоду в йодиді калію, картопля, насіння кукурудзи і пшениці.
Хід роботи
Картоплю розрізають на дві частини і свіжезрізаний пласт змочують розчином йоду в йодиді калію. Те ж саме роблять з насінням кукурудзи та пшениці. Синє забарвлення вказує на присутність крохмаля.
Дослід 5.3. Кислотний ступінчатий гідроліз крохмалю.
Принцип реакції. Під час нагрівання розчину крохмаля з мінеральними кислотами має місце гідроліз крохмаля з утворенням глюкози, яку можна виявити характерними реакціями на моносахариди, зокрема, реакцією Троммера.
Матеріали та реактиви. Концентрована соляна кислота, 1%-й розчин крохмалю, 10%-й розчин гідроксиду натрію, 1%-й розчин сульфату міді.
Хід роботи
В дві пробірки наливають по 5 мл розчину крохмаля. В одну з них вносять також дві-три краплі концентрованої соляної кислоти й кип'ятять на водяній бані 5хв. Інша пробірка - контрольна. Потім в обидві пробірки доливають по 2мл розчину гідроксиду натрію та по п'ять крапель розчину сульфату міді й нагрівають (проводять реакцію Троммера), В пробірці, де проводився гідроліз крохмалю соляною кислотою, під час нагрівання утворюється червоний осад геміоксиду міді (позитивна реакція Троммера), а в контрольній пробірці його немає (негативна реакція Троммера).
Дослід 5.4. Якісне визначення целюлози в рослинних матеріалах.
Одним з найбільш поширених реагентів якісного аналізу на целюлозу є хлор-цинк-йод, який забарвлює целюлозу в фіолетовий колір.
Для визначення целюлози використовують також розчин йоду в сірчаній кислоті, він забарвлює целюлозне волокно в темно-синій колір.
З точки зору хіміка кольорові реакції є малопереконливі, так як вони дають добрі результати тільки тоді, коли аналізують чисту целюлозу. Якщо досліджують продукт, що містить значну кількість домішків, то колір буде нечіткий, із стороннім відтінком.
Хід роботи
На скляну пластинку кладуть невелику кількість досліджуваного матеріалу або стрічку фільтрувального паперу і наносять на них декілька крапель хлор-цинк-йоду. Відмічаємо забарвлення продукту дослідження.
Питання і вправи до теоретичної частини
1. Наведіть структурні формули гомо- та гетерополісахаридів. Яка їх роль у життєдіяльності живих організмів?
2. Наведіть схеми реакцій гідролізу крохмаля.
3. В чому полягають процеси дектринізації та висахарювання крохмаля?
4. Наведіть схеми ферментативних гідролізів амілози і амінопектину. Під дією яких ферментів проходять вказані вище процеси?
5. Наведіть схему біосинтезу крохмаля.
6. Яка роль крохмаля у життєдіяльності людини?
7. Яка будова глікогену? Де сконцентровані основні запаси глікогену?
8. Яка роль глікогену у діяльності живого організму?
9. Яка хімічна будова і де використовується карбоксиметилцелюлоза, диєтиламіноетилцелюлоза та геміцелюлоза?
10. Наведіть схеми біосинтезу глюкози та глікогену.
11. В чому полягає хімічна суть бродіння глюкози? Які фактори впливають на цей процес?
12. Поясніть суть аеробного та анаеробного перетворення вуглеводів.
13. На відміну від крохмаля целюлоза в організмі людини і тварин розщеплюється в малій кількості. Поясніть причини цього. Чому присутність клітковини у їжі являється необхідною?
Питання і вправи до експериментальної частини
1. Що таке клейстеризація крохмаля? Як її проводять?
2. Яка хімічна суть взаємодії йоду з крохмалем?
3. Як проводять ступінчатий гідроліз крохмаля?
4. Як здійснюють визначення пентоз у тканинах?
5. Як визначити якісно целюлозу?
ЛАБОРАТОРНА РОБОТА № 6
Тема: Визначення деяких констант жирів.
Дослід 6.1. Визначення і топлення тваринного жиру
Метод заснований на визначенні температури по підніманню стовпчика жиру в капілярі, відкритому з двох кінців.
Матеріали та реактиви. Лід, жир.
Обладнання. Фарфорова чашка; капіляр, відкритий з двох кінців; термометр; штатив з кільцем; стакан на 500 мл; мішалка.
Хід роботи
Досліджуваний зразок жиру нагрівають на водяній бані у фарфоровій чашці до повного розтоплення і фільтрують. Чисту, суху,відкриту з двох кінців капілярну трубку з тонкого скла з внутрішнім діаметром 1 – 1,2 мм (довжина капіляра 50 - 60 мм) занурюємо одним кінцем у розтоплений жир так, щоб висота його в капілярі дорівнювала 10 мм. Капіляр з жиром видержують на льоду 10 хвилин або залишають на 24 год. при кімнатній температурі.
Після цього капіляр прикріпляють до термометра тонким резиновим кільцем так, щоб стовпчик жиру знаходився на одному рівні з ртутним шариком термометра. Потім термометр з капіляром занурюють в стакан з водою на таку глибину, щоб він був у воді на 3 - 4 см. Температура води в стакані 15 – 18ºС. Слідкують, щоб в незаповнений кінець капіляра не потрапила вода. При перемішуванні мішалкою (магнітною або механічною), воду в стакані нагрівають спочатку зі швидкістю приблизно на 2ºС за хвилину, а потім – 1ºС за хвилину.
Температурою топлення вважають ту, при якій жир в капілярі починає підніматись. Визначення роблять 2 рази, за результат приймають середнє арифметичне з двох паралельних дослідів, які повинні розрізнятися не більше, ніж на 0,5ºС.
Дослід 6.2. Визначення показника заломлення ліпідів.
Принцип методу. Визначення засновано на вимірюванні показника заломлення жиру по граничному куту заломлення до повного внутрішнього відбивання.
Реактиви та обладнання. Жир, рефрактометр, скляні палички.
Хід роботи
На поверхню вимірювальної призми скляною паличкою, не торкаючись призми, наносять декілька крапель досліджуваної рідини, обережно опускають освітлювальну призму. Рідина повинна повністю заповнити зазор між призмами. Освітлювальне дзеркало ставлять так, щоб світло попадало в освітлювальну призму і рівномірно освітлювало поле зору.
Знаходять кордон світла і тіні. Потім точно суміщують кордон розділу з крапкою перехрещення рисок і відраховують по шкалі приладу показник заломлення. Дослід повторюють 2 - 3 рази з точністю до 0,0002, беруть середнє значення одержаних значень.
Якщо температура досліду була не 20ºС, а інша, то одержане значення приводять до 20ºС по формулі:
ND20 NDt (t - 20) 0,00035,
де ND20 - показник заломлення при 20ºС;
NDt- показник заломлення при температурі t;
0,00035 - середня зміна показника заломлення жиру при зміні температури на 1ºС.
По закінченні вимірювань поверхню призм очищають ватою з діетиловим спиртом, а потім сухою.
Дослід 6.3. Визначення числа омилення жирів.
Принцип методу. Числом омилення називають кількість гідроксиду калію, яка потрібна для нейтралізації всіх жирних кислот (вільних і тих, що входять до складу триацилгліцеролів), що містяться в 1 г жиру.

 CH2OCOR CH2OH
CH2OCOR CH2OH


 CHOCOR + 3KOH CHOH + 3RCOOK
CHOCOR + 3KOH CHOH + 3RCOOK
CH2OCOR CH2OH
Матеріали та реактиви. Жир, 0,1%-й розчин фенолфталеїну, розчин НСІ. (0,5 моль/л), спиртовий розчин КОН (0,5 моль/л). Для виготовлення цього реактиву, 40 г КОН розчиняють у 30 мл води, залежно від концентрації спиртового розчину, беруть відповідну кількість водяного розчину КОН і розводять перегнаним за наявності NaОН (на 100 г спирту 5 г NaОН) спиртом. Спирт із таким вмістом NaОН кип’ятять із зворотним холодильником протягом години. Потім переганяють. Розчин відстоюють добу. Фільтрують і зберігають у добре закоркованій склянці з темним склом.
Обладнання. Колби, об’ємом 50 мл; зворотний холодильник; водяна баня; піпетка; бюретки; крапельниці.
Хід роботи
В одну колбу (досліджувану пробу) вміщують 0,5 г жиру, в другу (контрольну пробу) 0,5 мл води. В обидві колби доливають по 15 мл спиртового розчину КОН і кип’ятять із зворотним холодильником на водяній бані протягом 50 хв. до повного омилення гліцеридів і нейтралізації вільних жирних кислот. Потім в обидві колби додають по 10 крапель розчину фенолфталеїну й титрують теплим розчином НСl до зникнення рожевого забарвлення (до нейтралізації реакції).
Кількість КОН, мг, (число омилення ЧО), витрачена на нейтралізацію всіх жирних кислот, що містяться в 1 г жиру, визначають за формулою:
ЧО = (В - А) · f · Q / a,
де:
(В - А) - різниця результатів титрування контрольного та досліджуваного зразків розчином соляної кислоти (0,5 моль / л), мл;
а - наважка досліджуваного жиру, г;
f - коефіцієнт поправки на титр розчину НСl (0,5 моль /л);
Q - кількість КОН (28,05 мг), яка еквівалентна 1 мл розчину КОН (0,5 моль /л).
Дослід 6.4. Визначення кислотного числа жиру.
Принцип методу. Кислотністю жиру, або кислотним числом (КЧ), називають кількість КОН, мг, яка потрібна для нейтралізації вільних жирних кислот, що містяться в 1 г жиру.
Матеріали та реактиви. Спирт, нейтралізований за фенолфталеїном, розчин КОН (0,1 моль /л), 0,1%-й розчин фенолфталеїну, жир.
Обладнання. Колби, об’ємом 50 мл, піпетки, бюретки.
Хід роботи
До 1 г жиру додають 15 мл суміші спирту з діетиловим ефіром, або бензолом (1:2), нейтралізованої за фенолфталеїном, добре перемішують для максимального розчинення вільних жирних кислот і титрують розчином КОН до появи рожевого забарвлення (забарвлення не повинно зникати протягом 0,5 - 1 хв.).
Кількість КОН, мг, витрачену на титрування вільних жирних кислот, що містяться в 1 г жиру, визчачають за формулою:
КЧ = А · f · Q / a,
де:
А – об’єм розчину КОН (0,1 моль /л), витрачений на титрування досліджуваної проби, мл;
а - наважка жиру, г;
f - коефіцієнт поправки на титр розчину КОН (0,1 моль /л);
Q - кількість КОН (5,6 мг), еквівалентна 1 мл розчину КОН (0,1 моль /л).
Дослід 6.5. Визначення ефірного числа жиру.
Принцип методу. Ефірним числом (ЕЧ) називають кількість КОН, мг, яка потрібна для нейтралізації всіх утворених під час омилення триацилгліцеролів жирних кислот, що містяться в 1 г жиру. Це число визначають за різницею між ЧО жиру та його КЧ.
Якщо відомо значення ЕЧ жиру, можна, використовуючи розрахунковий метод, обчислити вміст гліцеролу. Слід зважати, що для вивільнення однієї молекули гліцеролу необхідно витратити три молекули КОН. Кількість гліцеролу в жирі, %, розраховують за формулою:
С = 92,06 · ЕЧ · 100 / 56,11 · 3 · 100 = 0,0547 · ЕЧ,
де:
92,06 - молекулярна маса гліцеролу;
ЕЧ - ефірне число жиру;
56,11 - молекулярна маса КОН.
Розрахунок ведуть, виходячи з реакції:

 CH2OCOR CH2OH
CH2OCOR CH2OH


 CHOCOR + 3KOH CHOH + 3RCOOK
CHOCOR + 3KOH CHOH + 3RCOOK
CH2OCOR CH2OH
Дослід 6.6. Визначення пероксидного числа у згірклому жирі.
Принцип методу. Пероксидним числом називають кількість, мл, розчину Na2S2О3, витрачену на титрування вільного йоду, що виділився під час окислення КІ пероксидним угрупуванням одного граму жиру. Метод грунтується на здатності пероксидного угруповання жиру реагувати з КІ в кислому середовищі:

 … - (СН) n – CН – СН – (СН2) n -... +2КІ + 2СНзСООН ——>
… - (СН) n – CН – СН – (СН2) n -... +2КІ + 2СНзСООН ——>
О — О
——>... - (СН2) n – СН – СН – (СН2) n -... + I2 + 2СНзСООН +Н2O
\ /
O
Реакція дуже чутлива, тому слід робити контрольні проби, щоб уникнути помилки, спричиненої можливим утворенням йоду під час окислення КІ киснем повітря.
Матеріали та реактиви. Жир, насичений розчин КІ, хлороформ, розчин Na2S2О3 (0,005 моль /л), 1 %-й розчин крохмалю, льодяна оцтова кислота. Обладнання. Дві конічні колби об’ємом 50 мл, піпетки, бюретки, крапельниці.
Хід роботи
В одну колбу (досліджувана проба) вносять наважку жиру (1 г), у другу (контрольна проба) - 1 мл води, додають по 5 мл льодяної оцтової кислоти, по 6 мл хлороформу та по 1 мл свіжовиготовленого насиченого розчину КІ, струшують протягом 5 хв. і титрують розчином Na2S2О3 за наявності десяти краплин розчину крохмалю як індикатора.
Пероксидне число, тобто кількість 0,005 моль /л розчину Na2S2О3, мл, витрачена на титрування 1 г жиру, дорівнює
(А - В) · f · 0,12691
С = ——————————, де
m
(А - В) - різниця результатів титрування досліджуваного та контрольного зразків розчином Na2S2О3 (0,005 моль /л);
f - коефіцієнт поправки на титр розчину Na2S2О3 (0,005 моль /л);
0,12691 - титр тіосульфата по йоду і помножений на 100;
m - маса досліджуваного жиру.
Дослід 6.7. Визначення йодного числа жиру.
Принцип методу. Йодним числом (ЙЧ) називають кількість йоду, г, яка може прореагувати з 100 г жиру. Це число ненасичених жирних кислот у жирі. Визначення ЙЧ грунтується на реакції приєднання йоду за місцем подвійного зв’язку, яка відбувається за рівнянням:
R – СН = СН – R + І2 + Н2O → R – СН-СН-R + НІ
 |  |
І ОН
Матеріали та реактиви. Жир, спиртовий розчин йоду (0,1 моль/л), 1 %-й розчин крохмалю, розчин Na2S2О3 (0,05 моль/л).
Обладнання. Дві конічні колби об’ємом 50 мл, піпетки, бюретки.
Хід роботи
В одну колбу (досліджувана проба) вносять наважку жиру 0.1 -0.2 г, у другу {контрольна проба) 0.1 -0.2 мл води, додають по 10 мл спиртового розчину йоду, перемішують і залишають на 15хв. Через 15хв. вміст колб титрують розчином Na2S2O3 до появи жовтуватого забарвлення. Потім, додавши 1 мл розчину крохмалю, суміш титрують до зникнення синього забарвлення. Йодне число визначають за формулою:
ЙЧ = (в – а) · f · Q · 100/a · 1000 =  % де,
% де,
(В-А) - різниця результатів титрування контрольного та досліджуваного зразків у розчині гіпосульфіту (0.05 моль / л), мл;
а - наважка досліджуваного жиру, г;
f- коефіцієнт поправки на титр розчину Na2S2O3 (0.05 моль /л);
Q - кількість I2 (12.69 мг), еквівалентна 1 мл розчину Na2S2O3 (0,05 моль/л).
Питання та вправи
До теоретичної частини:
1. Які вам відомі групи ліпідів?
2. Який хімічний склад ліпідів?
3. Які особливості хімічної будови нейтральних ліпідів, фосфоліпідів і сфінголіпідів?
4. Наведіть схему біосинтезу вищих насичених та ненасичених карбонових кислот.
5. В чому полягає суть біосинтезу вищих насичених спиртів та альдегідів?
6. Наведіть схему біосинтезу триацилгліцеролів.
7. В чому полягає роль фосфоліпідів у життєдіяльності організмів? Яка їх хімічна будова?
8. Наведіть схему метаболізму основних фосфоліпідів.
9. Наведіть схему біосинтезу холестеролу. Яка роль останнього у функціонуванні організму?
10. Що таке воскоподібні речовини?
11. Що собою являють жироподібні речовини?
До експериментальної частини:
1. Як проводять визначення Т. топ., Т. кіп. речовин?
2. Що таке число омилення жирів?
3. За якою формулою обчислюють число омилення?
4. В чому суть визначення числа омилення жирів?
5. Яка техніка виконання досліду по визначенню числа омилення жиру?
6. Як визначають кислотність жиру? Чим вона зумовлена?
7. Наведіть формулу, за якою обчислюють кислотне число жиру.
8. Для чого визначають ефірне число жиру? Як це робиться?
9. Як визначити кількість жирних кислот у жирі?
10. Чому жири прогоркають?
11. Що характеризує пероксидне число жиру? Як його визначають?
ЛАБОРАТОРНА РОБОТА № 7
Тема. Хімічні та фізичні властивості ліпідів.
Дослід 7.1. Вивчення розчинності жирів і утворення емульсії.
Принцип методу. Характерними властивостями жирів є їх добра розчинність у багатьох органічних розчинниках (ацетон, хлороформ, діетиловий ефір тощо) і нерозчинність у воді. Під час змішування жирів із водою утворюються емульсії, стійкість яких залежить від середовища, в якому вони створюються. Наявність у воді речовин-емульгаторів (мила, жовчні кислоти, карбонати тощо) збільшує стійкість емульсій. Утворення емульсій зумовлене тим, що в поверхневий водяний шар, який оточує жирові краплинки, спрямовуються поверхнево-активні частинки жовчних кислот, мила, карбонату, котрі обволікають краплинки жиру й переш






