гемоглобина к О2
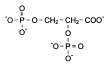
2,3-бисфосфоглицерат
Ткани
Нb(О2)4 + БФГ ↔ Нb-БФГ + 4О2
Лёгкие

Поиск: Рекомендуем:  Почему я выбрал профессую экономиста
Почему я выбрал профессую экономиста
 Почему одни успешнее, чем другие
Почему одни успешнее, чем другие
 Периферийные устройства ЭВМ Периферийные устройства ЭВМ
 Нейроглия (или проще глия, глиальные клетки) Нейроглия (или проще глия, глиальные клетки)
Категории:
|
Бифосфоглицерат (БФГ) – аллостерический регулятор сродства
гемоглобина к О2
2,3-бисфосфоглицерат
Ткани Нb(О2)4 + БФГ ↔ Нb-БФГ + 4О2 Лёгкие
| ||
| 4. Роль протеомики в оценке патологических состояний. Понятие об азотистом балансе. Переваривание и всасывание пищевых белков. Протеиназы желудочно-кишечного тракта: пепсин, гастриксин, ренин, трипсин, химотрипсин, экзопептидазы. Гастроинтестинальные гормоны, их роль | |||
| Протеомика – наука, основным предметом изучения которой являются белки, их функции и взаимодействия в живых организмах, в том числе – в человеческом. Основная задача протеомики – количественный анализ экспрессии белков в клетках в зависимости от их типа, состояния или влияния внешних условий. Протеомика осуществляет сравнительный анализ больших групп белков – от всех белков, вовлеченных в тот или иной биологический процесс до полного протеома. Преимуществом протеомики перед геномикой является тот факт, что наличие какого-либо гена в геноме не означает, что с него производится транскрипция, а наличие транскрипта не означает, что с него происходит трансляция, а даже если происходит, то транскрипт не позволяет однозначно говорить о структуре белка, его созревании и локализации. Азотистый баланс означает разность между общим количеством азота, поступившим в организм человека (или другой организм), и общим количеством экскретируемого азота. Если азота поступает больше, чем экскретируется, говорят, что данный индивидуум имеет положительный азотистый баланс. Важные примеры: период роста и беременности; азотистый баланс положителен как у здорового растущего ребенка, так и у здоровой беременной женщины. Взрослый человек в норме находится в состоянии азотистого равновесия: потребление азота уравновешивается его выделением в составе фекалий и мочи. В состоянии отрицательного азотистого баланса количество выделяемого азота превышает количество азота, потребляемого организмом. Важным примером служат больные, потребляющие недостаточное количество азота с пищей (например, при квашиоркоре); такое же состояние наблюдается при прогрессирующих формах рака и в ряде случаев в послеоперационном периоде. Переваривание пищевых белков Переваривание белков, входящих в состав пищи, происходит в различных отделах ЖКТ с участием протеиназ. Пепсин. Основная пищеварительная функция желудка заключается в том, что в нем начинается переваривание белка. Пепсин продуцируется главными клетками в виде неактивного зимогена, пепсиногена. Пепсиноген активируется в пепсин ионами Н+, которые отщепляют защитный полипептид, «раскрывая» активный пепсин, а также самим пепсином, вызывающим быструю активацию дополнительных молекул пепсиногена (аутокатализ). Пепсин преобразует денатурированный белок в протеозы и затем в пептоны—большие полипептидные производные. Он представляет собой эндопептидазу, поскольку осуществляет гидролиз пептидных связей в составе главной полипептидной структуры, а не N- или С-концевых последовательностей, что характерно для экзопептидаз. При этом фермент специфически атакует пептидные связи, образуемые с участием ароматических аминокислот (например, тирозина) или дикарбоновых аминокислот (например, глутамата). Гастриксин – протеолитический фермент (катализирующий расщепление белка пищи) желудочного сока, проявляющий максимальную активность при pH, равном 3,0-3,5. Гастриксин по своим функциям и эволюции в желудке близок к пепсину, поэтому иногда называется пепсин С или парапепсин II и относится к изопепсинам. Профермент гастриксина – прогастриксин – секретируется главными клетками фундальных желёз дна, тела и интермедиальной зоны желудка, а также клетками пилорических желёз и активируется, также как и профермент пепсина пепсиноген, соляной кислотой желудочного сока. Гастриксин, в отличие от пепсина, протеолетически активен в менее кислой среде. Гастриксин является вторым по объёму после пепсина среди содержащихся в желудочном соке протеолитических ферментов. Количество гастриксина в желудочном соке здорового взрослого человека составляет 20-50 % от количества пепсина. Гастриксин вместе с пепсином обеспечивают до 95 % всей протеолитической активности желудочного сока. Реннин(химозин, сычужный фермент). Этот фермент вызывает створаживание молока. Он чрезвычайно важен для процессов пищеварения у младенцев, поскольку предотвращает быстрый выход молока из желудка. В присутствии кальция реннин вызывает необратимые изменения казеина молока, превращая его в параказеин, который затем подвергается действию пепсина. В желудке взрослых людей реннин, по-видимому, отсутствует. Он используется при производстве сыра. Трипсин, хнмотрипсин н эластаза. Протеолитическое действие панкреатического секрета обусловливается тремя эндопептидазами – трипсином, химотрипсином и эластазой, которые расщепляют белки и полипептиды, поступающие из желудка, с образованием полипептидов, пептидов или тех и других. Трипсин специфически действует на пептидные связи, образуемые основными аминокислотами, химотрипсин – на связи между остатками незаряженных аминокислот (например, ароматических), в то время как эластаза вопреки своему названию обладает довольно широкой специфичностью, расщепляя связи, примыкающие к остаткам малых аминокислот, таких, как глицин, аланин и серии. Все три фермента секретируются в виде зимогенов. Активация трипсиногена осуществляется другим протеолитическим ферментом, энтерокиназой, секретируемой слизистой кишечника. Она гидролизует лизиновую пептидную связь в зимогене, высвобождая малый полипептид, что приводит к разворачиванию молекулы в активный трипсин. Образовавшийся трипсин действует не только на новые молекулы трипсиногена, но и на другие зимогены панкреатического секрета – химотрипсиногеи, проэластазу и прокарбоксипептидазу – с высвобождением соответственно химотрипсина, эластазы и карбокснпептиндазы. Карбоксипептидаза. Дальнейшее расщепление полипептидов, образовавшихся под действием эндопептидаз, осуществляет экзопептидаза – карбоксипептидаза, которая атакует С-концевую пептидную связь, высвобождая одиночные аминокислоты. | Эффективность использования пищевого белка обусловливает его требуемое количество. Кроме того, это количество зависит от следующих факторов: качества белка, потребления энергии и физической активности. Качество белка. Качество (пищевая ценность) белка определяется соотношением доли незаменимых аминокислот в пище с величиной этого показателя при адекватном питании. Чем ближе обе величины, тем выше качество белка. Белки яйца и молока обладают высокой ценностью, они эффективно используются организмом и применяются в качестве стандарта при оценке других белков. Потребление энергии.Энергия, извлекаемая из углеводов и жиров, влияет на потребность в белке, поскольку она способствует сбережению белка как источника энергии. Для эффективного использования «дорогого» (высокоценного) пищевого белка и для сведения потребности в нем до минимума необходимо обеспечить адекватное поступление энергии из небелковых источников, в частности из углеводов, которые «оберегают» белок от его использования в процессе глюконеогенеза. Физическая активность.Физическая активность повышает задержку азота из пищевого белка. Переваривание секретом кишечника Кишечный сок, секретируемый железами Бруннера и Либеркюна, также содержит пищеварительные ферменты, в число которых входят: 1) аминопептидаза, представляющая собой экзопептидазу, которая гидролизует пептидные связи за N-концевыми аминокислотами полипептидов и олигопептидов; дипептидазы различной специфичности, некоторые из них могут находиться внутри кишечного эпителия; они завершают расщепление дипептидов до свободных аминокислот; 2) специфические дисахаридазы и олигосахаридазы, такие, как α-глюкозидаза (мальтаза), удаляющая единичные глюкозные остатки из α1→4-связанных олигосахаридов и дисахаридов начиная с нередуцирующих концов, изомальтаза (а-декстриназа), которая гидролизует 1→6-связи α-декстринов; β-галактозидаза (лактаза), удаляющая галактозу из лактозы; сахараза, гидролизующая сахарозу, и трегалаза. расщепляющая трегалозу; 3) фосфатаза, удаляющая фосфат из некоторых органических фосфатов (гексозофосфаты и глицерофосфат) и из нуклеотидов пищевого происхождения или образующихся из нуклеиновых кислот в результате их переваривания нуклеазами; 4) полинуклеотидазы, которые расщепляют нуклеиновые кислоты на нуклеотиды; 5) нуклеозидазы (нуклеозидфосфорилазы), катализирующие фосфоролиз нуклеозидов с образованием свободных азотистых оснований и пентозофосфатов; 6) кишечный секрет, по-видимому, содержит также фосфолипазу, которая действует на фосфолипиды с образованием глицерола, жирных кислот, фосфорной кислоты и оснований, таких, как холин. Наиболее интенсивно переваривание и всасывание осуществляются в тонком кишечнике. Приблизительно 90% переваренных пищевых веществ подвергается всасыванию при прохождении через него; одновременно всасывается и вода. Этот процесс усиливается при поступлении пищи в толстый кишечник, в результате жидкое содержимое тонкого кишечника, попадая в толстую кишку, постепенно становится более твердым. Транспорт веществ, всасывающихся в кишечнике, осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Всасывание аминокислот и белка В нормальных условиях пищевые белки почти полностью расщепляются на составляющие их аминокислоты, которые затем быстро всасываются в кишечнике. Возможно, что некоторые гидролитические процессы (например, в случае дипептидов) полностью завершаются в кишечной стенке. Потребность животных в белке может с успехом удовлетворяться скармливанием полной смеси аминокислот. Природные (L-) изомеры (но не D-изомеры) аминокислот подвергаются активному переносу через кишечную стенку от слизистой ее поверхности к серозной; в этом переносе может участвовать витамин В6 (пиридоксальфосфат). Активный транспорт L-аминокислот представляет собой энергозависимый процесс; об этом свидетельствует его ингибирование разобщителем окислительного фосфорилирования 2,4-динитрофенолом. Аминокислоты переносятся через щеточную каемку целым рядом переносчиков, многие из которых действуют при посредстве Na+-зависимых механизмов, подобно системе переноса глюкозы. К числу Na+-зависимых переносчиков относятся переносчик нейтральных аминокислот, переносчик фенилаланина и метионина и переносчик, специфичный для иминокислот, таких, как пролин и гидроксипролин. Охарактеризованы и независимые от Na+-переносчики, специализированные в отношении транспорта нейтральных и липофильных аминокислот (например, фенилаланина и лейцина) или катионных аминокислот (например, лизина). Клинические аспекты. Лица, у которых возникает иммунологическая реакция на прием белка, по-видимому, обладают способностью к всасыванию некоторого количества негидролизованного белка, потому что переваренный белок лишен антигенных свойств. Это предположение не является полностью умозрительным, ведь известно, что антитела молозива поступают в кровь младенца. Получает все новые и новые подтверждения гипотеза, согласно которой при нетропическом спру основной дефект локализуется в клетках слизистой кишечника и выражается в том, что, во-первых, полипептиды, образующиеся при пептическом и триптическом переваривании клейковины (главного белка пшеницы), оказывают на кишечник повреждающее действие, а во-вторых, они (эти полипептиды) всасываются в кровоток, что индуцирует образование соответствующих антител. Заметим, что антитела против клейковины или ее фракций часто обнаруживаются в крови больных нетропическим спру. Повреждающий эффект скорее всего принадлежит компоненту, представляющему собой полипептид, состоящий из 6 или 7 аминокислот, в число которых обязательно должны входить глутамин и пролин. Анализ данного заболевания позволяет предположить, что при определенных условиях в кишечнике может происходить всасывание белковых фрагментов больших молекулярных размеров, чем аминокислоты. | ||
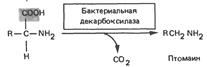
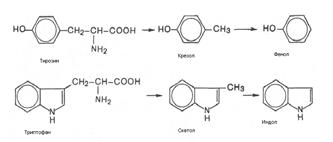
| 5. Бактериальное расщепление невсосавшихся в кишечнике аминокислот | |||
| Процессы гниения и брожения в кишечнике Большая часть потребленной пищи всасывается в тонком кишечнике. Остальная часть попадает в толстый кишечник. Именно здесь происходит значительное всасывание воды и полужидкое кишечное содержимое постепенно становится более твердым. В этот период проявляется бактериальная активность. В ходе вызываемых бактериями процессов брожения и гниения образуются различные газы, такие, как СО2, метан, водород, азот и сероводород, а также уксусная, молочная и масляная кислоты. Бактериальное разложение фосфатидилхолина приводит к образованию холина и родственных токсических аминов, например нейрина. Судьба аминокислот Большинство аминокислот подвергается декарбоксилированию в результате действия кишечных бактерий с образованием токсических аминов (птомаинов). Реакции декарбоксилирования приводят к образованию кадаверина из лизина, агматина из аргинина, тирамина из тирозина, путресцина из орнитина и стамина из гистидина. Многие из этих аминов являются мощными вазопрессорными агентами. Аминокислота триптофан в результате нескольких реакций превращается в индол и метилиндол (скатол). Именно эти соединения в основном придают запах калу. Серусодержащая аминокислота цистеин подвергается серии превращений с образованием меркаптанов, таких, как этил- и метилмеркаптаны, а также H2S. В толстом кишечнике образуется значительное количество аммиака, который представляет собой продукт гниения при действии кишечных бактерий на азотистые субстраты. Аммиак всасывается в портальную кровь, но при нормальных условиях быстро удаляется из крови печенью. При болезнях печени эта ее функция может нарушаться, и в таком случае концентрация аммиака в периферической крови повышается до токсических уровней. Считают, что аммониевая интоксикация может играть роль в возникновении у некоторых больных печеночной комы. Показано, что оральное введение неомицина уменьшает количество аммиака, поступающего из кишечника в кровь, благодаря антибактериальному действию этого вещества. У больных с тяжелыми поражениями печени диета с высоким содержанием белка, а также желудочно-кишечные кровотечения могут способствовать развитию интоксикации аммиаком. В этих случаях также показан неомицин. Кишечные бактерии Кишечная флора может составлять значительную часть (до 25%) сухого веса кала. У травоядных, пища которых состоит большей частью из целлюлозы, бактерии кишечника или рубца играют важную роль в пищеварении, поскольку они расщепляют полисахариды и тем самым способствуют их всасыванию. Кроме того, эти бактерии осуществляют синтез незаменимых аминокислот и витаминов. Для людей кишечная флора не столь важна, как для травоядных. Однако бактериальная активность вносит определенный полезный вклад в питание человека, ибо с ней связан синтез витаминов К и В12, а возможно, и других витаминов группы В, которые далее усваиваются организмом. |
 [2H]
CH3SH → CH4 + H2S
Метилмеркаптан Метан Сероводород
[2H]
CH3SH → CH4 + H2S
Метилмеркаптан Метан Сероводород
|
|
|
|
|
|
|
Дата добавления: 2016-11-23; Мы поможем в написании ваших работ!; просмотров: 1071 | Нарушение авторских прав
Лучшие изречения: