У даний час відомо понад 1000 ферментів. У міру розвитку біохімії виникала необхідність у вдосконаленні номенклатури і класифікації ферментів. До перших ферментів, відкритих біохіміками, відносяться ферменти, що здійснюють гідролітичне розщеплення речовин, – гідролази. Потім були відкриті ферменти, що здійснюють негідролітичний розпад складних речовин – десмолази, або ліази та ін. Ферменти почали називати за характером каталітичної дії, природою субстрату та іншим ознакам, додаючи до кореня слова суфікс – аза. Так виникли тривіальні назви ряду класів (наприклад, гідролази), груп (пептидази) і окремих представників (амілаза) ферментів.
На V Міжнародному біохімічному конгресі, що проходив у 1961 р. в Москві, була прийнята нова класифікація і номенклатура ферментів. За основу був узятий принцип класифікації ферментів по типу хімічних реакцій, які вони каталізують. Всі відомі ферменти діляться на шість класів:
1. Оксидоредуктази – ферменти, які каталізують окисно-відновні реакції.
2. Трансферази – ферменти, які каталізують реакції міжмолекулярного перенесення різних хімічних груп і залишків.
3. Гідролази – ферменти, які каталізують реакції приєднання або відщеплення окремих груп або залишків молекул з участю води.
4. Ліази – ферменти, які каталізують реакції відщеплення від субстрата негідролітичним шляхом певних груп з утворенням подвійних зв’язків або реакції приєднання таких же груп по подвійних зв’язках.
5. Ізомерази – ферменти, які каталізують реакції внутрішньомолекулярного переміщення різних атомних груп або зв’язків (ізомерні перетворення речовин).
6. Лігази (синтетази) – ферменти, які каталізують з’єднання двох і більше молекул простих речовин в одну за рахунок макроергічного зв’язку молекули АТФ або іншого донатора енергії.
Кожний клас ферментів підрозділяється на підкласи, які, у свою чергу, діляться на підпідкласи, підпідкласи складаються з окремих представників. Єдина система класифікації ферментів заснована на чотиризначному десятковому коді, згідно якому класам, підкласам, підпідкласам і індивідуальним ферментам привласнюються номери (шифри). Перша цифра шифру показує, до якого з шести класів відноситься даний фермент, друга цифра означає підклас в класі, третя – підпідклас, четверта – порядковий номер ферменту в даному підпідкласі. Ферменти, для яких каталітичні реакції вивчені недостатньо, тимчасово віднесені в підпідклас з номером 99. Наприклад, деякі ферменти класу оксидоредуктаз (цифра 1), для яких не встановлена природа природного акцептора (підклас 1) позначаються 1.1.99 і т.д.
В даний час біохіміки користуються двома номенклатурами – тривіальною (робочою) і систематичною. Тривіальна номенклатура використовується в повсякденній практиці. Тривіальні назви ферментів короткі, наприклад, пепсин, трипсин, уреаза, мальтаза, лактаза.
Систематичні назви точно ідентифікують фермент і по можливості точно визначають його дію. Систематична назва ферменту складається з двох частин: перша частина назви відображає назву головного субстрата, друга – характер реакції, яка каталізується, і суфікс – аза. На початку шифру ставиться дві букви – КФ (класифікація ферментів) і чотири числа; розділених між собою крапками, – чотиризначний десятковий код ферменту. Так, фермент, який гідролітично розщеплює пептидний зв’язок між двома залишками гліцина (гліцилгліцина), називається гліцилгліцин-гідролаза, його шифр – КФ 3.4.3.1. Якщо фермент каталізує реакцію між двома субстратами (зокрема, перенесення окремих груп атомів), то в першій частині назви ферменту вказуються назви цих субстратів, ставиться двокрапка без інтервалу, а в другій частині вказується характер хімічної реакції і додається суфікс – аза. Так, фермент, що переносить атоми водню від молочної кислоти на кофермент НАД, називається L-лактат:НАД-оксидоредуктаза, його шифр – КФ 1.1.1.27. У ряді випадків дається докладна вказівка про окремі сторони хімізму дії ферменту (за допомогою дужок) за систематичною назвою. Так, фермент, який дезамінує L-глутамінову кислоту шляхом перенесення водню на НАД, називається L-глутамат:НАД-оксидоредуктаза (дезамінуюча), його шифр – КФ 1.4.1.2.
За новою класифікацією можна швидко знайти в списку ферментів потрібний фермент, визначити його тривіальну і систематичну назву, номер (шифр), активні групи і кофактори, характер хімічної реакції, яку він каталізує, дізнатися про джерела сировини для його одержання та ін.
Нижче приводяться відомості за новою класифікацією і номенклатурою ферментів 1961 р. з додаванням змін, внесених пізніше Асамблеями Міжнародного біохімічного союзу. Класи представлені повністю, підкласи, підпідкласи і індивідуальні ферменти – вибірково, залежно від їх значення в обміні речовин.
Оксидоредуктази
Ферменти, які каталізують окисно-відновні процеси. Оксидоредуктази – двокомпонентні ферменти. Функції кофакторів у яких можуть виконувати піридин– (НАД і НАДФ) і флавіннуклеотиди (ФМН і ФАД), залізопорфіринові комплекси (гем) і багато катіонів (Fe3+, Fe2+, Co2+, Mo2+, Cu2+, Zn2+ та ін.). Хімічні реакції, в яких беруть участь оксидоредуктази, дають можливість клітинам одержувати хімічну енергію у вигляді макроергічних сполук.
Відомо понад 200 оксидоредуктаз. Вони об’єднані в 14 підкласів. За тривіальною номенклатурою ферменти розділяються відповідно до характеру каталітичної дії на дегідрази (відщеплюють від субстрата атоми водню або електрони і переносять їх на інший субстрат), оксидази (акцептором є кисень), гідроксилази (включають у відновлений субстрат один атом кисню) і оксигенази (вводять в субстрат, що окислюється, два атоми кисню).
За систематичною номенклатурою в назві ферменту вказується субстрат-донатор, субстрат-акцептор, слово „оксидоредуктаза” і шифр.
1.1. Оксидоредуктази, які діють на CH–ОН-групу донорів. Залежно від природи акцептора підклас ділиться на чотири підпідкласи. Прикладом, коли акцептором є НАД або НАДФ, може бути фермент спиртового бродіння – алкогольдегідрогеназа (алкоголь:НАД-оксидоредуктаза, КФ 1.1.1.1), що здійснює окислення спиртів з участю НАД і іонів Zn2+:

До другого підпідкласу відносяться ферменти, у яких акцептором є цитохром. Зокрема, лактатдегідрогеназа (L–лактат:цитохром С-оксидоредуктаза, КФ 1.1.2.3), яка каталізує окислення лактата з участю цитохрома С і наявності іонів Zn2+ як активаторів. Для ряду ферментів акцептором є кисень, зокрема, для гексозооксидази (D-гексоза:O2-оксидоредуктаза, КФ 1,1.3.5).
1.2. Оксидоредуктази, які діють на альдегідну або кетонну групу донорів. Залежно від природи акцептора підклас ділиться на п’ять підпідкласів (акцептори – НАД або НАДФ, цитохроми, O2, ліпоєва кислота та інші). Прикладом може бути гліцеральдегідфосфатдегідрогеназа (D-гліцеральдегід-3-фосфат:НАД-оксидоредуктаза (фосфорилуюча), КФ 1.2.1.12):

1.3. Оксидоредуктази, які діють на CH–СН-групу донорів. За участю ферментів даного підкласу CH–СН-групи перетворюються в С=С-групи:

Залежно від природи акцепторів (НАД або НАДФ, цитохроми, O2, та інші) підклас ділиться на чотири підпідкласи.
Найбільше значення мають ацил-КоА-дегідрогеназа (ацил-КоА:(акцептор) –оксидоредуктаза, КФ 1.3.99.3), що каталізує окислення вищих жирних кислот, і сукцинатдегідрогеназа (сукцинат: (акцептор) – оксидоредуктаза, КФ 1.3.99.1):

1.4. Оксидоредуктази, які діють на CH–NH2-групу донорів. Ферменти дезамінують аміни і амінокислоти. При цьому аміни перетворюються на альдегіди (або кетони), амінокислоти – в кетокислоти. В тканинах тварин широко поширена глутаматдегідрогеназа (L-глутамат:НАД-оксидоредуктаза (дезамінуюча), КФ 1.4.1.2.):

1.5. Оксидоредуктази, які діють на СН–NH-групу донорів. Ферменти, які каталізують окислення заміщених амінів без виділення аміаку.
1.6. Оксидоредуктази, які діють на відновлені НАД або НАДФ. Для цих ферментів донором водню є відновлені форми коферментів. Наприклад, фермент цистинредуктаза (НАДФ) (НАДФ:L-цистиноксидоредуктаза, КФ 1.6.4.1.) є донором водню для відновлення цистину:
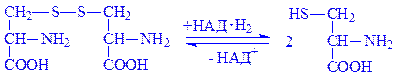
1.7. Оксидоредуктази, які діють на інші азотисті сполуки донорів. До цього підкласу відносять ферменти, які каталізують окислення азоту, аміаку та деяких органічних нітросполук.
1.8. Оксидоредуктази, які діють на сірковмісні групи донорів. Ферменти окислюють тіолові групи до дисульфідних або сульфітів, а сульфіти – до сульфатів. Розрізняють шість підпідкласів залежно від природи акцептора. Загальний принцип дії більшості ферментів такий:

Типовим ферментом підкласу є цистеаміндегідрогеназа (цистеамін:НАД-оксидоредуктаза, КФ 1.8.1.1).
1.9. Оксидоредуктази, які діють на групи гема донорів. Підклас складається з шести підпідкласів. В організмі широко поширена цитохромоксидаза (цитохром С:O2-оксидоредуктаза, КФ 1.9.3.1), яка окислює цитохром Спри перенесенні електронів на кисень:
4 Фероцитохром С + О2 = 4 Ферицитохром С + Н2О
1.10. Оксидоредуктази, які діють на дифеноли і близькі до них сполуки донорів. Ферменти цього підкласу каталізують окислення о - і n -фенолів до відповідних о - і n -хінонів. Сюди належить також фермент аскорбатоксидаза (L-аскорбат:О2-оксидоредуктаза, КФ 1.10.3.3), яка окислює аскорбінову кислоту до дегідроаскорбінової:

1.11. Оксидоредуктази, які діють на Н2О2 як акцептор. Найбільш поширено два ферменти – пероксидаза і каталаза. Їх простетична група представлена гемом. Пероксидаза (донор:H2O2-оксидоредуктаза, КФ 1.11.1.7) каталізує реакцію:
Донор + Н2О2 = Окислений донор + Н2О
Каталаза (Н2О2:H2O2-оксидоредуктаза, КФ 1.11.1.6) руйнує пероксид водню, що утворюється в ході окисно-відновних реакцій:
2H2О2 ® 2H2O + O2.
1.12. Оксидоредуктази, які діють на водень як захисники донора. Акцептором водню в цих ферментах є НАД+ або НАДФ+, цитохроми або залізосіркопротеїд.
1.13. Оксидоредуктази, які діють на окремі донори з включенням у них молекулярного кисню (оксигенази). Ферменти цього підкласу каталізують реакції включення в свої субстрати одного або двох атомів кисню з О2. При цьому вони взаємодіють з однією молекулою донора (субстрату). Прикладом є ліпоксигеназа (лінолеат:О2-оксидоредуктаза, КФ 1.13.11.12). цей фермент каталізує реакції окислення ненасичених жирних кислот (головним чином лінолевої та ліноленової) з утворенням гідроперекисних і перекисних сполук:

1.14. Оксидоредуктази, які діють на пару донорів, каталізуючи включення молекулярного кисню. Ферменти цього підкласу каталізують більш складні реакції, ніж підкласу 1.13. Вони прискорюють реакції, в яких два різних донори водню взаємодіють з О2.
До наступних підкласів належать оксидоредуктази, які діють на перекисні радикали у вигляді акцептора (1.15), окислюють іони металів (1.16), діють на СН2-групи (1.17), на відновлений фередоксин у вигляді донора (1.18) і на відновлений флаводоксин у вигляді донора (1.19).
Трансферази
Трансферази – клас ферментів, які каталізують перенесення різних хімічних груп від однієї органічної сполуки (донатора) до іншої (акцептору). Вони беруть участь в обміні нуклеїнових кислот, білків, вуглеводів, ліпідів і т.д. Каталітичний процес, в якому беруть участь трансферази, складається з декількох стадій. Головною з них є утворення проміжного продукту – фермент-транспортованої групи. Якщо донатор позначити A, транспортовану групу – T, фермент – Ф, акцептор – Д, то ці реакції можна зобразити так:
А + Ф «В + ФТ; ФТ + Д «ДТ + Ф.
Клас трансфераз об’єднує близько 800-та ферментів. Він складається з восьми підкласів. Систематична назва ферменту створюється за схемою: донор: акцептор – група-трансфераза. В тканинах найбільш поширені такі підкласи трансфераз:
2.1. Трансферази, які діють на одновуглецеві залишки. Залежно від природи залишку в підкласі розрізняють три підпідкласи. Особливої уваги заслуговують метилтрансферази, які здійснюють реакції переметилювання. До них відноситься нікотинамід-метилтрансфераза (S-аденозилметіонін:нікотинамід-метилтрансфераза, КФ 2.1.1.1), яка каталізує утворення N-метилнікотинаміда за рахунок перенесення метильної групи з „активного” метіоніна на нікотинамід:

Широко поширені в тканинах карбоксил- і карбамоїлтрансферази, які каталізують перенесення COOH- і COO–NH2-груп. Так, в тканинах печінки міститься орнітин-карбамоїлтрансфераза (карбамоїлфосфат:L-орнітин-карбамоїлтрансфераза, КФ 2.1.3.3).
2.2. Трансферази, які діють на альдегідні або кетонні залишки. З участю цих ферментів формуються молекули нових речовин, що містять карбонільну групу з високою реакційною здатністю. Так, під впливом трансальдолази (D-седогептулозо-7-фосфат:D-гліцеральдегід-3-фосфат – діоксіацетонтрансферази, КФ 2.2.1.2) здійснюється одна з основних реакцій пентозного циклу:

2.3. Трансферази, які діють на ацильні залишки. Це ферменти, що здійснюють перенесення залишків різних жирних кислот за допомогою KoA на різні акцептори (гліцин, карнітин, холін та ін.). Прикладом є холін-ацетилтрансфераза (ацетил-КоА:холін-О-ацетилтрансфераза, КФ 2.3.1.6), яка синтезує в нервовій тканині ацетилхолін:

2.4. Трансферази, які діють на глікозильні залишки. Це ферменти, які каталізують перенесення залишків вуглеводів від різних глікозильних сполук. Прикладом є УДФ-галактоза-глюкоза – галактозилтрансфераза (УДФ-галактоза:D-глюкоза-1-галактозилтрансфераза, КФ 2.4.1.22), яка каталізує утворення молочного цукру (лактози):
УДФ-галактоза + D-глюкоза = Лактоза + УДФ
2.5. Трансферази, які переносять алкільні (відрізняються від метильних) та арильні залишки. Дана група ферментів досить гетерогенна. Значна частина цих ферментів бере участь у синтетичних процесах, зокрема в біосинтезі стероїдів, каротиноїдів, убіхінону, тіаміну, рибофлавіну та інших сполук. До цього класу належить метіонін-аденозилтрансфераза (АТФ:L-метіонін S-аденозилтрансфераза, КФ 2.5.1.6), яка перетворює метіонін на сполуку активних метильних груп:
АТФ + L-метіонін + Н2О = S-Аденозилметіонін + 3 Н3РО4
2.6. Трансферази, які діють на азотисті групи. Підклас складається з трьох підпідкласів (амінотрансферази, амідинотрансферази, оксимінотрансферази). Велике значення має аланін-амінотрансфераза (L-аланін:2-оксоглутарат-амінотрансфераза, КФ 2.6.1.2), що каталізує двостороннє перенесення аміногрупи:

2.7. Трансферази, які діють на фосфатні групи. Підклас на основі природи хімічної групи акцептора фосфату ділиться на сім підпідкласів. Прикладом ферменту, що каталізує приєднання фосфатної групи до спиртового гідроксилу, є гексокіназа (АТФ:D-гексоза-6-фосфотрансфераза, КФ 2.7.1.1):
АТФ + D-гексоза + D-гексозо-6-фосфат + АДФ
2.8. Трансферази, які діють на сірковмісні групи. В підклас входить три підпідкласи: сульфідтрансферази, сульфотрансферази, КоА-трансферази. Зокрема, малонат-КоА-трансфераза (ацетил-КоА:малонат-KoA-трансфераза, КФ 2.8.3.3) каталізує реакцію:
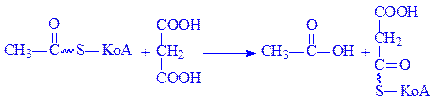
Гідролази
Це ферменти, що каталізують реакції розщеплення (іноді і синтезу) органічних речовин, за участю води:
R1R2 + HOH «R1H + R2OH
Гідролази широко поширені в природі. Вони беруть участь в обміні нуклеїнових кислот, білків, ліпідів, вуглеводів та інших сполук. Більшість гідролаз – прості білки. Каталітична активність залежить від наявності в їх каталітичних центрах SH-груп. Відомо близько 200 гідролаз. За типом зв’язку який вони гідролізують їх ділять на одинадцять підкласів.
3.1. Гідролази, які діють на складноефірні зв’язки. За тривіальною номенклатурою їх називають естеразами. Підклас складається з шести підпідкласів: гідролази ефірів карбонових кислот, тіолових ефірів, фосфомоноефірів, фосфодиефірів, трифосфомоноефірів і сульфоефірів. В організмі широко поширена ліпаза (гідролаза ефірів гліцерину, КФ 3.1.1.3), особливо в тканинах підшлункової залози. Під її впливом, у тому числі і в тонкій кишці, відбувається розщеплення нейтральних жирів:
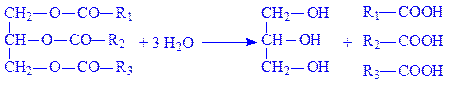
Гідролази тіолових ефірів розщеплюють складні ефіри, утворені SH-групами і карбоновими кислотами. Так, ацетил-КоА-гідролаза (ацетил-КоА – гідролаза, КФ 3.1.2,1) каталізує розкладання ацетил-КоА:
Ацетил-КоА + H2O = KoA + CH3–COOH
Під впливом гідролаз фосфомоноефірів (фосфатаз) фосфорні ефіри розщеплюються на спирти і фосфорну кислоту. Так, лужна фосфатаза (фосфогідролаза моноефірів ортофосфата, КФ 3.1.3.1) каталізує реакцію:
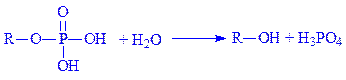
3.2. Гідролази, які діють на глікозильні сполуки. За тривіальною номенклатурою цей підклас називають глікозидазами, оскільки вони розщеплюють глікозидні зв’язки між залишками моноз. Підклас складається з трьох підпідкласів: гідролази глікозидів, N-глікозильних і S-глікозильних сполук. Сюди входять такі ферменти вуглеводного обміну, як a- і b-амілази, целюлаза, інулаза, a- і b-глюкозидази, нуклеозидаза та ін. Типовим представником першого підпідкласу є a-амілаза (a-1,4-глюкан – 4-глюканогідролаза, КФ 3.2.1.1), яка здійснює за присутності іонів Ca2+ гідролітичне розщеплення a-1,4-глюканових зв’язків в полісахаридах. Механізм дії ферментів другого підпідкласа відображає НАД(Ф)-нуклеозидаза (НАД(Ф) – глікогідролаза, КФ 3.2.2.6):
НАД(Ф) + H2O = Нікотінамід + R(Ф)
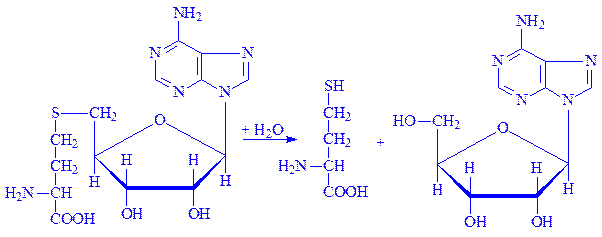
3.3. Гідролази, які діють на прості ефірні зв’язки. Представником ферментів цього підкласу є аденозилгомоцистеїназа (S-аденозил-L-гомоцистеїн гідролаза, КФ 3.3.1.1):
3.4. Пептидгідродази. Вони каталізують розщеплення пептидних зв’язків в білках:
R1–NH–CO–R2 + H2O «R1–NH2 + R2–COOH
Підклас складається з чотирьох підпідкласів: a-амінопептид-аміноацидогідролази, a-карбоксипептид-аміноацидогідролази дипептидгідролази і пептид-пептидогідролази. В підклас входять багато відомих ферментів. Так, амінотрипептидаза (КФ 3.4.1.3) гідролізує пептиди, що містять нейтральні амінокислоти, з відщепленням N-кінцевого залишку молекули; карбоксипептидаза А (КФ 3.4.2.1) гідролізує пептиди з відщепленням С-кінцевого залишку молекули; пепсин (КФ 3,4.4.1) гідролізує зв’язки між залишками ароматичних або дикарбонових L-амінокислот; катепсин С (КФ 3.4.4.1) гідролізує пептиди, особливо по зв’язках, що містять залишок ароматичної амінокислоти, суміжної з вільною a-аміногрупою і т.д.
3.5. Гідролази, які діють на С–N-зв’язки, відмінні від пептидних. Ці ферменти діють на аміни і амідини. Діляться на п’ять підпідкласів. Наприклад, уреаза (карбамід – амідогідролаза, КФ 3.5.1.5) бактерійного походження:
NH2–CO–NH2 + H2O = CO2 + 2NH3
В м’язовій тканині міститься АДФ-дезаміназа (АДФ – аміногідролаза, КФ 3.5.4.7), яка каталізує дезамінування АДФ:
АДФ + H2O = ІДФ + NH3
3.6. Гідролази, які діють на кислотоангідридні зв’язки. Підклас складається з семи підпідкласів. До нього відносяться фосфогідролази, що каталізують розщеплення ангідридів фосфорної кислоти. Зокрема, АТФ-аза (АТФ – фосфогідролаза КФ 3.6.1.3) каталізує реакцію:
АТФ + H2O = АДФ + Н3РО4
3.7. Гідролази, які діють на С–С-зв’язки. Вони гідролізують зв’язки в основному у кетосполуках. Сюди належить оксалоацетаза (оксалоацетат – ацетилгідролаза, КФ 3.7.1.1). вона розщеплює оксалоацетат:

До інших підкласів гідролаз належать ферменти, що діють на галоїдні зв’язки (3.8), фосфор-азотні зв’язки (3.9), сірка-азотні зв’язки (3.10), і вуглець-фосфорні зв’язки (3.11), які мають важливе значення в обміні багатьох сполук в організмах.
Ліази
Ліази – це ферменти, що каталізують реакції негідролітичного відщеплення певних груп від субстратів з утворенням подвійних зв’язків або реакції приєднання цих груп по подвійних зв’язках. Деякі ліази, на відміну від лігаз, здійснюють реакції синтезу окремих речовин без участі макроергічних сполук. Більшість ліаз – складні білки, що містять в молекулах фосфорні ефіри водорозчинних вітамінів. Клас складається з шести підкласів: вуглець-вуглець-ліази, вуглець-кисень-ліази, вуглець-азот-ліази, вуглець-сірка-ліази і вуглець-галоїд-ліази та ін.
4.1. Вуглець-вуглець-ліази. Ферменти, які здійснюють в основному розрив С–С-зв’язків. В підклас входять три підпідкласи: карбокси-ліази, альдегід-ліази і ліази кетокислот. Типовим представником є піруватдекарбоксилаза (карбокси-ліаза 2-оксокислот, КФ 4.1.1.1), яка здійснює декарбоксилування:

4.2. Вуглець-кисень-ліази. Їх часто називають гідроліазами, або дегідратазами (гідратазами). Самим вивченим ферментом підкласу є карбонат-дегідратаза, або карбоангідраза (карбонат – гідро-ліаза, КФ 4.2.1.1), що каталізує реакцію:
H2CO3 = CO2 + H2O
4.3. Вуглець-азот-ліази. Це ферменти, які здійснюють відщеплення від певних субстратів аміаку або амідинових груп. Наприклад, аспартат – аміак-ліаза (L-аспартат –аміак-ліаза, КФ 4.3.1.1) дезамінує аспартат:

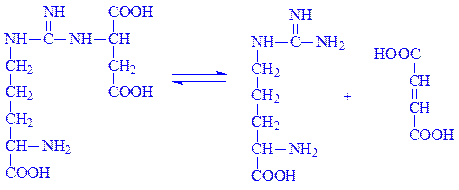
Фермент аргініносукцинат-ліаза (L-аргініносукцинат – аргінін-ліаза, КФ 4.3.2.1) розкладає аргінінянтарну кислоту:
4.4. Вуглець-сірка-ліази. Це ферменти, за допомогою яких розщеплюється зв’язок між вуглецем і сіркою. Прикладом є цистеїндесульфгідраза (L-цистеїн:сірководень-ліаза (дезамінуюча), КФ 4.4.1.1), що каталізує реакцію:

До інших підкласів ліаз належать також вуглець-галоїд-ліази (4.5) і фосфор-кисень-ліази (4.6). Із інших ліаз (4.99) відомий такий фермент, як феррохелатаза (4.99.1.1), що каталізує включення заліза в молекулу гема.
Ізомерази
Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і епімерази амінокислот і їх похідних, оксикислот і їх похідних, вуглеводів і їх похідних і інших сполук. Ферменти, що здійснюють реакції ізомеризації в субстратах з одним асиметричним атомом, називають рацемазами. До них слід віднести бактерійні ферменти, які перетворюють L-амінокислоти в D-амінокислоти, зокрема аланінрацемазу (аланінрацемаза, КФ 5.1.1.1):

Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами. Так, УДФ-глюкозоепімераза (УДФ-глюкозо – 4-епімераза, КФ 5.1.3.2) в тканинах молочної залози ізомеризує УДФ-глюкозу в УДФ-галактозу, яка необхідна для біосинтезу лактози (за участі НАД і іонів Mg2+):
УДФ-глюкоза «УДФ-Галактоза
5.2. Цис-транс-ізомерази. Ці ферменти змінюють геометричну конфігурацію органічних сполук, що містять подвійні зв’язки. Зокрема, малеїнатізомераза (малеїнат – цис-транс -ізомераза, КФ 5.2.1.1) здійснює перетворення:

5.3. Внутрішньомолекулярні оксидоредуктази. Ці ферменти каталізують взаємні перетворення альдоз і кетоз. З їх участю окислюються –CH–ОН-групи, одночасно відновлюється сусідня СО-група. Так, тріозофосфатізомераза (D-гліцеральдегід-3-фосфат – кетол-ізомераза, КФ 5.3.1.1) каталізує реакцію:

5.4. Внутрішньомолекулярні трансферази. Ці ферменти часто називають мутазами. Вони переносять певні групи з однієї частини молекули на іншу. Так, під впливом фосфогліцерат-фосфомутази (D-фосфогліцерат – 2,3-фосфомутази, КФ 5.4.2.1) відбувається реакція:

5.5. Внутрішньомолекулярні ліази. До ферментів, що каталізують внутрішньомолекулярні перетворення ліазного типу, відноситься муконат-циклоізомераза (4-карбоксиметил-4-оксиізокротонолактон – ліаза (дециклізуюча), КФ 5.5.1.1), що каталізує реакцію:
(+)-4-карбоксиметил-4-окси-ізокротонолактон = Цис-цис -муконат
6. лігази (синтетази)
Ці ферменти каталізують реакції з’єднання двох молекул та реакції спряжені з відщепленням залишків фосфорної кислоти від АТФ або її аналогів. Термін „лігази” застосовують також до ферментів, що каталізують реакції синтезу без нуклеозидтрифосфатів. Вони сприяють утворенню хімічних зв’язків, що власне і є причиною їх назви (від лат. ligare – зв’язувати). Механізм реакцій складний. Він є або трьохстадійним перенесенням, або утворенням потрійних комплексів. Кофакторами багатьох лігаз є біотин і його похідні. Число лігаз, відомих зараз, досягає 100.
6.1. Лігази, які утворюють С–О-зв’язки. До підкласу належать ферменти, що каталізують приєднання амінокислот до відповідних тРНК. Число лігаз відповідає кількості амінокислот, які використовуються для біосинтезу молекул білків. Утворюються аміноацил-тРНК. Так, тирозил-тРНК – синтетаза (L-тирозин: тРНК – лігаза (АМФ), КФ 6.1.1.1) за наявності іонів Mg2+ і K+ каталізує реакцію
АТФ + L-Тирозин + тРНК = АМФ + Пірофосфат + L-Тирозил-тРНК
6.2. Лігази, які утворюють С–S-зв’язки. Ці ферменти здійснюють утворення С–S-зв’язків між залишками жирних кислот і KoA. Зв’язок макроергічний. Активований залишок жирної кислоти залучається до всіляких реакцій синтезу або розщеплення. Так, під впливом ацетил-KoA – синтетази (ацетат: KoA – лігази (АМФ), КФ 6.2.1.1) і за наявності іонів Mg2+ в різних тканинах протікає реакція
АТФ + Ацетат + KoA = АМФ + Пірофосфат + Ацетил-КоА
6.3. Лігази, які утворюють С–N-зв’язки. Підклас складається з п’яти підпідкласів: амідсинтетази, пептидсинтетази, циклолігази, інші С–N-лігази і С–N-лігази з глутаміном в ролі N-донора. Особливе значення мають пептидсинтетази, під впливом яких з амінокислот синтезуються пептиди. Наприклад, g-глутамілцистеїнсинтетаза (L-глутамат:L-цистеїн – лігаза (АДФ), КФ 6.3.2.2) в тканинах печінки за наявності іонів Mg2+ каталізує реакцію утворення дипептида:
АТФ + L-Глутамат + L-Цистеїн = АДФ + Ортофосфат + g-L-глутаміл-L-цистеїн
6.4. Лігази, які утворюють С–С-зв’язки. З цього підкласу найбільш детально вивчена карбоксилаза, що каталізує реакцію карбоксилування. Так, під впливом піруваткарбоксилази (піруват: CO2 – лігази (АДФ), КФ 6.4.1.1) в тканинах за наявності іонів Mg2+ з піровиноградної кислоти і вуглекислого газу утворюється щавелевооцтова кислота:
АТФ + СН3–СО–СООН + СО2 + Н2О = НООС–СН2–СО–СООН + АДФ + Н3РО4
Другий фермент цього підпідкласу ацетил-КоА – карбоксилаза (ацетил-КоА:CO2 – лігаза (АДФ), КФ 6.4.1.2) каталізує утворення з ацетил-КоА і СО2 малоніл-КоА – проміжного продукту біосинтезу вищих жирних кислот:
АТФ + Ацетил-КоА +СО2 + Н2О = АДФ + Ортофосфат + Малоніл-КоА
Класифікація і номенклатура ферментів у ході розвитку біохімії і в результаті відкриття нових ферментів постійно удосконалюються, а їх число з кожним роком збільшується.






