(за T.T. Березовим і Б.Ф. Коровкіним)
| Фермент | Катіон металу | Фермент | Катіон металу |
| Цитохроми | Fe2+ | Амілаза | Са2+ |
| Каталаза | Fe2+ | Ліпаза | Ca2+ |
| Пероксидаза | Fe2+ | Карбоангідраза | Zn2+ |
| Триптофаноксидаза | Fe2+ | Лактатдегідрогеназа | Zn2+ |
| Аскорбатоксидаза | Cu2+ | Уриказа | Zn2+ |
| Тирозиназа | Cu2+ | Карбоксипептидаза | Zn2+ |
| Фенолоксидаза | Cu2+ | Пептидази | Mg2+ |
| Ксантиноксидаза | Mo2+ | Фосфатази | Mg2+ |
| Нітратредуктаза | Mo2+ | Фосфоглюкокіназа | Mg2+ |
| Альдегідоксидаза | Mo2+ | Фосфоглюкомутаза | Mn2+ |
| Пептидази | Co2+ | Холінестераза | Mn2+ |
До неспецифічних інгібіторів відносяться ферментні отрути (HCN, KCN, NaCN), іони важких металів, алкалоїдні реактиви, азиди, флуориди, сульфіди та ін. Інгібітори взаємодіють з активними центрами молекули ферменту, інактивуючи функціональні групи білків. Вони можуть взаємодіяти з металами, що входять до складу молекул ферментів і фермент-субстратних комплексів. Високі концентрації інгібіторів руйнують четвертну і третинну структуру молекули ферменту, викликаючи його денатурацію.
Розрізняють оборотне і необоротне гальмування. Прикладом оборотного гальмування є дія антиферменту на фермент. Так, антипепсин, який інактивує, пепсин, в порожнині шлунку під впливом соляної кислоти стає неактивним, оскільки комплекс фермент-інгібітор в цих умовах дисоціює. Прикладом необоротного гальмування є дія ізопропіл-фторфосфату на ацетилхолінестеразу.
Розрізняють два типи активації і гальмування ферментів: алостеричне або просторове, і субстратне або конкурентне. За відсутності активатора між молекулою субстрата і молекулою ферменту немає тісного контакту і активність ферменту зведена до мінімуму (рис. 4, I). За наявності активатора він приєднується до молекули ферменту, змінюючи його конфігурацію так, що каталітичний центр зближується з субстратом і активність ферменту досягає максимальної величини (рис. 4, II). При алостеричному гальмуванні активний центр деформується і субстрат не може приєднатися до ферменту (рис. 4, III). При конкурентному гальмуванні місце субстрата в активному центрі займає аналог і фермент-субстратний комплекс не може виникнути (рис. 4, IV). Прикладом конкурентного гальмування є взаємодія СДГ з малоновою кислотою замість янтарної. Для витіснення конкурента слід збільшити концентрацію субстрата.
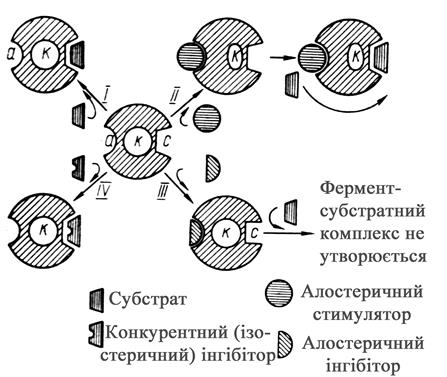
Рис. 4. Схема активації і гальмування дії ферменту а – алостеричний центр ферменту;
к – каталітичний центр ферменту; с – субстратний центр ферменту
Висока каталітична здатність. Ферменти володіють високою каталітичною здатністю. Так, амілаза слини проявляє активність при розбавленні 1: 1000000, пероксидаза – при розбавленні 1: 5000000, пепсин – при розбавленні 1: 10000000. Молекула каталази за 1 с розщеплює 550000 молекул H2O2.
Одиниці вимірювання активності ферментів. Характерною особливістю дії ферментів є їх висока каталітична активність. Вона значно вища, ніж неорганічних каталізаторів. Наприклад, пероксид водню розщеплюється на воду і кисень завдяки дії іонів заліза. Ця реакція каталізується також залізовмісним ферментом – каталазою. При цьому каталаза в 100 млн. разів швидше розщеплює пероксид водню, ніж іони заліза. Високу каталітичну активність, порівняно з каталізаторами небіологічного походження, мають і інші ферменти.
Активність ферментів характеризується швидкістю хімічних реакцій, які вони каталізують. Якщо за певний час фермент каталізує значну кількість хімічних перетворень, то вважають, що він має високу каталітичну активність. Часто її визначають за кількістю субстрату, який перетворюється за одиницю часу, або за кількістю продуктів реакції, які утворюються за цей час. Активність ферментів визначають також, виходячи із залежності, яка при певних умовах існує між активністю ферменту і його концентрацією.
У 1961 р. Комісія по ферментах Міжнародного біохімічного союзу рекомендувала використовувати стандартну одиницю ферментів.
За одиницю (E) будь-якого ферменту приймається така його кількість, яка каталізує перетворення одного мікромоля субстрата за хвилину.
Активність ферментів виражають в одиницях, які називаються каталами (скорочено кат.). Катал – це каталітична активність, яка здійснює хімічне перетворення 1 моль субстрату за 1 с. Один катал характеризує досить високу ферментативну активність, яка майже не зустрічається при звичайних умовах. Тому активність ферментів виражають у частках каталу, наприклад у мілікаталах (мл-кат. – одна тисячна частка каталу), в мікрокаталах (мк-кат. – одна мільйонна частка каталу) і т.д. Наприклад, у досліджуваній пробі ферментативна активність становить 2 мк-кат., тобто в пробі міститься така кількість ферменту, яка може здійснити перетворення 2 мкмоль субстрату за 1 с.
У деяких випадках важливо знати не тільки, яка активність даного розчину, що містить фермент, а й яка ферментативна активність саме білка, що знаходиться в розчині. З цією метою в досліджуваному розчині визначають вміст білка і після цього роблять перерахунки, яка ферментативна активність одиниці маси білка, наприклад, 1 мг. Число одиниць ферменту, яке припадає на 1 мг білка ферментного препарату, називається питомою активністю. Чим ретельніше очищений фермент, тим вища його питома активність.
Користуючись одиницями активності ферментів, можна досить точно співставити активність різних препаратів одного і того самого ферменту. Однак, коли є потреба порівняти між собою активність різних ферментів, то використовують таку міру активності ферментів, як молекулярна активність, її раніше називали числом оборотів ферменту.
Молекулярна активність – це кількість молекул субстрату, яка перетворюється за одну хвилину однією молекулою ферменту. Для різних ферментів молекулярна активність також різна (табл. 3).
Таблиця 3.
Молекулярна активність деяких ферментів (за В.Й. Розенгартом)
| Фермент | Число молекул субстрату, що перетворюється однією молекулою ферменту за 1 хв |
| Карбоангідраза | 36 000 000 |
| Кетостероїдізомераза | 17 100 000 |
| Амілаза | 1 100 000 |
| Ацетилхолінестераза | 3 000 000 |
| b-Галактозидаза E. соlі | 12 500 |
| Фосфоглюкомутаза | 1 240 |
| Сукцинатдегідрогеназа | 1 150 |
Із даних таблиці видно, що перше місце за активністю займає карбоангідраза, яка за 1 хв перетворює 36 млн молекул субстрату (вугільної кислоти). Це найактивніший (із усіх нині відомих) фермент.
Якщо фермент має простетичну групу або каталітичний центр, концентрація яких доступна вимірюванню, то його каталітичну дію можна виразити у величинах активності каталітичного центру, тобто, числом молекул субстрата, які перетворюються за 1 хв одним каталітичним центром.
Оборотність дії ферментів. Ферменти здатні впливати на синтез субстрата і на його розпад. Так, пепсин при рН=0,5 – 2 розщеплює білки до поліпептидів, пептидів і амінокислот. При рН=5 – 6 з цих же амінокислот під впливом пепсину синтезуються білки. Значення оборотності дії ферментів велике. Воно дає можливість організму економно витрачати пластичні і енергетичні матеріали, клітинам і тканинам одержувати потрібні біологічні речовини залежно від потреб у певні періоди існування і функціонування. Так, в анаеробній фазі розщеплення вуглеводів глікоген або глюкоза розпадаються до молочної або піровиноградної кислот. Близько ⅔ цих кислот регенерується до глюкози і глікогену під впливом тих же ферментів, які здійснювали розпад.
Хімічна природа ферментів
Відомо, що ферменти мають білкову природу. Як і білки, їх ділять на прості і складні. Прості ферменти є однокомпонентними, а складні – дво- і багатокомпонентними.
Для ферментів-білків характерна будова, типова для цього класу сполук. Для ряду ферментів була визначена первинна, вторинна, третинна і четвертна структура молекули. Так, встановлена послідовність амінокислотних залишків в молекулі панкреатичної РНК-ази, лізоциму, хімотрипсина, аспартатамінотрансферази й ін. У більшості ферментів молекула складається з одного поліпептидного ланцюга, що має вигляд a- і b-спіралей. Вивчена третинна і четвертна структури ферментів. Третинна і четвертна структури ферменту визначають характер його функцій. Так, якщо молекула має 12 субодиниць, то фермент здійснює реакцію декарбоксилування (піруватдекарбоксилаза), шість субодиниць – фермент каталізує окисно-відновні перетворення пірувата та ін.
Молекули ферментів зазвичай мають великі розміри і складну просторову конфігурацію. Кожна частина молекули ферменту строго спеціалізована. Так, в молекулі ферменту є активний центр. Він є динамічним утворенням, що містить у собі оптимальне розміщення різних функціональних груп і угрупувань, які забезпечують акт каталізу. Молекули трипсину і карбоксипептидази мають по одному активному центру, гліцеральдегід-фосфат-дегідрогенази – 2, уреази – 3 – 4, холінестерази – 20 – 100. В активному каталітичному центрі виділяються спеціалізовані ділянки, що відповідають за зв’язок з субстратом – контактна, або „якірна” ділянка (рис. 5).
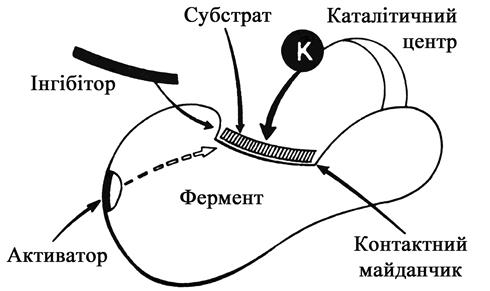
Рис. 5. Схема молекули ферменту (за О.С. Хохловим і Ю.О. Овчинниковим)
Периферійні частини молекули ферменту беруть участь в підтримці і формуванні просторової конфігурації активного центру, визначають внутрішньоклітинну локалізацію ферменту і його активних центрів, взаємостосунки з клітинними мембранами і органоїдами клітини та ін. У молекулі ферменту є ділянки, з якими можуть взаємодіяти інші речовини – алостеричні активатори або інгібітори, що змінюють просторову конфігурацію і каталітичну активність всього ферменту і його активних центрів.
Активний центр ферментів. Вивчення специфічності і каталітичної дії ферментів дало можливість встановити, що субстрат зв’язується не з усією молекулою ферменту, а з окремою її ділянкою, яка називається активним центром (рис. 5). Оскільки активний центр визначає специфічність і каталітичну активність ферменту, то він повинен складатися із структури певного ступеня складності,яка може зближуватися і взаємодіяти з молекулою субстрату.
У складних ферментах (протеїдах) активний центр утворений кофактором і залишками амінокислот; у простих ферментах (протеїнах) активний центр представлений певною комбінацією залишків амінокислот, які розміщені на відповідній ділянці молекули ферменту. До складу активного центру більшості простих ферментів входять залишки амінокислот цистеїна, серина, аргініна, аспарагінової і глутамінової кислот, гістидина, тирозина і триптофана. Серед них важливе значення мають групи HS (цистину), групи OH (серину), імідазольне кільце гістидину. Певну роль відіграють функціональні групи інших залишків амінокислот, зокрема карбоксильні групи аспарагінової і глутамінової кислот та індольна група триптофану. При цьому необхідно зауважити, що такі функціональні групи розміщені в поліпептидних ланцюгах ферменту на різній відстані одна від одної. Їх зближення зутворенням активного центру відбувається тільки внаслідок формування властивої для ферменту вторинної і третинної структур. Отже, активний центр ферменту складається із функціональних груп, які відповідно зорієнтовані у просторі. Порушення третинної і вторинної структур призводить до зниження або повної втрати активності ферменту. Це можна спостерігати при дії на ферменти високої температури, тобто коли відбувається їх денатурація, яка супроводжується деформацією структури білка.
Деякі ферменти мають два і більше активних центри. В активному центрі розрізняють так звану каталітичну ділянку, яка безпосередньо взаємодіє з субстратом, і контактну (якірну) ділянку, яка зумовлює спорідненість до субстрату, формування його комплексу з ферментом.
Такий поділ активного центру ферменту є досить умовним, оскільки взаємодія в контактній ділянці фермент-субстратних сполук значною мірою впливає на швидкість перетворень, які відбуваються на каталітичній ділянці ферменту. Умовний характер має також і саме відділення активного центру від інших частин ферменту, оскільки вони мають важливе значення в утворенні його нативної структури і впливають на реакційну здатність функціональних груп активного центру. Отже, за каталітичну активність ферменту відповідає вся структура його молекули.
В ході каталітичного акту відбувається своєрідна індукційна „підгонка” субстрата (іноді і інгібітору) до активного центру (рис. 6).
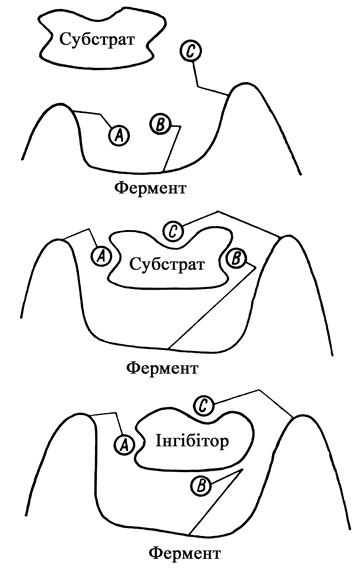
Рис. 6. Схема індукованої „підгонки” ферменту і субстрату, ферменту й інгібітору
Крім активного центру в молекулі ферменту може бути також алостеричний центр (центри) (від грец. алос – другий, інший і стереос – просторовий, структурний). Алостеричний центр – це ділянка молекули ферменту, яка в результаті приєднання до неї низькомолекулярної сполуки зумовлює зміну просторової (третинної), а іноді і четвертинної структури ферменту. Це, в свою чергу, призводить до зміни конфігурації активного центру, що зумовлює зміну каталітичної активності, тобто підвищує або знижує каталітичну активність. Цей процес є основою так званої алостеричної регуляції ферментативної активності. Ферменти, активність яких контролюється станом активного та алостеричного центрів, називаються алостеричними ферментами. Характерною особливістю цих ферментів є наявність у молекулі олігомерного ферменту декількох активних і алостеричних центрів. Функціональна активність цих центрів тісно взаємозв’язана між собою і структурою усієї молекули ферменту.
Прості ферменти. Молекули простих ферментів при гідролізі розщеплюються до амінокислот. За хімічними властивостями прості ферменти відносяться до альбумінів (естераза печінки), глобулінів (трипсин і уреаза) та до інших груп простих білків. Простими ферментами є гідролази харчового каналу (трипсин, уреаза, РНК-аза, ДНК-аза, хімотрипсин), лізоцим яйця, алкогольдегідрогеназа дріжджів і печінки та ін. У простих ферментів активний центр зазвичай формується із залишків гістидина, серина, аргініна, триптофана, цистеїна, аспарагінової і глутамінової кислот, тирозина. Так, в активному центрі РНК-ази розміщені два залишки гістидина, залишок аспарагіна і лізину. При формуванні третинної структури ферменту в його молекулі утворюється своєрідна „кишеня” поліпептидного ланцюга, в якій і відбуваються каталітичні перетворення субстрата (рис. 5).
Складні ферменти. Більшість ферментів є складними білками. При діалізі білковий компонент (апофермент) залишається в діалізаторі, небілковий проходить через напівпроникну перегородку. За присутності небілкових компонентів (кофакторів) виявляється каталітична дія багатьох ферментів. M. Діксон і Е. Уебб всі кофактори ферментів розділили на три види: коферменти, простетичні групи і активатори. Ні кофактор, ні апофермент не можуть самостійно повноцінно здійснювати каталітичний акт. Так, при з’єднанні заліза з молекулою порфірина утворюється гем, його каталітична активність щодо розкладання пероксида водню зростає в 1000 разів, а після приєднання гема до специфічного білкового компоненту утворюється каталаза, каталітична активність її в 100 000 000 разів перевищує активність кофактора. Кофактор в середньому складає близько 1 % загальної маси ферменту.
Зв’язок між апоферментом і кофактором в молекулі різних ферментів неоднаковий. Часто кофактор неміцно зв’язаний з апоферментом і з’єднується з ним під час каталітичного акту. В цьому випадку кофактор є типовим коферментом (див. вище). Прикладом таких ферментів є дегідрогенази. В багатьох ферментах кофактор міцно і постійно зв’язаний з апоферментом – простетична група, наприклад каталаза і пероксидаза, які містять гем. До активаторів ферментів відносять такі кофактори, які переводять фермент в активний стан, але самі не беруть участь в каталітичному акті. До них відносяться багато неорганічних іонів. До ферментів такого роду можна віднести карбоксипептидазу, карбоангідразу та ін. Їх часто називають металоферментами.
Розподіл кофакторів на три види умовний, оскільки дуже часто важко провести чітку грань між коферментом і простетичною групою, між іонами металів що входять до складу молекули та іонами, що активують каталітичний процес.
Функції кофакторів різноманітні. Перш за все, вони є основою для формування активного центру і здійснення контакту молекули ферменту з молекулами субстрата. Вони беруть участь у перенесенні атомних груп, атомів, протонів і електронів у ході каталітичного процесу. Деякі з них виконують зв’язуючі функції між різнорідними ферментами, забезпечуючи узгодженість їх дії. Каталіз здійснює вся молекула ферменту. Її білкова частина обумовлює швидкість реакції і специфічність дії. Один і той же кофактор може бути складовою частиною багатьох ферментів, різних за своєю будовою і значенням. Так, фосфопіридоксаль є кофактором понад 30-ти ферментів, що здійснюють карбоксилування, транс- і переамінування.
В молекулах складних ферментів в утворенні активного центру бере участь відповідний кофактор і деякі прилеглі до нього білкові функціональні групи: SH-група цистеїна, ОН-група серина, імідазольне кільце гістидина, СООН-групи аспарагінової і глутамінової кислот, індольна група триптофана та ін.






