ћеханизмом химической реакции называют последовательность и характер стадий реакции. »зучение механизма дает детальную стехиометрическую картину каждой ступени реакции и позвол€ет установить еЄ пор€док и молекул€рность.
¬ соответствии с механизмом различают простые и сложные реакции. ѕростыми (элементарными) называют реакции, протекающие в одну стадию. простым реакци€м относ€т диссоциацию большинства двухатомных молекул, например: Br2 = 2Br.
—ложные реакции протекают в несколько стадий. —реди сложных реакций различают: параллельные, последовательные, конкури-рующие, сопр€женные, цепные, фотохимические и др. ¬ сложных реакци€х молекул€рность и пор€док реакции, как правило, не совпадают.
ѕо механизму протекани€ реакции можно разделить на несколько типов.
|
|
|
|

Ќапример, при нитровании толуола одновременно протекают два процесса Ц образование орто- и пара-нитротолуола. ≈сли реакции раз-личаютс€ по скорости, то реакцию с наибольшей скоростью (k1 >> k2) считают главной (основной), а остальные - побочными.
2. ѕоследовательныереакции можно представить в виде:
A  B
B  C.
C.
ѕримером €вл€етс€ реакци€ гидролиза соли:
Na2CO3 + H2O = NaHCO3 + NaOH; (k1);
NaHCO3 + H2O = H2CO3 + NaOH; (k2).
—тадии последовательных реакций характеризуютс€ различными скорост€ми. —тади€, константа скорости которой минимальна, называетс€ лимитирующей. ќна определ€ет кинетический пор€док реакции в целом.
Ѕиохимические реакции в организме человека в большинстве случаев €вл€ютс€ последовательными. Ќапример, глюкоза, поступаю-ща€ в организм, в процессе окислени€ превраща€сь в пировиноград-ную кислоту, претерпевает дев€ть последовательных превращений (процесс гликолиза).
3. онкурирующими реакци€ми называют сложные реакции, в которых одно и тоже вещество ј одновременно взаимодействует с одним или несколькими реагентами:
ј + ¬1 → ’1;
ј + ¬2 → ’2.
¬ биологических процессах часто приходитс€ сталкиватьс€ с конкуренцией между реагентами за активный центр фермента.
4. —опр€женныереакции отвечают общей схеме:
1) A + B 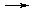 D;
D;
2) A + C 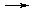 E.
E.
ѕри этом реакци€ 1) может протекать самосто€тельно, тогда как реакци€ 2) протекает только при наличии реакции 1). “акие процессы обусловлены снижением суммарной энергии √иббса (ΔG < 0) и, как правило, осуществл€ютс€ за счет образовани€ общего промежуточного соединени€. “ак, в процессе образовани€ сахарозы из глюкозы и фруктозы в присутствии ј“‘ таким соединением €вл€етс€ глюкозо-1-фосфат.
5. ÷епныереакции - это реакции, протекающие с участием химически активных частиц (свободных атомов и радикалов) и состо€щие из большого количества повтор€ющихс€ стадий.
ќбразование свободных радикалов, необходимых дл€ начала цепной реакции, происходит при разрыве св€зей в молекуле и всегда бывает сопр€жено с затратой энергии, котора€ может быть получена:
а) при поглощении молекулой кванта света: Br2  BrХ + BrХ;
BrХ + BrХ;
|
|
|
б) при электрическом разр€де: O2  OХ + OХ;
OХ + OХ;
в) под воздействием a-, b-, g-излучений (радиоактивный распад);
г) при использовании внутренней тепловой энергии самой системы.
–адикалы, вследствие своей валентной ненасыщенности и высокой химической активности, существуют лишь очень недолго, но они перевод€т устойчивые молекулы в активное состо€ние. Ќачавша€с€ цепна€ реакци€ продолжаетс€ до тех пор, пока не прореагирует все вещество или пока активные частицы по каким-либо причинам не исчезнут. –оль активных радикалов могут играть атомы водорода, хлора, кислорода и группы: —Ќ3Ц, ЦќЌ, ЦSH, —6Ќ5Ц и др.
6. ‘отохимическиминазываютс€ реакции, которые протекают только при наличии излучени€ в широком интервале энергий: от видимого и ультрафиолетового до рентгеновского и g-лучей.
Ёнерги€ активации здесь обеспечиваетс€ за счЄт излучени€, под действием которого молекулы исходных веществ переход€т в электронно-возбуждЄнное состо€ние.
ћеханизмы фотохимических реакций разнообразны. Ќесмотр€ на это, во всех случа€х можно выделить первичные процессы, непосредственно вызываемые действием света, и вторичные реакции, не требующие освещени€ дл€ своего протекани€ и называемые поэтому тЄмными.
первичным процессам относ€тс€ следующие:
1. ¬озбуждение молекул или атомов, в результате чего образуютс€ менее устойчивые частицы, способные к дальнейшим превращени€м:
M + hn 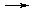 M*.
M*.
2. ƒиссоциаци€ молекул на атомы или радикалы (фотолиз):
AB + hn 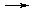 A + B.
A + B.
3. »онизаци€ молекул или атомов с выделением электрона (фотоэффект):
M + hn 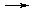 M+ + e.
M+ + e.
I закон фотохимии:
’имически активным €вл€етс€ лишь то излучение, которое поглощаетс€ реакционной смесью.
II закон фотохимии:
аждый поглощЄнный квант света вызывает превращение одной молекулы.
‘отохимические реакции отличаютс€ слабой зависимостью скорости реакции от температуры. Ёто объ€сн€етс€ тем, что в первичных реакци€х за счЄт поглощени€ света приобретаетс€ настолько больша€ энерги€, что повышение температуры может изменить еЄ лишь незначительно.
атализ
атализ - это изменение скорости химической реакции под действием специфических веществ, называемых катализаторами.
–азличают положительный и отрицательный катализ, в зависимости от того, ускор€ет катализатор реакцию или замедл€ет еЄ. ак правило, термин Ђкатализї относ€т к ускорению реакции; вещества, замедл€ющие реакцию, называют ингибиторами. “ак, присутствие глицерина замедл€ет (ингибирует) разложение пероксида водорода.
атализаторы участвуют в реакции, но не вход€т в состав продуктов и по окончании реакции остаютс€ в неизменЄнном состо€нии.
–еакции, протекающие под действием катализаторов, называют каталитическими.
≈сли катализатор и реагенты наход€тс€ в одной фазе, то такой катализ называют гомогенным. ¬ этом случае действие катализатора объ€сн€ют образованием промежуточных соединений, которые облегчают дальнейший ход реакции.
“ак, если реакци€ с  описываетс€ уравнением:
описываетс€ уравнением:
A + B = AB
то каталитический процесс можно представить следующим образом:
1) A + Kat = [AKat] 
2) [AKat] + B = AB + Kat  ,
,
где  ,
,  ,
,  - энергии активации соответствующих процессов.
- энергии активации соответствующих процессов.
ѕри этом:
 +
+  <
<  .
.
“аким образом, катализатор, измен€€ состав системы, понижает энергию активации процесса, что можно показать графически (рис. 4).

–ис. 4. ”ровни энергии активации реакции, протекающей с ката-лизатором (права€ часть) и без него (лева€ часть).
|
|
|
ѕримером гомогенного катализа €вл€етс€ разложение оксида азота (I), протекающее в газовой фазе по уравнению:
2N2O (газ) = 2N2 (газ) + O2 (газ)
ѕри обычных услови€х N2O (Ђвесел€щий газї, обладающий анестезирующим действием) весьма устойчив и разлагаетс€ при температурах выше 1000 K. ќднако присутствие следов газообразного хлора (катализатор) существенно ускор€ет этот процесс.
—лучай, когда катализатор и реагенты наход€тс€ в разных фазах, называют гетерогенным катализом. ѕри гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого катализатора, поэтому активность катализатора зависит от площади и свойств его поверхности. ¬ целом, механизм гетерогенного катализа более сложен и включает в себ€ следующие стадии:1) физическа€ адсорбци€ на активных центрах поверхности твердого вещества реагирующих молекул;2) химическа€ реакци€ между реагирующими молекулами;3) десорбци€ продуктов с поверхности катализатора.—ледует отметить, что все эти стадии обратимы.
ѕримеры гетерогенного катализа:
2H2O2 (р-р) = 2H2O (жидк.) + O2 (газ) (катализатор MnO2)
2H2 (газ) + O2 (газ) = 2H2O (газ) (катализатор платина)
—пецифической особенностью гетерогенного катализа €вл€етс€ способность к промотированию и отравлению. ѕромоторы Ц это вещества, добавление которых к катализаторам повышает их активность, а иногда избирательность и устойчивость. ѕри этом промоторы могут сами и не обладать каталитическими свойствами. “ак, в промышленном синтезе аммиака в качестве катализатора используют губчатое железо, которое в качестве промоторов содержит Al2O3, K2O и др. ѕосторонние примеси в реакционной смеси, которые привод€т к частичной или полной потере активности катализатора, называютс€ каталитическими €дами, а само €вление - отравлением катализа-тора. числу наиболее распространенных каталитических €дов относ€тс€ кислородсодержащие (H2O, CO, CO2), серусодержащие (H2S, CS2) вещества, непредельные углеводороды (C2H4, C2H2), ионы металлов (Cu2+, Sn2+, Hg2+, Fe2+, Co2+, Ni2+ и др.) ѕочти все биохимические реакции в растительных и животных организмах ускор€ютс€ биохимическими катализаторами - ферментами. ќтличительными особенност€ми ферментативного катализа €вл€ютс€ высока€ селективность (способность ускор€ть только определЄнные реакции) и способность фермента к обратимой инактивации.‘ерменты бывают двух типов: простые и сложные. ѕростые ферменты имеют только белковую природу (трипсин, уреаза-4), а сложные ферменты состо€т из белковой и небелковой части (кофермента). ¬ качестве кофермента могут выступать атомы т€желых металлов, витамины, гемины и т. д. ѕодробно ферментативный катализ будет рассмотрен позднее.Ќаконец, случай, когда катализатором €вл€етс€ один из продуктов реакции или еЄ исходных веществ, называют автокатализом.
ѕримером автокаталитической реакции €вл€етс€ гидролиз этилацетата:
CH3COOC2H5 + H2O = CH3COOH + C2H5OH.
Ёта реакци€ катализируетс€ ионами водорода, которые образуютс€ в результате диссоциации уксусной кислоты:
CH3COOH ⇄ CH3COO- + H+
2.4.1. инетика ферментативных реакций
ѕолный математический анализ ферментативной реакции приводит к сложным уравнени€м, мало пригодным дл€ практического применени€. Ќаиболее удобной оказалась проста€ модель, разработанна€ в 1913 г. Ћ. ћихаэлисом и ћ. ћентен. ћодель ћихаэлиса-ћентенисходит из того, что вначале субстрат S образует с ферментом E комплекс ES, который превращаетс€ в продукт P намного быстрее, чем в отсутствие фермента.
|
|
— целью упрощени€ модель предполагает, что E, S и ≈S наход€тс€ в химическом равновесии и константаћихаэлиса kћ характеризует сродствофермента к субстрату. ¬ысокое сродство фермента к субстрату характеризуетс€ низкой величиной kћ и наоборот.
—огласно закону действующих масс распад комплекса ES описываетс€ уравнением:
 .
.
ѕоскольку [E] = C0(E) - [ES], путем алгебраических преобразо-ваний получим:
|
|
|
 .
.
“ак как  , то скорость ферментативной реакции равна:
, то скорость ферментативной реакции равна:
 .
.
ѕроизведение kкат×C0(E) соответствует максимальной скорости реакции 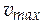 т. е. скорости, когда весь фермент находитс€ в составе фермент-субстратного комплекса.
т. е. скорости, когда весь фермент находитс€ в составе фермент-субстратного комплекса.
“аким образом, можно записать:
 , ,
| (28) |
ѕолученное соотношение известно как уравнение ћихаэлиса-ћентен. »з него можно сделать следующие выводы:
1) при большой концентрации субстрата [S] >> kM скорость реак-ции будет практически равна максимальной скорости, т. е.  ;
;
2) при малой концентрации субстрата [S] << kM скорость реакции будет пр€мо пропорциональна его концентрации, т. е.:

3) константа ћихаэлиса численно равна той концентрации субстрата [S] при которой  достигает половины максимальной величины
достигает половины максимальной величины  . ƒействительно, если
. ƒействительно, если  , то
, то  и
и 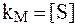 .
.
√рафическое изображение модели ћихаэлиса-ћентен представ-лено на рис. 5.

 от концентрации субстрата [S] при посто€нной концентрации фермента.
от концентрации субстрата [S] при посто€нной концентрации фермента. ”часток а соответствует случаю, когда [S] < kM, и реакци€ имеет первый кинетический пор€док. ”часток б (при средних значени€х концентрации субстрата) показывает, что реакци€ имеет смешанный пор€док. Ќаконец, участок в отвечает случаю, когда [S] >> kM, скорость реакции €вл€етс€ максимальной, и реакци€ имеет нулевой пор€док.
ќтметим, что уравнение ћихаэлиса-ћентен довольно точно описывает только начальный период ферментативного процесса, так как в нем не учитываетс€ вли€ние продуктов реакции и их взаимодействие с ферментом.
ѕример 4. ƒл€ некоторой ферментативной реакции константа ћихаэлиса равна 0,035 моль/л. —корость реакции при концентрации субстрата 0,115 моль/л равна 1,165.10-3 моль/(лЈс). Ќайти максимальную скорость этой реакции.
–ешение.
»з уравнени€ ћихаэлиса-ћентен получим:

ќсновы фармакокинетики
‘армакокинетика [10] - это раздел фармакологии, который изучает кинетические закономерности химических и биологических процессов, происход€щих с лекарственным средством в организме[11]. ‘армакокинетика содействует решению проблемы эффективности и безопасности фармакотерапии путем исследовани€ зависимости терапевтических, токсических и побочных эффектов лекарственных средств от их концентраций в месте действи€ или в анализируемой биологической среде (чаще всего в крови) и расчету оптимальных режимов введени€ препаратов дл€ создани€ и поддержани€ оптимальных концентраций лекарственных веществ.
ќсновы фармакокинетики были заложены в начале XX века. ¬клад в развитие этой науки внесли ученые разных специальностей и разных стран.
“ак, в 1913 г. немецкие биохимики Ћ. ћихаэлис и M. ћентен предложили уравнение кинетики ферментативных процессов, широко используемое в современной фармакокинетике дл€ описани€ метаболизма лекарственных средств.
Ўведские физиологи Ё. ¬идмарк, ƒ. “андберг (1924) и T. “еорелл (1937) применили методы математического анализа дл€ обработки и интерпретации данных фармакокинетического эксперимента.
ќсновы методологии изучени€ метаболизма лекарственных средств были заложены английскими биохимиками X. Ѕреем, ¬. “орпом и . ”айтом (1951).
ѕрактические аспекты применени€ фармакокинетики дл€ оптимизации фармакотерапии разрабатывали . Ћапп во ‘ранции (1948-56), ј. ван √емерт и др. в ƒании (1950), Ё. рюгер-“иммер (1960) и ‘. ƒост (1953-68) в √ермании (последний - автор термина Ђфармакокинетикаї).
¬ –оссии развитие фармакокинетики началось в 60-х гг. и св€зано с именами ¬. ј. ‘илова, ¬. H. —оловьева, ¬. ѕ. яковлева и р€да других специалистов.
ƒо 50-х годов XX века развитие фармакокинетики сдерживалось отсутствием высокочувствительных и селективных методов анализа микроконцентраций лекарственных веществ в биологических средах и недостаточной компьютеризацией исследований. — решением этих проблем фармакокинетика получила дальнейшее развитие.
|
|
|
¬ насто€щее врем€ дл€ определени€ микроконцентраций лекарственных веществ и продуктов их метаболизма используют следующие методы исследовани€: хроматографические, спектральные и иммунохимический.
’роматографи€ - это динамический сорбционный метод разделени€ и анализа смесей веществ, основанный на распределении веществ между двум€ фазами - подвижной и неподвижной.
—пектральные методы основаны на взаимодействии вещества с излучением и включают в себ€ спектры электромагнитного излучени€, акустических волн, распределени€ элементарных частиц по массам и энерги€м и др.
»ммунохимический метод - это лабораторный метод качественного и количественного определени€ различных соединений, в основе которого лежит специфическа€ реакци€ антиген-антитело.
ѕроника€ в организм больного любым путем (кроме внутривенного), лекарство проходит сначала фармацевтическую фазу, когда оно освобождаетс€ из лекарственной формы. «атем активна€ субстанци€ раствор€етс€ и наступает фармакокинетическа€ фаза, котора€ включает в себ€ абсорбцию, распределение, метаболизм и экскрецию (выведение).
јбсорбци€ (всасывание) - это процесс поступлени€ лекарственного средства (Ћ—) в кровь. ¬сасывание Ћ— зависит от пути его введени€ в организм, лекарственной формы, растворимости (в воде и в липидах), а также интенсивности кровотока в месте абсорбции. “ак, вещества основного характера всасываютс€ обычно в тонком кишечнике, вещества нейтрального или кислотного характера начинают всасыватьс€ уже в желудке.
¬ыбором оптимальной лекарственной формы Ћ—, определ€ющей пути и скорость всасывани€, способы введени€ лекарства занимаетс€ специальный раздел фармакокинетики - биофармаци€.
¬сосавшись, Ћ— распредел€етс€ между кровью, межклеточной жидкостью, и клетками тканей. –аспределение зависит от относительного сродства молекул лекарственного вещества к биомакромолекулам крови и тканей. Ќеобходимым условием реализации фармакологического действи€ лекарственного вещества €вл€етс€ его проникновение в ткани-мишени, тогда как попадание лекарственного вещества в индифферентные ткани снижает действующую концентрацию и может привести к нежелательным побочным эффектам (например, к канцерогенезу).
Ћекарственные вещества выдел€ютс€ из организма либо в неизменЄнном виде, либо в виде продуктов их биохимических превращений (метаболитов). Ќаиболее распространЄнными процессами метаболизма €вл€ютс€ окисление-восстановление, гидролиз, а также соединение (конъюгаци€) с остатками глюкуроновой, серной, уксусной кислот. ћетаболиты, как правило, более пол€рны и лучше растворимы в воде по сравнению с исходным лекарственным веществом, поэтому быстрее вывод€тс€ с мочой. “аким образом, биологическое значение метаболических превращений - это подготовка липорастворимых Ћ— к выведению из организма.
Ќаконец, экскреци€ (выведение) осуществл€етс€ при помощи различных выделительных систем. “ак, водорастворимые лекарствен-ные вещества вывод€тс€, как правило, через почки, а пол€рные вещества с высокой относительной молекул€рной массой (более 300) вывод€тс€ преимущественно с жЄлчью. ќстальные пути выделени€ менее интенсивны, но могут быть исследованы при изучении фармакокинетики. ¬ частности, нередко анализируют содержание лекарственного вещества в слюне, поскольку дл€ многих препаратов концентраци€ в слюне пропорциональна их концентрации в крови.
Ќа фармакокинетические процессы вли€ют различные факторы: способность лекарственной формы высвобождать активное начало, физические и химические свойства действующего вещества (размер молекулы, растворимость, липофильность и др.), объЄм органов и тканей, скорость потока крови через них, проницаемость капилл€ров и клеточных мембран, рЌ вне- и внутриклеточных сред, количество и активность метаболических ферментов, активность выделительных органов, а также возраст пациента, патологические и генетические факторы, климат, характер питани€ и т. д.
“аким образом, подбор препарата и режим его дозировани€ €вл€етс€ довольно трудоЄмкой задачей и требует учета индивидуальных особенностей пациента.
—итуационна€ задача є2
ƒл€ пациента требуетс€ разработать оптимальный режим дозировани€ препарата.
–ешение.
¬начале пациенту необходимо ввести нагрузочную дозу препарата. ƒалее через определЄнные промежутки времени брать на анализ кровь или мочу пациента и при помощи описанных выше методов определ€ть концентрацию препарата в биологической жидкости. ѕо результатам исследований построить фармакокинетическую кривую - зависимость концентрации препарата от времени. Ѕольшинство процессов, протекающих с участием лекарственного средства, имеют первый кинетический пор€док, и фармакокинетическа€ крива€ дл€ них имеет следующий вид (рис. 6).
|
|
|
”становленна€ зависимость позвол€ет определить период полувыведени€ (полуэлиминации) лекарственного препарата и по формуле (26) рассчитать константу скорости реакции. «на€ эти параметры можно рассчитывать концентрации препарата в любой момент времени и назначать режим его дозировани€.

–ис. 6. »зменение концентрации некоторого препарата в плазме крови.
ѕримеры решени€ задач
«адача є1
–еакци€ протекает по уравнению: 2A + B = C и имеет второй пор€док по веществу ј и первый по веществу B. ¬ начальный момент времени скорость реакции равна 15 моль/(л×с). –ассчитать константу скорости и скорость пр€мой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации веществ ј и B соответственно равны 10 и 5 моль/л. ак изменитс€ скорость химической реакции?
–ешение.
—огласно закону действующих масс:
 ;
;

—(B), вступившего в реакцию, равна:
—(B) = 0,5Ј5 = 2,5 моль/л.
—оответственно —(A), вступившего в реакцию, равна:

—(A) и —(B) после протекани€ реакции:
—(A) = 10 - 5 = 5 моль/л,
—(B) = 5 - 2,5 = 2,5 моль/л.
¬ заданный момент времени скорость реакции будет равна:

“аким образом, соотношение скоростей составит:

т. е. скорость реакции уменьшитс€ в 8 раз.
«адача є2
¬ обратимой газофазной реакции
A + 2B ⇄ 2C
скорости пр€мой и обратной реакций, протекающих в замкнутом сосуде, выражаютс€ уравнени€ми:


–ассчитать, как измен€тс€ скорости пр€мой и обратной реакций при увеличении давлени€ в равновесной системе в 3 раза.
–ешение.
ѕовышение общего давлени€ в газообразных системах приводит к аналогичному (симбатному) увеличению концентраций всех газов, что сопровождаетс€ увеличением скорости как пр€мой, так и обратной реакции.
ќбозначим концентрации газов в равновесной смеси [’]. ¬ случае трехкратного увеличени€ давлени€ можем записать:

“огда скорости пр€мой и обратной реакций станут равны:


“аким образом, скорость пр€мой реакции увеличитс€ в 27 раз, обратной - в 9.
«адача є3
–еакци€ при температуре 500— протекает за 2 мин 15 с. –ассчитать, за какое врем€ закончитс€ эта реакци€ при температуре 700—, если в данном температурном интервале g = 3.
–ешение.
ѕо правилу ¬ант-√оффа:

¬рем€ реакции обратно пропорционально скорости протекани€ реакции, следовательно:

где 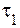 и
и  - времена протекани€ реакции при температурах
- времена протекани€ реакции при температурах  и
и  .
.
ќтсюда получаем:

”читыва€, что 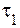 = 135 с (2 мин 15 с), определ€ем врем€ реакции при температуре
= 135 с (2 мин 15 с), определ€ем врем€ реакции при температуре  :
:

«адача є4
ѕри изучении кинетики выведени€ лекарственного препарата из организма больного было установлено, что через 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. ќпределить период полувыведени€ и константу скорости реакции выведени€ препарата из организма человека, если известно, что это реакци€ первого пор€дка.
–ешение.
“ак как за данный промежуток времени из организма было выведено 50% препарата, то t1/2 = 3 часа. онстанту скорости реакции рассчитаем из уравнени€:

«адача є5
ѕри лабораторных исследовани€х водных растворов лекарствен-ного средства было установлено, что вследствие гидролиза концентраци€ препарата за сутки уменьшилась от 0,05 до 0,03 моль/л. ¬ычислить период полупревращени€ реакции гидролиза препарата.
–ешение.
“ак как реакции гидролиза обычно протекают при значительном избытке воды, то еЄ концентрацию можно посто€нной. —ледо-вательно, в ходе реакции измен€етс€ только концентраци€ препарата и реакцию гидролиза можно считать реакцией псевдопервого пор€дка.
«начение константы скорости реакции найдем из уравнени€:

ќтсюда:

«адача є6
ѕериод полуэлиминации препарата из организма больного (реакци€ первого пор€дка) равен 5 часам. ќпределить врем€, за которое из организма будет выведено 75% препарата.
–ешение.
ѕри выведении из организма 75% препарата отношение —/—0 составит 0,25. ¬ данном случае удобно воспользоватьс€ формулой:
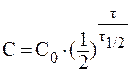
ќтсюда:


Ёту задачу можно также решить при помощи графической зависимости концентрации вещества от времени (рис. 6). ¬идно, что 75% (50% + 25%) будет выведено за 2 периода полуэлиминации (2t), т. е. за 10 часов.
«адача є7
онстанта скорости реакции гидролиза сахарозы равна 2,31×10-3 1/ч. –ассчитать:
1) период полупревращени€ сахарозы;
2) врем€, за которое гидролизу подвергнетс€ 20% сахарозы;
3) кака€ часть сахарозы подвергнетс€ гидролизу через 5 суток.
–ешение.
1) –азмерность константы скорости указывает на первый пор€док реакции. ѕериод полупревращени€ равен:

2) ѕосле того, как гидролизу подвергнетс€ 20% сахарозы, отношение —/—0 составит 0,8. —ледовательно:

3) „ерез 5 суток (120 часов) отношение —/—0 составит:
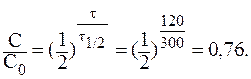
—ледовательно, гидролизу подвергнетс€ 24% сахарозы.
«адача є8
¬ ходе некоторой реакции первого пор€дка за 30 мин превращению подвергаетс€ 60% исходного количества вещества. ќпределить:
1) кака€ часть реагирующего вещества останетс€ через 1 час;
2) скорость реакции при концентрации реагирующего вещества 0,1 моль/л;
–ешение.
1) „ерез 30 минут количество оставшегос€ вещества составит:
—1 = —0 - 0,6—0 = 0,4×—0.
т.е., отношение —0/—1 равно 2,5.
Ќайдем константу скорости реакции:

оличество вещества —2, оставшеес€ через 1 час, определим по формуле:

“аким образом, через 1 час останетс€ 16% от исходного вещества.
2) —огласно закону действующих масс:

«адача є9
Ёнерги€ активации реакции кислотного гидролиза сахарозы при 370— равна 102 кƒж/моль, а в присутствии фермента снижаетс€ до 35 кƒж/моль. ќпределить, во сколько раз увеличиваетс€ скорость реакции.
–ешение.
ќтношение скоростей реакции при различных услови€х можно представить как отношение соответствующих констант:
 ,
,
которое, в свою очередь, определ€етс€ уравнением јррениуса:

«адача є10
ѕри температурах 36 и 410— значени€ константы скорости распада пенициллина составл€ют 6×10-6 и 1,2×10-5 1/с. –ассчитать:
1) энергию активации реакции;
2) значение константы скорости реакции при 380—;
3) температурный коэффициент скорости реакции.
–ешение.
1) »з уравнени€ (24¢¢¢):
| T1 = 36 + 273 = 309 K | T2 = 41 + 273 = 314 K |

 2) Ќайдем соотношение констант скоростей при 36 и 380— (T3):
2) Ќайдем соотношение констант скоростей при 36 и 380— (T3):
 .
.

ќтсюда:

3) —огласно закону действующих масс и правилу ¬ант-√оффа:




«адача є11
¬ычислить энергию активации реакции спиртового брожени€ глюкозы, если в интервале температур от 200— до 400— g = 2.
–ешение.
омбиниру€ уравнение јррениуса (24¢¢) и математическое выражение правила ¬ант-√оффа (23) получим:
 .
.
ќтсюда:
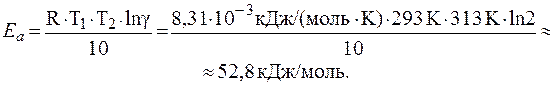
¬опросы дл€ самоконтрол€
1. „то называетс€ скоростью химической реакции?
2. „то называетс€ истинной скоростью гомогенной реакции?
3. акова размерность скорости гомогенной реакции?
4. „то называетс€ скоростью гетерогенной реакции?
5. акова размерность скорости гетерогенной реакции?
6. ѕеречислите факторы, вли€ющие на скорость реакции.
7. —формулируйте закон действующих масс.
8. аков физический смысл константы скорости реакции? ќт чего зависит и от чего не зависит константа скорости реакции?
9. „то называетс€ пор€дком реакции? ѕриведите примеры уравнений реакций нулевого, первого, второго и третьего пор€дков.
10. «ависит ли размерность константы скорости реакции от пор€дка реакции?
11. „то называетс€ молекул€рностью реакции?
12. ѕо какой формуле можно рассчитать период полупрев-ращени€ вещества в реакции первого пор€дка?
13. ƒайте определение простым и сложным реакци€м. ѕриведите классификацию сложных реакций.
14. —формулируйте правило ¬ант-√оффа. ѕриведите математи-ческое выражение правила ¬ант-√оффа.
15. ак скорость реакции зависит от энергии активации? Ќапишите уравнение јррениуса.
16. „то такое активированный комплекс?
17. „то называетс€ катализатором? √омогенный и гетерогенный катализ. ѕочему в присутствии катализаторов реакции измен€ют скорость?
18. „то такое ферментативный катализ? Ќапишите уравнение ћихаэлиса-ћентен.
¬арианты задач дл€ самосто€тельного решени€
¬ариант є 1
1. –еакци€ между веществами ј и ¬ выражаетс€ уравнением 2ј + ¬ = — и имеет второй пор€док по веществу ј и первый по веществу B. »сходные концентрации веществ соответственно равны 0,4 и 0,8 моль/л; k = 0,6 л2/(моль2 мин).
–ассчитать:
1) начальную скорость реакции и скорость в момент времени, когда концентраци€ вещества ј уменьшитс€ на 0,2 моль/л;
2) как и во сколько раз изменитс€ скорость реакции, если концентрацию ј увеличить в 2 раза, а концентрацию ¬ в 2 раза уменьшить;
3) на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 8 раз, если g = 2.
2. онстанта скорости реакции инверсии тростникового сахара равна 5,3×10-3 1/мин. ќпределить врем€, через которое прореагирует 75% сахара.
3. ќпределить энергию активации реакции, если при повышении температуры от 220— до 320— скорость реакции увеличитс€ в 2 раза.
¬ариант є 2
1. –еакци€ 2A + B = 2C протекает в газовой фазе. ѕр€ма€ реакци€ имеет второй пор€док по веществу ј и первый по веществу B. ќбратна€ реакци€ имеет второй пор€док по веществу C.
–ассчитать:
1) как и во сколько раз изменитс€ скорость пр€мой реакции, если увеличить давление в системе в 2 раза;
2) как и во сколько раз изменитс€ скорость обратной реакции, если концентраци€ — увеличитс€ на 30%;
3) врем€ окончани€ реакции при 700C, если при 500— она заканчиваетс€ за 10 минут, а g= 2,5.
2. ѕри лечении онкологических заболеваний в организм пациента ввод€т препарат, содержащий радиоактивный изотоп. —чита€ радиоактивный распад реакцией первого пор€дка, определить кака€ часть радионуклида останетс€ в организме больного через 30 суток, если период полураспада составл€ет 130 суток.
3. ѕри температурах 27 и 500— значени€ константы скорости некоторой реакции составл€ют 0,1 и 0,28 1/мин. ќпределить энергию активации и температуру, при которой величина константы составит 0,5 1/мин.
¬ариант є 3
1. –еакци€ протекает по уравнению: 2A + 3B = 4C + 2D и имеет первый пор€док и по веществу ј, и по веществу B. »сходные концентрации веществ соответственно равны 2 и 3 моль/л; k = 0,8 л/(моль мин).
–ассчитать:
1) начальную скорость реакции и скорость в момент времени, когда прореагирует 40% ј;
2) как и во сколько раз изменитс€ скорость реакции, если концентрацию ј увеличить от 2 до 8 моль/л, а концентрацию ¬ уменьшить от 3 до 1,5 моль/л;
3) температурный коэффициент реакции g, если при повышении температуры на 200— скорость реакции увеличилась в 9 раз.
2. ѕри хранении таблеток анальгина установлено, что константа скорости разложени€ препарата при 200— составл€ет 1,5×10-9 1/c. Ќайти срок хранени€ таблеток (врем€ разложени€ 10% вещества).
3. онстанта скорости реакции разложени€ новокаина при 250— равна 3,5×10-6 1/сут, а при 400— составл€ет 1×10-5 1/сут. ќпределить энергию активации и значение константы скорости при 300—.
¬ариант є 4
1. –еакци€ протекает в газовой фазе по уравнению A + 2B = 2C. ƒл€ пр€мой элементарной реакции рассчитать:
1) как и во сколько раз изменитс€ скорость реакции, если объЄм реактора увеличить в 3 раза;
2) как и во сколько раз изменитс€ скорость реакции, если концентраци€ ¬ увеличитс€ на 40%;
3) температуру, при которой реакци€ закончитс€ за 20 секунд, если, име€ g= 2, при 200— она заканчиваетс€ за 1 минуту 20 секунд.
2. –еакци€ первого пор€дка проходит на 30% за 15 мин. ¬ычислить:
1) кака€ часть реагирующего вещества останетс€ через 30 минут;
2) скорость реакции при концентрации реагирующего вещества 0,05 моль/л.
3. ѕри температурах 250 и 400— значени€ константы скорости некоторой реакции составл€ют 0,009 и 0,08 1/мин. ќпределить энергию активации этой реакции и константу скорости при 700—.
¬ариант є 5
1. –еакци€ выражаетс€ уравнением: 4A + 2B = 3C + 2D и имеет первый пор€док по веществу ј и второй по веществу B. ѕри начальных концентраци€х ј и B, равных соответственно 3 и 5 моль/л, скорость пр€мой реакции равна 0,3 моль/(л×с).
–ассчитать:
1) константу скорости и скорость реакции в момент времени, когда концентраци€ A уменьшитс€ на 2 моль/л;
2) как и во сколько раз изменитс€ скорость реакции, если концентрацию ј увеличить в 3 раза, а концентрацию ¬ уменьшить в 2 раза;
3) на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 27 раз, если g = 3.
2. ¬о врем€ аварии на „ернобыльской јЁ— (1986 г.) произошел выброс радионуклида Cs-137, период полураспада которого составл€ет 30 лет. –ассчитать, кака€ часть попавшего тогда в организм радионуклида осталась в насто€щее врем€.
3. ќпределить, во сколько раз увеличитс€ скорость реакции в присутствии катализатора, если энерги€ активации реакции уменьшаетс€ на 50 кƒж/моль. “емпература реакции равна 250—.
¬ариант є 6
1. ¬ закрытом сосуде находитс€ смесь газов, состо€ща€ из 1 моль A и 3 моль B, котора€ реагирует по уравнению: A + 3B = 2C. —корость пр€мой реакции описываетс€ уравнением:

–ассчитать:
1) как и во сколько раз изменитс€ скорость пр€мой реакции после того как прореагирует 0,5 моль A;
2) как и во сколько раз изменитс€ скорость пр€мой реакции, если объЄм реактора увеличить в 3 раза;
3) врем€ окончани€ реакции при 300C, если при 500— она заканчиваетс€ за 5 минут, а g= 2.
2. ¬ ходе лабораторных исследований было установлено, что за сутки концентраци€ препарата в организме больного снизилась от 0,1 моль/л до 0,02 моль/л. ¬ычислить период полуэлиминации препарата, счита€, что данна€ реакци€ первого пор€дка.
3. Ёнерги€ активации реакции разложени€ спазмолитина в растворе равна 75 кƒж/моль. ќпределить, во сколько раз увеличитс€ скорость разложени€ при повышении температуры от 25 до 400—.
¬ариант є7
1. –еакци€ протекает по уравнению: 2A + B = 2C и имеет второй пор€док по веществу ј и первый по веществу B. »сходные концентрации веществ соответственно равны 8 и 4 моль/л;
k = 0,5 л2/(моль2 мин).
–ассчитать:
1) начальную скорость реакции и скорость в момент времени, когда прореагирует 25% ј;
2) как и во сколько раз изменитс€ скорость реакции, если концентрацию ј уменьшить от 8 до 4 моль/л, а концентрацию ¬ увеличить от 4 до 8 моль/л;
3) температурный коэффициент реакции g, если при повышении температуры на 300— скорость реакции увеличилась в 27 раз.
2. –ассчитать, кака€ часть препарата мебикар останетс€ в организме человека через 10 часов после введени€, если константа скорости реакции составл€ет 0,231 1/ч.
3. Ёнерги€ активации гидролиза сахарозы при 370— в присутствии ионов Ќ+ равна 107,5 кƒж/моль, а в присутствии фермента сахаразы составл€ет 34,9 кƒж/моль. ќпределить во сколько раз быстрее протекает ферментативна€ реакци€.
¬ариант є8
1. ¬ растворе объЄмом 1 л, содержащем 1 моль вещества A и 2 моль вещества B, протекает реакци€: A + 3B = 2C + D. ѕр€ма€ реакци€ имеет первый пор€док по веществу ј и второй по веществу B.
–ассчитать:
1) как и во сколько раз изменитс€ скорость реакции, если раствор разбавить в 2 раза;
2) как и во сколько раз изменитс€ скорость реакции после того, как прореагирует 0,35 моль вещества A;
3) температуру, при которой реакци€ закончитс€ за 30 секунд, если, име€ g= 3, при 250— она заканчиваетс€ за 1,5 минуты.
2. –азложение препарата ЂЌо-шпаї в организме человека характеризуетс€ периодом полупревращени€, равным 2 часам. ќпределить врем€, за которое разложению подвергнетс€ 40% препарата.
3. онстанта скорости некоторой реакции при 200— равна 0,055 1/мин, при 450— составл€ет 0,165 1/мин. ќпределите энергию активации этой реакции и значение константы скорости при 350—.
¬ариант є9
1. –еакци€ протекает по уравнению: 2Aгаз = Bгаз + Cтв. и имеет второй пор€док по веществу ј. –ассчитать:
1) во сколько раз следует увеличить давление в системе, чтобы повысить скорость реакции в 64 раза;
2) как и во сколько раз изменитс€ скорость реакции после того, как прореагирует 25% ј;
3) на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 16 раз, если g = 2.
2. –еакци€ первого пор€дка при 250— завершаетс€ на 70% за 15 минут. ќпределить врем€, за которое реакци€ завершитс€ на 90%.
3. “емпературный коэффициент реакции первого пор€дка равен 2,5. –ассчитать за какое врем€ разложитс€ половина вещества при 500—, если при 300— половина вещества разлагаетс€ за 1,5 часа.
¬ариант є10
1. Ќекотора€ ферментативна€ реакци€ протекает по уравнению: A + B = C и имеет второй пор€док по веществу ј и нулевой по веществу B. “емпературный коэффициент g = 4. ќпределить, как и во сколько раз изменитс€ скорость пр€мой реакции, если:
1) концентрацию ј увеличить в 2 раза;
2) концентрацию B уменьшить в 2 раза;
3) снизить температуру от 36,6 до 31,60C.
2. √идролиз некоторого гормона €вл€етс€ реакцией 1 пор€дка с константой скорости 0,125 1/лет. ќпределить концентрацию гормона в организме через 1 мес€ц, если начальна€ концентраци€ составл€ла 0,01 моль/л.
3. ќпределить энергию активации, если при возрастании темпера-туры от 400— до 600— скорость реакции увеличилась в 3,5 раза.
¬ариант є11
1. Ёлементарна€ реакци€ протекает в газовой фазе по уравнению A + B = 2C. “емпературный коэффициент g = 2,5. ќпределить, как и во сколько раз изменитс€ скорость реакции, если:
1) увеличить концентрацию ј в 2 раза;
2) уменьшить давление в системе в 3 раза;
3) повысить температуру от -5 до +150—.
2. онстанта скорости реакции разложени€ пероксида водорода равна 0,05 1/мин. ќпределить, кака€ часть вещества останетс€ через 25 минут.
3. —равните скорости каталитической и некаталитической реакции, протекающей при 500—, если без катализатора энерги€ активации реакции равна ≈а = 150 кƒж/моль, а в присутствии катализатора уменьшаетс€ на 50 кƒж/моль.
¬ариант є12
1. –еакци€ протекает по уравнению A + B = 2C и имеет первый пор€док по ј и 0,5 по B. »сходные концентрации веществ составили 0,25 моль/л, начальна€ скорость реакции была равна 5Ј10-4 моль/(л×с).
–ассчитать:
1) константу скорости реакции и скорость реакции в момент, когда прореагирует 0,09 моль/л вещества B;
2) как и во сколько раз изменитс€ скорость реакции, если снизить концентрацию ј вдвое, а концентрацию B увеличить в 4 раза;
3) температурный коэффициент реакции g, если при понижении температуры на 200— скорость реакции уменьшилась в 16 раз.
2. ѕеренос этилового спирта из желудочно-кишечного тракта в кровоток подчин€етс€ кинетике 1 пор€дка с периодом полупревра-щени€, равным 4 минутам. Ќайти скорость всасывани€ этанола при концентрации спирта 0,1 моль/л.
3. онстанта скорости гидролиза сахарозы при температуре 250— равна 0,75 л/(моль×мин), а при температуре 550— составл€ет 35,5 л/(моль×мин). –ассчитать энергию активации этой реакции и константу скорости при 700—.
¬ариант є13
1. –еакци€ протекает по уравнению: 2A + B = 2C и имеет второй пор€док по веществу ј и первый по веществу B. »сходные концентрации ј и B соответственно равны 0,4 и 0,9 моль/л. онстанта скорости реакции равна 5×10-2 л2/(моль2×с). “емпературный коэффициент gравен 2.
–ассчитать:
1) начальную скорость реакции и скорость к моменту образова-ни€ 0,1 моль вещества —;
2) как и во сколько раз изменитс€ скорость реакции, если концен-трацию ј увеличить в 2 раза, а концентрацию B в 3 раза уменьшить;
3) при какой температуре реакци€ закончитс€ за 20 минут, если при 100— реакци€ протекает за 1 час 20 минут.
2. ƒл€ изучени€ натриевого баланса в живых организмах используетс€ хлорид натри€-24. ¬о врем€ испытаний за 35 часов содержание этого вещества в образце уменьшилось от 0,05 мг до 0,02 мг. –ассчитать период полураспада хлорид натри€-24.
3. –азложение некоторого лекарственного препарата €вл€етс€ реакцией первого пор€дка с энергией активации 90 кƒж/моль. ѕри 250— за 10 мин в реакцию вступает 40% вещества. ќпределить, кака€ часть вещества разложитс€ за это же врем€ при 350—.
¬ариант є14
1. –еакци€ протекает в растворе по уравнению: A + 3B = 2C и имеет первый пор€док по веществу ј и второй по веществу B. »сходные концентрации веществ ј и B соответственно равны 2 и 6 моль/л. k = 0,01 л2/(моль2×с).
–ассчитать:
1) начальную скорость реакции и скорость реакции в момент, когда в реакцию вступит 1 моль вещества ј;
2) как и во сколько раз изменитс€ скорость реакции, если раствор разбавить в 2 раза;
3) на сколько градусов необходимо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если g = 3.
2. онстанта скорости гидролиза пестицида равна 4,5×10-6 1/мин. Ќачальна€ концентраци€ пестицида составила 0,12 моль/л. Ќайти скорость реакции по истечении двух периодов полупревращени€.
3. ƒенатураци€ вируса €вл€етс€ реакцией первого пор€дка с энергией активации 650 кƒж/моль. ѕри 300— период полупревращени€ равен 6 часам. –ассчитать период полупревращени€ при 370—.
¬ариант є15
1. —корость пр€мой газофазной реакции 3A + B = C выражаетс€ уравнением:  »сходные концентрации веществ ј и B соответственно равны 3 и 1 моль/л. k = 0,05 л2/(моль2 с).
»сходные концентрации веществ ј и B соответственно равны 3 и 1 моль/л. k = 0,05 л2/(моль2 с).
–ассчитать:
1) начальную скорость реакции и скорость реакции после того как прореагирует 0,9 моль A;
2) как и во сколько раз изменитс€ скорость пр€мой реакции, если объЄм реактора увеличить в 3 раза;
3) врем€ окончани€ реакции при 450C, если при 250— она заканчиваетс€ за 1 мин 40 секунд, а g= 4.
2. онстанта скорости реакции гидролиза этилового эфира фенилаланина равна 2,7×10-3 1/с. ќпределить врем€, за которое концентраци€ эфира снизитс€ от 0,1 до 0,05 моль/л.
3. ¬ычислить энергию активации реакции гидролиза этилацетата в интервале от 30 до 500—, если g= 1,8.
¬ариант є16
1. –еакци€ между веществами ј и ¬ протекает по уравнению: A + 2B = C и имеет первый пор€док по и веществу ј и по веществу ¬. »сходные концентрации веществ ј и B соответственно равны 3 и 5 моль/л. k = 0,4 л/(моль с).
–ассчитать:
1) начальную скорость реакции и скорость реакции после того как прореагирует 40% моль A;
2) как и во сколько раз изменитс€ скорость пр€мой реакции, если концентрацию A увеличить в 2 раза, а концентрацию B увеличить в 3 раза.
3) температурный коэффициент реакции g, если при повышении температуры на 200— скорость реакции увеличилась в 6,25 раза.
2. онстанта скорости гидролиза атропина при 400— равна 0,316 1/с. ќпределить, кака€ часть атропина останетс€ через 10 секунд после начала реакции.
3. ѕериод полупревращени€ реакции инверсии тростникового сахара, имеющей первый кинетический пор€док, при 250— равен 71,66 мин, а при 400— составл€ет 9,44 мин. ќпределить энергию активации данной реакции в указанном интервале температур.
¬ариант є17
1. –еакци€ выражаетс€ уравнением: A + 2B = C + D и имеет первый пор€док по и веществу ј и веществу B. ѕри начальных концентраци€х ј и B, равных соответственно 3 и 4 моль/л, скорость пр€мой реакции равна 1,2×10-3 моль/(л×с).
–ассчитать:
1) константу скорости и скорость реакции в момент времени, когда прореагирует 75% A;
2) как и во сколько раз изменитс€ скорость реакции, если концентрации реагентов уменьшить в 4 раза;
3) на сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 81 раз, если g = 3.
2. ћинеральные воды содержат повышенное количество изотопа радона-222, период полураспада которого равен 3,8 суток. ќпределить врем€, за которое распадетс€ 85% радионуклида.
3. ћуравьина€ кислота разлагаетс€ на оксид углерода (IV) и водород на поверхности золота. Ёнерги€ активации этой реакции составл€ет 98,4 кƒж/моль. ќпределить температуру, при которой константа скорости будет равна 0,01 1/мин, если при 1400— она равна 5,5×10-4 1/мин.
¬ариант є18
1. –еакци€ 2A + B ⇄ C + 2D протекает в газовой фазе и подчин€етс€ уравнени€м:

–ассчитать:
1) как и во сколько раз изменитс€ скорость пр€мой реакции, если увеличить давление в системе в 3 раза;
2) как и во сколько раз изменитс€ скорость обратной реакции, если объЄм системы уменьшить в 9 раз;
3) врем€ окончани€ реакции при 300C, если при 500— она заканчиваетс€ за 10 минут, а g= 3,5.
2. онстанта скорости гидролиза пестицида при 250— равна 0,32 1/с. –ассчитать врем€, за которое массова€ дол€ пестицида снизитс€ от 2,5 до 0,5%.
3. ѕри 600— константа скорости реакции первого пор€дка составл€ет 0,25 1/ч. ѕериод полупревращени€ вещества в этой же реакции в присутствии катализатора составл€ет 50 секунд. ¬ычислить, как и на сколько изменитс€ энерги€ активации, счита€, что величина пред-экспоненциального множител€ не мен€етс€.






