√лава 1. Ёнергетика химических реакций
¬рач в своей работе посто€нно имеет дело с физическими и химическими процессами, протекающими в организме как здорового, так и больного человека. Ёти процессы неразрывно св€заны с изменени€ми общей энергетики живого организма, пополн€емой за счет потребл€емой пищи и солнечного излучени€ и расходуемой при теплообмене с окружающей средой и совершении работы.
¬первые взаимосв€зь химических превращений и энергетических процессов в организме была продемонстрирована ј. Ћавуазье (1743 Ц 1794) и ѕ. Ћапласом (1749 Ц 1827), которые показали, что энерги€, выдел€ема€ в процессе жизнеде€тельности, есть результат окислени€ продуктов питани€ кислородом вдыхаемого воздуха.
— развитием классической термодинамики в XIX Ц XX вв. по€вилась возможность рассчитывать энергетические превращени€ в биохимических процессах и предсказывать их направление.
ќбласть науки, занимающа€с€ изучением трансформации энергии в живых организмах, называетс€ биоэнергетикой. Ёта наука, в частности, позвол€ет ответить на следующие вопросы:
1) акова калорийность пищи?
2) акое количество теплоты тер€етс€ при потоотделении?
3) акую работу совершает организм в состо€нии поко€ (вентил€ци€ лЄгких) и при физической нагрузке (раст€жение и сокращение мышц)?
роме того, знание термодинамических закономерностей процессов обмена веществ и энергии в организме человека может быть использовано дл€ диагностики р€да заболеваний (онкологических, деструктивных, эмбриональных и др.), дл€ которых термодинамические параметры измен€ютс€ в зависимости от течени€ процесса (нормальный или патологический).
ќсновы термодинамики
“ермодинамика - это наука, котора€ изучает взаимные превращени€ теплоты и работы. ’имическа€ термодинамика примен€ет термодинамические методы дл€ решени€ химических задач, т.е. дл€ теоретического описани€ различных видов химических или фазовых равновесий и свойств веществ в растворах.
ќсновна€ физическа€ величина, используема€ в термодинамике, - это энерги€. ¬есь математический аппарат термодинамики построен на законе сохранени€ энергии:
Ёнерги€ не создаЄтс€ из ничего и не может превратитьс€ в ничто; если в ходе процесса исчезает энерги€ определЄнного вида, то взамен по€вл€етс€ эквивалентное количество энергии другого вида.
ќбъект внимани€ термодинамики Ц внутренн€€ энерги€.
¬нутренн€€ энерги€ U системы - это суммарна€ энерги€ всех еЄ составных частей, (в том числе молекул, атомов, электронов, €дер, внутри€дерных частиц и т.д.) [1]. ќна складываетс€ из кинетической энергии их движени€, потенциальной энергии их взаимодействи€ между собой, а также их собственной энергии, отвечающей массе поко€ частиц: E = mc2 (см. теорию относительности ј. Ёйнштейна).
“.к. окончательно строение материи неизвестно (и не будет известно никогда), то учесть все виды взаимодействи€ всех видов частиц невозможно, т.е. невозможно знать абсолютное значение U. Ќо термодинамика в этом знании и не нуждаетс€, т.к. имеет дело с изменением энергии DU.
|
|
|
¬нутренн€€ энерги€, естественно, может измен€тьс€. ”пор€доченную макроскопическую форму изменени€ внутренней энергии называют работой ј, неупор€доченную микрофизическую - теплотой Q.
“ермодинамика изучает в качествеобъекта термодинамическую систему.
“ермодинамическа€ система - это совокупность тел или веществ, выделенна€ из окружающего пространства реальными или мнимыми границами.
¬ыделенна€ из окружающей среды система может быть изучена термодинамическими методами только в том случае, если имеетс€ возможность проследить за всеми процессами обмена между системой и окружающей средой.
ѕо типу взаимодействи€ системы с окружающей средой различают:
открытые системы - возможен теплообмен и обмен массой;
закрытые системы - возможен теплообмен, но нет обмена массой;
изолированные системы - невозможен ни теплообмен, ни обмен массой.
ѕримерами открытой системы может служить любой живой организм, сломанный зуб, закрытой - запа€нна€ ампула с веществом, вылеченный зуб, изолированной - наша ¬селенна€ или даже термос[2].
—войства термодинамической системы, а также €влени€, св€занные с взаимными превращени€ми теплоты и работы, описывают при помощи термодинамических параметров.
»змер€емые термодинамические параметры - это давление p, объЄм V, температура T, количество вещества n и другие.
Ќеизмер€емые (вычисл€емые) термодинамические параметры - это энерги€ U, энтальпи€ H, энтропи€ S и другие.
—осто€ние системы называют равновесным, если все параметры остаютс€ посто€нными во времени, и в системе отсутствуют потоки вещества и энергии. ≈сли параметры системы посто€нны во времени, но имеютс€ потоки вещества и энергии, состо€ние называют стационарным.
“ермодинамический процесс св€зан с изменением хот€ бы одного термодинамического параметра. ѕосто€нство определЄнного параметра в ходе процесса отмечают приставкой изо-:
изохорный процесс - при посто€нном объЄме;
изобарный процесс - при посто€нном давлении;
изотермический процесс - при посто€нной температуре
ѕроцесс, протекающий без теплообмена с окружающей средой, называют адиабатическим или адиабатным. адиабатным обычно относ€т очень быстрые процессы, счита€, что за малое врем€ теплообмен просто не успевает произойти.
ѕроцесс, протекающий под действием бесконечно малой разности внешних сил, называют равновесным или квазистатическим. ¬ таком случае система проходит через р€д промежуточных равновесных состо€ний по аналогии с движением канатоходца.
ѕроцесс называют обратимым, если переход системы из состо€ни€ 1 в состо€ние 2 и обратно возможен по одному и тому же пути и после возвращени€ в исходное состо€ние в окружающей среде не остаетс€ никаких макроскопических изменений.
“аковыми €вл€ютс€, например, процессы сжати€-расширени€ газа или зар€дки-разр€дки аккумул€тора (теоретически). ¬се обратимые процессы €вл€ютс€ равновесными.Ќо равновесный процесс необ€зательно €вл€етс€ обратимым.
¬ необратимых процессах после возвращени€ в исходное состо€ние часть работы переходит в теплоту. необратимым процессам относ€тс€ самопроизвольные, т.е. протекающие без посто€нного воздействи€ на систему извне.
лассическа€ термодинамика изучает только свойства равновесных систем. ¬ этой св€зи, в классической термодинамике используетс€ р€д допущений. ѕрежде всего, это постулат о термодинамическом равновесии системы, согласно которому:
Ћюба€ система с течением времени придет к равновесному состо€нию.
|
|
|
≈щЄ один постулат классической термодинамики - это постулат о существовании температуры:
≈сли системы ј, B и C наход€тс€ между собой в состо€нии термодинамического (теплового) равновеси€, то TA = TB = TC.
»ными словами, в термодинамике температура определ€етс€ как обобщЄнна€ сила, отвечающа€ теплообмену.
Ёти постулаты представл€ютс€ достаточно очевидными, но они необходимы дл€ построени€ строгого математического аппарата термодинамики.
—осто€ние системы прин€то описывать при помощи переменных, значени€ которых принимают вполне определЄнные значени€ дл€ любого состо€ни€ системы, но при этом не завис€т от способа достижени€ данного состо€ни€[3].
“акие переменные называют функци€ми состо€ни€.
‘ункци€ми состо€ни€ €вл€ютс€: объЄм V, давление p, внутренн€€ энерги€ U, энтальпи€ H, энтропи€ S, свободна€ энерги€ √иббса (изобарно-изотермический потенциал) G и другие.
–абота A и теплота Q функци€ми состо€ни€ не €вл€ютс€, так как завис€т от пути, по которому система переходит из одного состо€ни€ в другое.
ƒл€ макроскопических систем энерги€ не €вл€етс€ непосредственно измер€емой величиной. »зменение внутренней энергии определ€етс€ из соотношени€:
DU = U2 (конечное состо€ние) - U1 (начальное состо€ние)
“ермодинамика позвол€ет вычислить изменение энергии на основе опытных данных. ƒл€ этого необходимо учесть теплообмен между системой и окружающей средой (количество теплоты) и измерить работу, совершаемую системой над окружающей средой (или средой над системой).
—оотношение между теплотой и работой установлено в I законе (начале) термодинамики, который представл€ет собой не что иное, как частную формулировку закона сохранени€ энергии:
»зменение внутренней энергии системы DU равно сумме количества теплоты Q, переданного системе, и работы ј, совершЄнной окружающей средой над системой:
| DU = Q + A, | (1) |
ƒруга€ формулировка:
»зменение внутренней энергии системы DU равно разности количества теплоты Q, переданного системе, и работы ј, совершЄнной системой против внешних сил:
| DU = Q - A. | (2) |
Ќа основании I закона термодинамикиможно заключить, что при различных способах перехода макроскопической системы из одного состо€ни€ в другое, алгебраическа€ сумма Q + A остаЄтс€ неизменной, следовательно, система не может ни создавать, ни уничтожать энергию.
Ётот вывод подтверждаетс€ многочисленными опытными данными.
“аким образом, величины DU, Q и A имеют одинаковую размерность - размерность энергии. ¬ насто€щее врем€ в —» единицей энергии €вл€етс€ ƒжоуль (ƒж) и производные от него мƒж, кƒж и т.д. ¬ некоторых случа€х используетс€ внесистемна€ единица - калори€ (килокалори€) кал (ккал), 1 ƒж = 0,239 кал.
—оотношение между внутренней энергией и работой зависит от условий протекани€ процесса. “ак, в изохорном процессе: DV = 0, A = p×DV = 0.
—ледовательно:
| Q v = DU. | (3) |
“аким образом, в изохорном процессе количество теплоты, полученное системой, целиком идет на увеличение внутренней энергии.
¬ изобарном процессе работа определ€етс€ как A = p×DV, и можно записать:
| Qp = DU + pDV = U2 - U1 + p(V2 - V1) = = (U2 + pV2) - (U1 + pV1) = H2 - H1 = DH. | (4) |
¬еличина
| U + pV º H | (5) |
называетс€ энтальпией системы.
Ёнтальпи€H - термодинамическа€ функци€ состо€ни€ системы, примен€ема€ дл€ изобарных процессов. ќна включает в себ€ внутреннюю энергию и работу по преодолению внешнего давлени€.
јбсолютное значение энтальпии ни рассчитать, ни измерить невозможно, но можно определить изменение энтальпии DЌ в результате протекани€ процесса:
DH = H2 (конечное состо€ние) - H1 (начальное состо€ние).
“аким образом, внутренн€€ энерги€ и энтальпи€ представл€ют собой взаимно дополн€ющие друг друга функции: перва€ отражает теплопередачу при посто€нном объЄме, втора€ - при посто€нном давлении.
1.2. “ермохимические уравнени€ и расчЄты
¬се химические реакции сопровождаютс€ выделением или поглощением теплоты. –аздел химической термодинамики, изучающий тепловые эффекты химических реакций, называетс€ термохимией.
|
|
|
“еплотой реакции Q называетс€ количество теплоты, поглощаемой из окружающей среды или выдел€емой в окружающую среду в ходе превращени€ исходных веществ (реагентов) в продукты реакции при определЄнных температуре и давлении.
¬ термохимии, когда говор€т о тепловом эффекте реакции, обычно имеют в виду DHр-€. ѕричЄм, Q и DHр-€ Ц это одна и та же энерги€, рассмотренна€ с разных позиций:
Q Ц c позиции внешнего наблюдател€ химической системы;
DHр-€ Ц с позиции самой химической системы.
ѕоэтому DHр-€ = Ц Q.
–еакции, которые протекают с выделением теплоты, называютс€ экзотермическими. ƒл€ таких реакций Q > 0, DЌ < 0.
–еакции, которые протекают с поглощением теплоты, называютс€ эндотермическими: Q < 0, DЌ > 0.
“ак как значени€ тепловых эффектов завис€т от внешних условий (температуры, давлени€ и др.), то дл€ того, чтобы иметь возможность сравнивать тепловые эффекты различных реакций, термохимические измерени€ провод€т при одинаковых услови€х, а именно:
1) в реакции участвуют индивидуальные вещества в их наиболее устойчивых модификаци€х;
2) концентрации реагентов составл€ют 1 моль вещества на 1 кг растворител€;
3) температура равна 250— (298,15 K);
4) давление соответствует 1 атм (760 мм рт. ст.; 101325 ѕа).
“акие услови€ называют стандартными.
«а стандартное состо€ние (обозначают верхним индексом 0) прин€то устойчивое состо€ние вещества (устойчива€ модификаци€ - дл€ веществ в конденсированном состо€нии; состо€ние идеального газа - дл€ газов), в котором оно существует при давлении 101,3 кѕа и данной температуре (обычно 298 K, но это требование не €вл€етс€ об€зательным).
“ак, величина 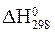 (читаетс€ Ђдельта аш стандартноеї) Ц это значение стандартной энтальпии[4] реакции, измеренное при
(читаетс€ Ђдельта аш стандартноеї) Ц это значение стандартной энтальпии[4] реакции, измеренное при
p = 101,3 кѕа и T = 298 K. ¬еличина 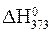 тоже €вл€етс€ стандартной, несмотр€ на другую температуру.
тоже €вл€етс€ стандартной, несмотр€ на другую температуру.
—тандартной энтальпией образовани€ вещества ( ) называют изменение энтальпии реакции образовани€ 1 моль данного вещества из соответствующих простых веществ, вз€тых в стандартном состо€нии при стандартных услови€х. Ќапример:
) называют изменение энтальпии реакции образовани€ 1 моль данного вещества из соответствующих простых веществ, вз€тых в стандартном состо€нии при стандартных услови€х. Ќапример:
C(тв.) + ќ2(газ) = —ќ2(газ) + 394 кƒж;  CO2 = -394 кƒж/моль.
CO2 = -394 кƒж/моль.
”равнение химической реакции, включающее величину теплового эффекта (энтальпии), называетс€ термохимическим уравнением. “ермохимические уравнени€ составл€ют таким образом, чтобы исходное вещество было вз€то в количестве 1 моль, либо в качестве продукта образовывалс€ 1 моль вещества, поэтому в таких уравнени€х стехиометрические коэффициенты могут быть дробными, обознача€ количества веществ.
Ќапример:
обычное химическое уравнение:
2H2 + O2 = 2H2O;
термохимическое уравнение:
H2(газ) + 0,5O2(газ) = H2O(газ) + 242 кƒж;
или:
H2(газ) + 0,5O2(газ) = H2O(газ);  H2O = -242 кƒж/моль.
H2O = -242 кƒж/моль.
“ермохимические уравнени€ имеют и другие особенности:
‑ с ними можно выполн€ть алгебраические действи€ Ц складывать, умножать, записывать в обратном направлении и т.д. (с учЄтом теплового эффекта);
‑ тепловой эффект зависит от агрегатных состо€ний веществ, поэтому это состо€ние указываетс€: тв., крист., ж., г., пар.
—тандартные энтальпии образовани€ простых веществ в их наиболее устойчивых состо€ни€х равны нулю. Ќапример:
 O2 = 0;
O2 = 0;  —графит = 0;
—графит = 0;
 O3 ¹ 0.
O3 ¹ 0.  —алмаз ¹ 0.
—алмаз ¹ 0.
¬еличины стандартных энтальпий образовани€ веществ - справочный материал. –азличному агрегатному состо€нию одного и того же вещества соответствуют различные значени€ стандартных энтальпий образовани€.
Ќапример:
 H2O(жидк.) = -286 кƒж/моль;
H2O(жидк.) = -286 кƒж/моль;
 H2O(газ) = -242 кƒж/моль.
H2O(газ) = -242 кƒж/моль.
ѕон€тие Ђстандартна€ энтальпи€ образовани€ї используют не только дл€ обычных веществ, но и дл€ ионов в растворе. ¬ данном случае за нулевую отметку принимают стандартную энтальпию образовани€ иона H+:
|
|
|
 H+(р-р) = 0.
H+(р-р) = 0.
—тандартной энтальпией сгорани€ вещества( ) называет-с€ стандартна€ энтальпи€ (изменение энтальпии) реакции окислени€ 1 моль данного вещества до продуктов предельного окислени€ (или простых веществ) при стандартных услови€х. Ќапример:
) называет-с€ стандартна€ энтальпи€ (изменение энтальпии) реакции окислени€ 1 моль данного вещества до продуктов предельного окислени€ (или простых веществ) при стандартных услови€х. Ќапример:
—6H12O6(тв.) + 6O2(газ) = 6CO2(газ) + 6H2O(жидк.) + 2810 кƒж;
 —6H12O6 = -2810 кƒж/моль.
—6H12O6 = -2810 кƒж/моль.
” высших оксидов стандартные энтальпии сгорани€ равны нулю:
 —O2 = 0;
—O2 = 0;  Ќ2O = 0.
Ќ2O = 0.
¬ 1840 г. русским ученым √.». √ессом на основании экспериментальных данных был открыт закон о посто€нстве сумм теплот дл€ различных путей превращени€ исходных веществ в продукты реакции. ¬ современной термохимии закон √есса рассматриваетс€ как следствие I закона термодинамики, но при этом имеет отдельное название, так как был открыт раньше установлени€ эквивалентности теплоты и работы.
¬ насто€щее врем€ закон √есса формулируетс€ так:
»зменение энтальпии реакции образовани€ заданных продуктов из данных реагентов не зависит от числа и вида реакций, в результате которых образуютс€ эти продукты, а зависит от природы и состо€ни€ исходных веществ и конечных продуктов
—хематично закон √есса можно представить следующим образом (рис. 1), откуда видно:
DH = DH1 + DH2 + DH3 = DH4 + DH5
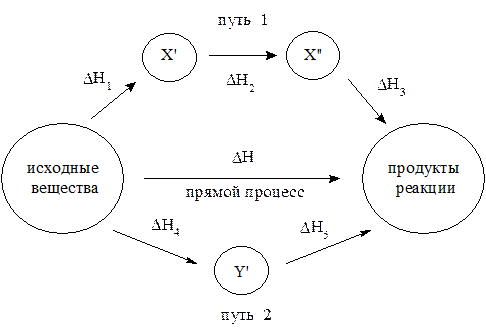
–ис. 1. ѕути превращени€ исходных веществ в продукты реакции
“ак, CO2 можно получить пр€мым взаимодействием углерода и кислорода:
C(тв.) + ќ2(газ) = —ќ2(газ); 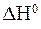 = -394 кƒж.
= -394 кƒж.
—уществует и другой путь:
— + 0,5O2 = CO; 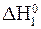 = -110 кƒж.
= -110 кƒж.
—O + 0,5O2 = CO2; 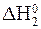 = -284 кƒж.
= -284 кƒж.
Ќо при этом:
DH = DH1 + DH2 = -110 + (-284) = -394 кƒж.
ƒл€ расчета энтальпий химических реакций используют следстви€ из закона √есса.
I следствие:
Ёнтальпи€ реакции равна сумме стандартных энтальпий образовани€ продуктов реакции за вычетом суммы стандартных энтальпий образовани€ исходных веществ с учЄтом стехиометрических коэффициентов.
ƒл€ реакции:
aA + bB = cC + dD,
где A, B, C и D - вещества, a, b, c и d - стехиометрические коэффициенты в уравнении реакции математическое выражение I следстви€ из закона √есса в общем виде выгл€дит следующим образом:
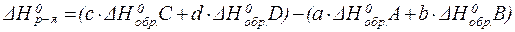
| (6) |
II следствие:
Ёнтальпи€ реакции равна сумме стандартных энтальпий сгорани€ исходных веществ за вычетом суммы стандартных энтальпий сгорани€ продуктов реакции с учЄтом стехиометрических коэффициентов.
¬ данном случае математическое выражение запишетс€ так:
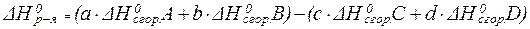
| (7) |
¬торое следствие из закона √есса в основном используетс€ дл€ расчЄта тепловых эффектов реакций с участием органических соединений, так как легко определ€ть их теплоты сгорани€ в кислороде, и невозможно экспериментально установить их теплоты образовани€ из простых веществ.
“аким образом, следстви€ из закона √есса позвол€ют проводить расчЄты энергетики химических реакций по справочным данным, не прибега€ к эксперименту.
Ёкспериментальное определение тепловых эффектов химических реакций
ѕомимо теоретических (расчЄтных) методов определени€ тепловых эффектов химических реакций, широко примен€ютс€ и методы экспериментальные.
Ёкспериментальное определение тепловых эффектов химических реакций обычно провод€т при помощи калориметра, который представл€ет собой термически изолированный сосуд со встроенным термометром. »змер€емой величиной €вл€етс€ температура. –асчЄты тепловых эффектов провод€т по формуле:
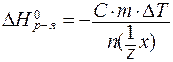 , ,
| (8) |
где C - удельна€ теплоЄмкость раствора;
m - масса раствора;
DT - повышение температуры в результате реакции;
n( х) - число моль эквивалентов реагирующего вещества х.
х) - число моль эквивалентов реагирующего вещества х.
аждый тип реакции характеризуетс€ своим, вполне определЄнным тепловым эффектом. Ќапример, стандартна€ энтальпи€ нейтрализации Ц энтальпи€ реакции между кислотой и основанием, в которой образуетс€ 1 моль воды при стандартных услови€х:
 Ќ+р-р + ќЌ-р-р Ќ2ќж + 56,7 кƒж;
Ќ+р-р + ќЌ-р-р Ќ2ќж + 56,7 кƒж;
DHонейтр = -56,7 кƒж/моль или -13,55 ккал/моль.
—уществуют пон€ти€: стандартна€ энтальпи€ гидрогенизации, стандартна€ энтальпи€ растворени€, стандартна€ энтальпи€ атомизации и т.д.
ѕример 1. “ребуетс€ определить тепловой эффект реакции нейтрализации.
–ешение.
Ќезависимо от того, какие были вз€ты кислота и основание, нейтрализаци€ всегда сводитс€ к ионно-молекул€рному уравнению:
H+(р-р) + ќH-(р-р) = H2O(жидк.).
“аким образом, из закона √есса следует, что стандартна€ энтальпи€ реакции нейтрализации €вл€етс€ величиной посто€нной.
ѕоместим в калориметр 25 мл сол€ной кислоты с C( HCl) = 0,5 моль/л и определим начальную температуру. «атем быстро прильЄм 25 мл раствора гидроксида кали€ с C(
HCl) = 0,5 моль/л и определим начальную температуру. «атем быстро прильЄм 25 мл раствора гидроксида кали€ с C( KOH) = 0,5 моль/л и снова измерим температуру. “емпература повысилась на 3,50—. Ёто означает, что реакци€ нейтрализации €вл€етс€ экзотермической. “еперь рассчитаем энтальпию нейтрализации (в нестандартных услови€х опыта), использу€ формулу (8)[5]:
KOH) = 0,5 моль/л и снова измерим температуру. “емпература повысилась на 3,50—. Ёто означает, что реакци€ нейтрализации €вл€етс€ экзотермической. “еперь рассчитаем энтальпию нейтрализации (в нестандартных услови€х опыта), использу€ формулу (8)[5]:
|
|
|
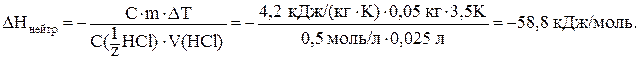
ѕроцессы растворени€ также сопровождаютс€ тепловыми эффектами. Ёнтальпией растворени€ называетс€ изменение энтальпии при растворении 1 моль вещества в определЄнном растворителе с образованием бесконечно разбавленного раствора.
ѕример 2. ѕри растворении 3 г нитрата аммони€ в 1 л воды температура понизилась на 0,370—. ќпределить стандартную энтальпию растворени€ нитрата аммони€.
–ешение.
“ак как температура раствора понизилась, то растворение нитрата аммони€ €вл€етс€ эндотермическим процессом.
оличество NH4NO3 равно:
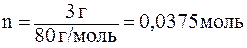 ,
,
≈сли прин€ть те же допущени€, что и в примере 1, то получим:
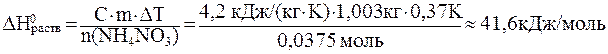 .
.






