¬ли€ние концентраций реагирующих веществ на скорость реакции выражаетс€ основным законом химической кинетики (законом действующих масс ‑ . √ульдберг и ѕ. ¬ааге 1867 г.):
—корость химической реакции, протекающей при посто€нной температуре в гомогенной среде, пропорциональна произведению концентраций реагирующих веществ в степен€х их стехиометрических коэффициентов.
“ак, дл€ гомогенной обратимой реакции, протекающей по уравнению:
aA + bB ⇄ cC + dD,
скорости пр€мой и обратной реакций определ€ютс€ выражени€ми:


где k1 и k2 - константы скоростей пр€мой и обратной реакций.
Ќеобходимо отметить, что данное определение справедливо только дл€ простых реакций, протекающих в результате одного элементарного акта взаимодействи€ частиц.
”равнени€, выражающие зависимость скорости химических реакций от концентраций реагентов, называют кинетическими.
оэффициент пропорциональности k называют константой скорости химической реакции.
¬еличина k зависит от природы реагирующих веществ, температуры, наличи€ катализатора и не зависит от концентрации реагирующих веществ. ‘изический смысл константы скорости реакции заключаетс€ в следующем: она равна скорости реакции в случае, если концентрации всех реагирующих веществ равны и составл€ют 1 моль/л или их произведение равно 1.
Ќапример:
H2(газ) + I2(газ) ⇄ 2HI(газ)
 ;
;
 .
.
≈сли система гетерогенна, то концентраци€ твЄрдой фазы в кинетическом уравнении входит в значение константы скорости (т.е., в €вном виде в уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
 ;
;
 .
.
«ависимость скорости реакции от температуры
ѕри повышении температуры скорость реакции, увеличиваетс€. Ёта закономерность в первом приближении может быть выражена уравнением:

| (23) |
где 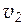 и
и  - скорости реакций при температурах
- скорости реакций при температурах  и
и  ;
;
γ - температурный коэффициент скорости реакции (темпера-турный коэффициент ¬ант-√оффа), который показывает во сколько раз возрастает скорость данной реакции при повышении температуры на 100.
ƒл€ большинства реакций g = 2-4. ¬ таких случа€х выполн€етс€ правило ¬ант-√оффа:
ѕри повышении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
ƒл€ ферментативных процессов, протекающих в биосистемах, g больше 4 (обычно около 7).
ѕример 3. ќпределить, во сколько раз снижаетс€ скорость реакции окислени€ глюкозы при гипотермии, если температура тела падает от 36,6 до 31,60—, а температурный коэффициент g равен 14.
–ешение.
ѕо правилу ¬ант-√оффа:

“аким образом, скорость реакции снизилась почти в 4 раза.
¬ эмпирическом правиле ¬ант-√оффа не отражена зависимость самого температурного коэффициента g от температуры. тому же имеютс€ реакции, дл€ которых значение g выходит за пределы обозначенной области. ¬ св€зи с этим правило ¬ант-√оффа имеет ограниченное применение и предназначено дл€ приблизительной оценки вли€ни€ температуры на скорость реакции.
Ѕолее точно температурную зависимость скорости химической реакции отражает уравнение јррениуса. —огласно јррениусу, константа скорости реакции зависит от температуры следующим образом:
|
|
|
 , ,
| (24) |
где: k - константа скорости реакции;
ј - константа јррениуса, частотный фактор, отражающий число столкновений между реагирующими молекулами в единице объЄма в единицу времени;
R - универсальна€ газова€ посто€нна€ (8,31Јƒж/(моль×K));
T - температура по ельвину (273 + t0—);
Ea - энерги€ активации, кƒж/моль.
Ёнерги€ активации
’имическое взаимодействие, как правило, начинаетс€ с разрыва или ослаблени€ св€зи между атомами в молекулах реагирующих веществ. Ќеобходимым этапом многих химических превращений €вл€етс€ столкновение молекул. ќднако подсчЄт числа столкновений, выполненный при помощи кинетической теории, показал, что далеко не каждое столкновение ведет к реакции. “ак, в реакции разложени€ йодоводорода, протекающей при комнатной температуре, эффективным (т.е., привод€щим к химической реакции) €вл€етс€ лишь одно столкновение из 2×1017 столкновений молекул.
“акое соотношение между числом эффективных столкновений и общим числом столкновений объ€сн€етс€ тем, что в ходе взаимодействи€ частиц образуетс€ неустойчивое промежуточное состо€ние, которое называетс€ активированным комплексом.
ќбразование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных €дер при сближении частиц и, во-вторых, необходимостью построени€ определЄнной пространственной конфигурации атомов в активированном комплексе и перераспределени€ электронной плотности. “аким образом, по пути из начального состо€ни€ в конечное система должна преодолеть своего рода энергетический барьер. Ёнерги€ активации (Ea) реакции приближЄнно равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Ќеустойчивый активированный комплекс существует очень короткое врем€ и распадаетс€ с образованием продуктов реакции и выделением энергии.
Ёнергией активации (Ea, кƒж/моль) называют дополнительное количество энергии, которое необходимо сообщить 1 моль веществ реакционной массы дл€ начала реакции.
¬ большинстве случаев энерги€ активации химических реакций между нейтральными молекулами составл€ет от 80 до 240 кƒж/моль. ƒл€ биохимических процессов значени€ ≈а ниже: до 20 кƒж/моль. Ёто объ€сн€етс€ тем, что абсолютное большинство биохимических процессов протекает через стадию фермент-субстратных комплексов.
Ёнергетические барьеры ограничивают протекание реакции, поэтому в принципе возможные реакции (дл€ которых DGр-€ < 0) могут протекать крайне медленно или не протекать вообще.
Ќа рис. 2 представлена энергетическа€ диаграмма условной реакции, протекающей по уравнению A + B = AB.

–ис. 2. Ёнергетическа€ диаграмма реакции A + B = AB.
где Eисх - средн€€ энерги€ частиц исходных веществ;
Eпрод - средн€€ энерги€ частиц продуктов реакции;
Ea - энерги€ активации;
| DHр-€ - энергетический эффект (энтальпи€) реакции. |
ƒанна€ диаграмма позвол€ет объ€снить вли€ние температуры и концентраций на скорость реакции. ƒействительно, поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энерги€ которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции. ѕовышение концентрации также приводит к увеличению числа частиц с более высокой энергией.
|
|
|
Ёнерги€ активации зависит от природы реагирующих веществ и в некоторой степени от температуры.
≈сли энерги€ активации мала (меньше 40 кƒж/моль), скорость реакции велика. “ак, ионные реакции в растворах протекают практически мгновенно.
≈сли энерги€ активации реакции велика (больше 120 кƒж/моль), скорость реакции мала. Ќапример, синтез йодоводорода из I2 и H2 (≈а = 163 кƒж/моль) при обычных услови€х протекает за астрономический промежуток времени.
–еакции, энерги€ активации которых находитс€ в пределах от 40 до 120 кƒж/моль, протекают за врем€, которое можно зафиксировать в лабораторных услови€х. “ак, врем€ протекани€ реакции разложени€ тиосульфата натри€ серной кислотой, ≈а = 86,5 кƒж/моль:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O
составл€ет несколько минут.






