Передмова
Згідно з існуючою класифікацією до клінічних форм ішемічної хвороби серця (ІХС) належать стабільна стенокардія, безбольова ішемія міокарда, нестабільна стенокардія, інфаркт міокарда, кардіосклероз і раптова коронарна смерть. Протягом багатьох років нестабільну стенокардію розглядали як проміжний ”синдром” між стабільною стенокардією і гострим інфарктом міокарда. Останнім часом з’ясували його патофізіологію і зробили значний крок уперед у веденні хворих. Зараз очевидно, що гострі коронарні синдроми (ГКС), нестабільна стенокардія та інфаркт міокарда мають спільний анатомічний субстрат – розрив атеросклеротичної бляшки або її ерозію – і відрізняються ступенем тромбозу та дистальною емболізацією.
Ці рекомендації стосуються ведення пацієнтів з підозрою на ГКС без стійкої елевації сегмента ST. Ведення пацієнтів із стійкою елевацією сегмента ST розглядається у рекомендаціях Асоціації кардіологів України з лікування гострого інфаркту міокарда.
Представлені рекомендації розроблено на базі рекомендацій Європейського товариства кардіологів, але з урахуванням реальної клінічної практики в Україні.
Рекомендації засновані на доказах, отриманих у багатьох клінічних дослідженнях, і враховують сучасні знання про ГКС. Ці дослідження проводили у відібраних популяціях пацієнтів з певними клінічними характеристиками, які не завжди відображають реальну клінічну практику лікаря.
ГКС – важлива проблема охорони здоров’я. Летальність протягом 6 міс унаслідок ГКС без елевації сегмента ST за даними Euro Heart Survey та реєстру GRACE становить 12%. Проте результати останніх досліджень свідчать про можливість поліпшення короткострокового та тривалого прогнозу при застосуванні клінічної стратегії, яка включає ретельну стратифікацію ризику в поєднанні з використанням сучасних терапевтичних засобів та процедур реваскуляризації у відібраної групи хворих.
2. Патофізіологія
ГКС зумовлені гострим або підгострим первинним зменшенням постачання міокарда киснем, яке спричиняється розривом або ерозією атеросклеротичної бляшки, асоційованими із запаленням, стійким або нестійким тромбозом вінцевої артерії, вазоконстрикцією та мікроемболізацією.
2.1. Розрив атеросклеротичної бляшки та її ерозія
Доведено, що атеросклероз – це не поступовий, лінійний процес, а скоріше захворювання з фазами стабільності та нестабільності. Раптові та непередбачувані зміни симптомів, очевидно, пов’язані з розривом атеросклеротичної бляшки. Бляшки, схильні до розриву, мають велике ліпідне ядро, низьку щільність гладком’язових клітин, високу щільність макрофагів, тонку фіброзну покришку з дезорганізованого колагену, а також високу концентрацію тканинного фактора. Ліпідне ядро формує клітинну масу всередині колагенового матриксу бляшки.
Розрив атеросклеротичної бляшки є наслідком поєднання різних факторів. Активний розрив атеросклеротичної бляшки, ймовірно, пов’язаний із секрецією протеолітичних ензимів макрофагами, які можуть послабити фіброзну покришку. Пасивний розрив бляшки зумовлено фізичними силами, які діють у місці сполучення бляшки і прилеглої ”нормальної” стінки. Крім розриву бляшки, одним із основних механізмів патогенезу ГКС є ерозія бляшки, яку частіше спостерігають у жінок, пацієнтів з цукровим діабетом і артеріальною гіпертензією. Ерозія більш поширена на фоні стенозу високого ступеня, а також при локалізації стенозу в правій вінцевій артерії. Коли виникає ерозія, тромб утворюється на поверхні бляшки, а коли бляшка розривається, тромб залучає глибші її шари, аж до ліпідного ядра. Якщо цей процес не скоригувати, він може сприяти росту та швидкому прогресуванню атеросклеротичної бляшки.
Запалення
Фіброзна покришка, як правило, має високий вміст колагену типу І, що дозволяє їй витримувати значне розтягнення стінки судини. Втім, це динамічна структура, у якій постійно підтримується рівновага між синтезом колагену, модульованого факторами росту, та його розпадом під впливом металопротеаз, які утворюються активованими макрофагами. Крім того, послабленню фіброзної покришки та розриву бляшки може сприяти апоптоз гладком’язових клітин. У патологоанатомічних дослідженнях постійно виявляють інфільтрацію бляшки макрофагами, частка яких у 6-9 разів більша у розірваних, ніж у стабільних бляшках. Присутність макрофагів свідчить про запальний процес, який також характеризується наявністю активованих Т-лімфоцитів у місці розриву бляшки. Т-лімфоцити можуть виділяти різні цитокіни, які активують макрофаги та сприяють проліферації гладком’язових клітин.
Тромбоз
Тромб утворюється в місці розриву або ерозії атеросклеротичної бляшки. Він може спричиняти швидкі зміни ступеня стенозу, а також призвести до субтотальної або тотальної оклюзії судини. Тромб, який з’являється при ГКС, переважно багатий на тромбоцити. Транзиторні епізоди оклюзії або субтотальної оклюзії судин і пов’язані з цим симптоми та зміни ЕКГ можна пояснити спонтанним тромболізисом.
Тромб, який формується у місці розриву атеросклеротичної бляшки, може поділятися на невеликі фрагменти, що мігрують разом з плином крові, викликаючи оклюзію артеріол і капілярів. Ці тромбоцитарні емболи здатні спричиняти невеликі ділянки некрозу (мінімальне пошкодження міокарда, малі інфаркти) за відсутності оклюзії епікардіальної вінцевої артерії.
2.4. Вазоконстрикція
Багатий на тромбоцити тромб може виділяти вазоконстрикторні субстанції, такі як серотонін і тромбоксан А2. Це зумовлює вазоконстрикцію у місці розриву атеросклеротичної бляшки або в мікроциркуляторному руслі. Описаний ефект є домінуючим у розвитку варіантної стенокардії Принцметала, що характеризується минущим, раптовим звуженням сегмента вінцевої артерії, якому не передує підвищення потреби міокарда в кисні. Ці епізоди гострої трансмуральної ішемії провокуються локалізованим коронарним вазоспазмом, який призводить до сильного звуження або оклюзії однієї чи більше великих епікардіальних вінцевих судин.
2.5. Міокард
Патологоанатомічні дослідження у пацієнтів з ГКС без стійкої елевації сегмента ST дозволили виявити широкий спектр змін у міокарді, який кровопостачається ураженою судиною. Міокард може залишатися незміненим при нестабільній стенокардії або мати різний ступінь вираженості некрозу – інфаркт міокарда, що пов’язано з повторними епізодами тромботичної емболізації. Визначення рівнів серцевих тропонінів Т і І – найбільш чутливих та специфічних маркерів некрозу міокарда – є методом вибору в обстеженні пацієнтів з підозрою на ГКС. Обмежені ділянки некрозу часто не вдається виявити рутинним вимірюванням рівня креатинфосфокінази (КФК) або її ізоферменту МВ-КФК. Вміст цих ферментів може залишатися в межах норми або бути лише дещо вищим за верхню межу норми. Впровадження цих методів має велике практичне значення для виявлення хворих з підвищеним ризиком розвитку ускладнень та вибору режиму терапії.
3. Діагноз
Скарги
Розрізняють кілька варіантів клінічного перебігу ГКС: тривалий (понад 20 хв) ангінозний біль у спокої, виникнення вперше у житті тяжкої стенокардії (ІІІ функціонального класу за класифікацією Канадського товариства із серцево-судинних захворювань) або нещодавня дестабілізація попередньо стабільної стенокардії і підвищення функціонального класу принаймні до ІІІ (прогресуюча стенокардія).
Утім, досить поширеними є атипові варіанти перебігу ГКС. Вони частіше спостерігаються у молодих (25-40 років) і літніх (понад 75 років) – пацієнтів, пацієнтів із цукровим діабетом та жінок.
3.2. Фізикальне обстеження
При фізикальному обстеженні, яке включає огляд грудної клітки, аускультацію, вимірювання частоти скорочень серця і артеріального тиску, нерідко не виявляють патологічних змін. Мета обстеження – виключити наявність некардіальних причин болю в грудній клітці та неішемічних серцевих розладів (перикардит, розшаровуюча аневризма аорти, захворювання клапанного апарату, тромбоемболія легеневої артерії, пневмоторакс), а також ознак гемодинамічної нестабільності і дисфункції лівого шлуночка.
3.3. Електрокардіограма
Реєстрація ЕКГ у спокої – ключовий елемент обстеження пацієнтів з підозрою на ГКС. Бажано здійснити запис ЕКГ у момент виникнення симптомів і у момент, коли симптоми зникнуть. Цінну інформацію дає порівняння з попередніми ЕКГ, особливо у пацієнтів із супутніми серцевими захворюваннями, такими як гіпертрофія лівого шлуночка або перенесений раніше інфаркт міокарда. Патологічні зубці Q, які можуть свідчити про попередній інфаркт міокарда, дозволяють зробити припущення щодо вираженого атеросклерозу вінцевих артерій, але не свідчать про нестабільність стану на момент обстеження.
Зміщення сегмента ST і зміни зубця Т є найбільш надійними електрокардіографічними індикаторами. Депресія сегмента ST більш ніж на 1 мм у двох або більше відведеннях ЕКГ, яка виникає на фоні відповідної клінічної картини, з високою імовірністю свідчить про ГКС, так само як інверсія зубців Т (більш ніж на 1 мм) у відведеннях з домінуючим зубцем R, хоча і є менш специфічною. Глибока симетрична інверсія зубців Т у передніх грудних відведеннях часто пов’язана з тяжким стенозом проксимального відділу лівої передньої низхідної вінцевої артерії. Неспецифічні зміни сегмента ST і зубця Т (менш ніж на 1 мм) менш характерні для ГКС. Їх нерідко виявляють у пацієнтів, у яких іншими методами вдалося виключити нестабільну стенокардію. Інколи під час ішемічних нападів виникають епізоди блокади ніжки пучка Гіса. Слід визнати, що повністю нормальна картина ЕКГ у пацієнтів з типовими ангінозними симптомами не виключає наявності ГКС. Крім того, реєстрація нормальної ЕКГ у пацієнта з вираженим болем у грудній клітці свідчить про необхідність розгляду інших можливих причин больового синдрому.
Елевація сегмента ST свідчить про наявність трансмуральної ішемії, спричиненої оклюзією вінцевих судин. Персистуюча елевація сегмента ST характерна для формування інфаркту міокарда.
3.4. Біохімічні маркери пошкодження міокарда
Для визначення некрозу міокарда зараз перевагу надають серцевим тропонінам Т або І, які є більш специфічними та надійними, ніж традиційні серцеві ферменти, такі як КФК або МВ-КФК. Будь-яке підвищення вмісту тропонінів Т або І відображає некроз клітин міокарда, а за наявності ознак ішемії міокарда (біль у грудях, зміни сегмента ST) – розвиток інфаркту міокарда.
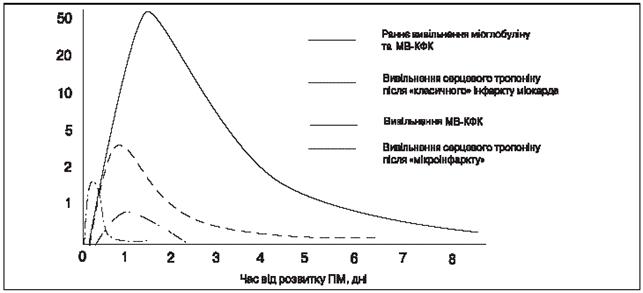
У пацієнтів з інфарктом міокарда початкове зростання концентрації тропонінів у периферійній крові спостерігається через 3-4 год та утримується впродовж 2 тиж (рис. 1). Визначення підвищеного рівня тропонінів дозволяє виявляти інфаркт міокарда приблизно у третини пацієнтів, які госпіталізуються з діагнозом нестабільної стенокардії без елевації МВ-КФК. Підвищення вмісту тропоніну може спостерігатися також при інших станах, які проявляються болем у грудній клітці, таких як розшаровуюча аневризма аорти, емболія легень, міокардит.
Одноразового визначення рівня тропоніну при госпіталізації пацієнта недостатньо, оскільки у 10-15% пацієнтів зміни цього показника виявляються у подальші години. Для того щоб довести або виключити наявність пошкодження міокарда, протягом перших 6-12 год після госпіталізації або після будь-яких наступних епізодів сильного болю в грудній клітці, необхідно повторювати аналіз крові. Якщо останній епізод болю в грудній клітці стався більш ніж за 12 год до першого визначення вмісту тропоніну, друге визначення можна пропустити, за відсутності інших підстав підозрювати інфаркт.
Рис. 1. Динаміка рівня маркерів некрозу міокарда у хворих з інфарктом міокарда.
3.5. Рекомендації
У пацієнтів з підозрою на гострі форми ІХС необхідно:
1) Провести реєстрацію ЕКГ у спокої та почати тривале моніторування сегмента ST (або часто здійснювати повторні записи ЕКГ, якщо немає обладнання для моніторування).
2) Вимірювати рівень тропоніну Т або І при госпіталізації і, за наявності нормальних показників, повторити дослідження через 6-12 год.
3) Оцінювати вміст МВ-КФК потрібно у пацієнтів із повторною ішемією після нещодавно перенесеного (менш як за 2 тиж.) інфаркту міокарда для виявлення рецидивів інфаркту.
4. Оцінка ризику
Вибір стратегії ведення пацієнтів із встановленим діагнозом ГКС визначається ризиком прогресування захворювання до гострого інфаркту міокарда і смерті. Ключовими елементами оцінки ризику, окрім віку та попереднього анамнезу ІХС, є клінічне обстеження, оцінка ЕКГ, біохімічних параметрів та функціонального стану лівого шлуночка.
4.1. Клінічна картина
Важливою інформацією для оцінки прогнозу є дані клінічної картини захворювання – час після останнього епізоду ішемії, наявність стенокардії у спокої і реакція на медикаментозне лікування. Але для вибору оптимального лікування потрібно також брати до уваги інші індикатори ризику.
4.2. Електрокардіограма
Електрокардіографія – найважливіший метод не лише для встановлення діагнозу, а й для прогностичної оцінки. У пацієнтів з депресією сегмента ST ризик подальших серцевих подій вищий, ніж у таких з ізольованою інверсією зубця Т, в яких, у свою чергу, ризик більший, ніж у випадку нормальної картини ЕКГ при госпіталізації (за винятком хворих, які раніше перенесли інфаркт міокарда із зубцем Q). Стандартна ЕКГ у спокої адекватно не відображає динамічну природу коронарного тромбозу та ішемії міокарда. Майже дві третіх епізодів ішемії при дестабілізації ІХС безсимптомні, і тому з малою ймовірністю можуть бути виявлені при звичайній реєстрації ЕКГ. Корисну інформацію може дати холтерівське моніторування ЕКГ, але його результати отримують лише через кілька годин або днів після запису. У 15-30% пацієнтів з дестабілізацією ІХС виявляють коливання сегмента ST (переважно депресію ST). У цих пацієнтів ризик подальших серцевих подій зростає. Крім реєстрації ЕКГ у спокої та інших клінічних параметрів, незалежну прогностичну інформацію забезпечує моніторування ЕКГ. У пацієнтів з кількістю ішемічних епізодів до 2 на добу частота смерті або інфаркту міокарда через 30 діб становить 9,5%, у пацієнтів з кількістю епізодів від 3 до 5-12,7% та у пацієнтів з кількістю ішемічних епізодів понад 5-19,7%.
4.3. Біохімічні маркери
Пацієнти з дестабілізацією клінічного стану, в яких виявлено підвищення вмісту тропоніну, характеризуються більш несприятливим коротко- та довгостроковим прогнозом порівняно з хворими без елевації рівня тропоніну. Ризик нових подій корелює із ступенем підвищення цього показника. Виявлення у пацієнтів з дестабілізацією ІХС підвищення рівня тропоніну є важливим для вибору відповідного лікування. В останніх дослідженнях показано, що при його підвищенні особливо ефективними засобами є низькомолекулярні гепарини (НМГ) та інгібітори глікопротеїнових рецепторів (GP) IIb/IIIa.
Підвищення рівнів фібриногену та С-реактивного протеїну (СРП) є фактором ризику в пацієнтів з ГКС. Прогностичне значення СРП найбільше у пацієнтів з пошкодженням міокарда. Концентрації тропоніну Т і СРП є незалежними маркерами серцевої смерті при тривалому спостереженні, але їх прогностична значущість зростає при поєднаному їх визначенні, а також разом з клінічними маркерами.
4.4. Ехокардіографія
Систолічна функція лівого шлуночка – важливий для оцінки прогнозу параметр, який можна легко і точно оцінити методом ехокардіографії. Під час ішемії виявляють ділянки минущої гіпокінезії або акінезії сегментів стінки лівого шлуночка, функція яких відновлюється після нормалізації кровотоку. Фонова дисфункція лівого шлуночка, а також інші стани, такі як аортальний стеноз або гіпертрофічна кардіоміопатія, мають велике значення для оцінки прогнозу та ведення хворих.
Навантажувальний тест перед випискою
Після стабілізації стану перед випискою хворого верифікацію діагнозу ІХС та оцінку середньо- та довгострокового ризику розвитку коронарних подій необхідно здійснити за допомогою стрес-тесту.
Проба з фізичним навантаженням має високу негативну передбачувальну цінність та забезпечує додаткову інформацію для оцінки прогнозу. Чимало пацієнтів не можуть виконати пробу з фізичним навантаженням, і це само по собі свідчить про поганий прогноз. Для оцінки прогнозу в цих випадках, особливо у жінок, використовують такі методи візуалізації серця в умовах навантажувальних тестів, як перфузійна сцинтиграфія міокарда с Tl201 і ехокардіографія.
4.6. Коронарна ангіографія
Це дослідження забезпечує унікальну інформацію про наявність та тяжкість ІХС. У пацієнтів з множинним ураженням коронарних судин, а також із стенозом стовбура лівої вінцевої артерії ризик тяжких серцевих подій вищий. Ангіографічна оцінка характеристики та локалізації пошкодження судин здійснюється у випадках, коли розглядають питання про необхідність реваскуляризації. Індикаторами ризику є складні, довгі пошкодження з вираженою кальцифікацією, а також підвищена звивистість судин. Але найбільшим є ризик при наявності дефектів наповнення, які вказують на внутрішньокоронарний тромбоз.
4.7. Рекомендації зі стратифікації ризику
Оцінка ризику повинна бути точною, надійною і, бажано, нескладною та доступною, пов’язаною з найменшими витратами. Рекомендують такі методи:
А. Маркери ризику тромбозу, тобто короткострокового ризику:
-а. рецидивування болю в грудній клітці;
-б. депресія сегмента ST;
-в. зміни в динаміці сегмента ST;
-г. підвищення рівня серцевих тропонінів;
-д. виявлення тромбу при ангіографії, ексцентричність, нечіткі контури, виразкування, нерізкість зображення та дефекти наповнення;
Б. Маркери фонового захворювання, тобто довгострокового ризику:
1) Клінічні маркери:
-а. вік;
-б. перенесені раніше інфаркт міокарда, шунтування вінцевих артерій, цукровий діабет, застійна серцева недостатність, гіпертензія;
2) Біологічні маркери:
-а. дисфункція нирок (підвищений рівень креатиніну або знижений кліренс креатиніну);
-б. запальні маркери (підвищення рівня СРП, фібриногену);
3) Ангіографічні маркери:
-а. дисфункція лівого шлуночка;
-б. ступінь ураження вінцевих артерій.
5. Лікування
На основі результатів багатьох клінічних досліджень та метааналізів визначена ефективність різних шляхів лікування ГКС, зокрема застосування антиішемічних, антитромбінових і антитромбоцитарних засобів, фібринолітиків і коронарної реваскуляризації.
5.1. Фармакотерапія
5.1.1. Антитромбоцитарні засоби
5.1.1.1. Аспірин
Ацетилсаліцилова кислота пригнічує циклооксигеназу-1 і блокує формування тромбоксану А2. Таким чином, блокується агрегація тромбоцитів, індукована через цей шлях. У рандомізованих дослідженнях аспірин зменшував ризик смерті або інфаркту міокарда у пацієнтів з нестабільною стенокардією. Дані метааналізу свідчили про те, що дози аспірину 75-150 мг були не менш ефективними, ніж більші дози. При гострому інфаркті міокарда антитромбоцитарна терапія (майже виключно аспірин) здатна зменшувати кількість судинних подій. Крім короткотривалого ефекту, аспірин забезпечує також поліпшення прогнозу при продовженні лікування. Побічні ефекти з боку шлунково-кишкового тракту при застосуванні аспірину в таких низьких дозах зустрічаються відносно нечасто. До протипоказань відносять активну пептичну виразку, кровотечі, геморагічний діатез, аспіринову бронхіальну астму. З огляду на це, аспірин рекомендують призначати всім пацієнтам з підозрою на ГКС, за відсутності протипоказань і в подальшому для тривалого лікування.
5.1.1.2. Антагоністи рецепторів аденозиндифосфату: тієнопіридини
Тиклопідин та його дериват клопідогрель – інгібітори аденозиндифосфату, який забезпечує агрегацію тромбоцитів. На фоні застосування тиклопідину можуть спостерігатися шлунково-кишкові розлади, алергійні реакції, нейтропенія або тромбоцитопенія. Застосування клопідогрелю супроводжується значно меншою частотою розвитку ускладнень. Ефективність клопідогрелю досліджували на фоні застосування аспірину (в дозі 75-325 мг) у пацієнтів із ГКС у великому клінічному дослідженні CURE (2001) за участю 12562 пацієнтів. За результатами цього дослідження клопідогрель рекомендують застосовувати, починаючи з навантажувальної дози (300 мг) одноразово та у подальшому – 75 мг один раз на добу в поєднанні з підтримувальними дозами аспірину 100 мг або менше та відміняти препарат за 5 діб до проведення аортокоронарного шунтування. Цей препарат призначають як у період дестабілізації клінічного стану, так і для тривалої терапії принаймні протягом 12 міс. Клопідогрель потрібно призначати пацієнтам з ГКС, яким планують проведення ангіографії, за винятком випадків, коли ймовірне ургентне хірургічне втручання (протягом 5 днів). Клопідогрель можна також рекомендувати для невідкладної та тривалої терапії у пацієнтів, які не переносять аспірин (CAPRIE, 1996), і пацієнтів, яким встановили стент.
5.1.1.3. Блокатори глікопротеїнових рецепторів IIb/IIIa
Активовані глікопротеїнові рецептори GP IIb/IIIa пов’язуються з фібриногеном, що призводить до формування містків між активованими тромбоцитами і утворення тромбоцитарних тромбів. Розроблені прямі інгібітори глікопротеїнових рецепторів IIb/IIIa. Їх ефективність оцінювали у клінічних ситуаціях, при яких велике значення надається активації тромбоцитів, зокрема під час перкутанних коронарних втручань, при ГКС. З огляду на результати рандомізованих досліджень, можливість призначення блокаторів рецепторів GP IIb/IIIa додатково до аспірину і низької дози гепарину, яку коригували залежно від маси тіла, потрібно розглядати у всіх пацієнтів з ГКС без елевації сегмента ST та з підвищеним рівнем тропоніну Т або тропоніну І, яким планують проводити ранню реваскуляризацію. Інфузія повинна тривати протягом 12 год (абсиксимаб) або 24 год (ептифібатид, тирофібан) після процедури.
5.1.1.4. Застосування антитромботичних засобів при ГКС
Таким чином, аспірин рекомендований усім хворим з ГКС без елевації сегмента ST (при відсутності протипоказань) у початковій дозі 160-325 мг з переходом на підтримувальну дозу 75-100 мг на добу. Всім хворим показано негайне призначення навантажувальної дози клопідогрелю у дозі 300 мг та у подальшому – 75 мг один раз на добу протягом якнайменше 12 міс. При проведенні інвазивної процедури/ПТКА навантажувальна доза клопідогрелю може бути збільшена до 600 мг. Не рекомендовано застосування нестероїдних протизапальних препаратів (як селективних інгібіторів циклооксигенази-2, так і неселективних) у комбінації з клопідогрелем або аспірином. Потрійну комбінацію аспірину, клопідогрелю та антагоністів вітаміну К слід призначати тільки у випадку беззаперечних показань після оцінки розвитку кровотеч. Тривалість потрійної терапії треба скоротити до мінімального рекомендованого терміну та МНО підтримувати на мінімальному ефективному рівні.
5.1.2. Антитромбінові препарати
5.1.2.1. Гепарин, низькомолекулярні гепарини та пентасахарид
Застосування нефракціонованого гепарину (НФГ) асоціюється з нижчою частотою виникнення рефрактерної стенокардії, інфаркту міокарда і смерті порівняно з плацебо (зменшення ризику на 29%). Великих за обсягом досліджень щодо доцільності призначення гепарину додатково до аспірину до цього часу не проведено. Незважаючи на це, у клінічних настановах рекомендують застосовувати стратегію поєднаного призначення НФГ разом з аспірином, що можна розцінювати як прагматичну екстраполяцію існуючих доказів.
У клінічній практиці застосування НФГ пов’язано з певними труднощами. Підтримувати терапевтичний антитромбіновий контроль важко через непередбачувані рівні зв’язування гепарину з протеїнами плазми. Крім того, НФГ має обмежену ефективність за умов, коли тромбін пов’язаний із тромбоцитами та міститься всередині тромбу.
Порівняно з НФГ, низькомолекулярні гепарини характеризуються посиленою активністю проти фактора Ха порівняно з активністю проти фактора ІІа (антитромбінова активність). Крім того, НМГ менш чутливі до тромбоцитарного фактора 4 і мають більш передбачуваний антикоагулянтний ефект, з меншою ймовірністю виникнення тромбоцитопенії. Ці препарати можна призначати підшкірно, доза залежить від ваги пацієнта; при цьому немає потреби у лабораторному контролі. Отримано дані на користь НМГ (еноксапарину) порівняно з НФГ при призначенні як початкового засобу лікування. Ці результати були підтверджені протягом 1 року спостереження. Загалом застосування НМГ у ”гострий” період у хворих з ГКС принаймні не менш ефективне, ніж НФГ. Утім, еноксапарин мав переваги порівняно з НФГ у двох дослідженнях при прямому порівнянні препаратів (за комбінованою кінцевою точкою – смерть, інфаркт міокарда, рецидивування стенокардії).
Фондапаринукс є єдиним селективним інгібітором Ха-фактора, що може використовуватися у клініці. Це синтетичний пентасахарид, який спричинює дозозалежну антитромбін-опосередковану блокаду Ха-фактора. Він може вводитися один раз на добу у фіксованій дозі 2,5 мг підшкірно, при цьому немає потреби у лабораторному контролі антикоагулянтної дії. Розвиток гепарин-індукованої тромбоцитопенії при застосуванні фондапаринуксу не описаний, тому немає потреби у моніторуванні кількості тромбоцитів. У дослідженні OASIS-5 порівнювали застосування фондапаринуксу у дозі 2,5 мг підшкірно один раз на добу з підшкірним введенням еноксапарину у дозі 1 мг/кг двічі на добу. Основним результатом дослідження було зниження ризику кровотеч при застосуванні фондапаринуксу, що спостерігалося вже на 9-ту добу від початку лікування та зберігалося протягом 6 місяців спостереження. Вища безпечність препарату реалізувалася зниженням летальності та розвитку несприятливих серцево-судинних подій через 6 міс спостереження. Проте застосування фондапаринуксу не довело переваг препарату порівняно з еноксапарином при невідкладному черезшкірному коронарному втручанні (ЧКВ), тому в цій ситуації фондапаринукс (арикстру) не рекомендується застосовувати. При проведенні інвазивного втручання додаткове введення НФГ (у дозі 50-100 MО/кг болюсно) рекомендовано хворим, які отримували фондапаринукс до процедури.
Таким чином, антикоагулянтна терапія рекомендована всім хворим на ГКС без стійкої елевації сегмента ST. На підставі більш сприятливого профілю (ефективність/безпечність) у хворих на ГКС рекомендовано застосування фондапаринуксу. Еноксапарин потрібно використовувати при проведенні невідкладного інвазивного втручання, а також можливе його використання у хворих з низьким ризиком розвитку кровотеч. Антикоагулянтну терапію слід проводити протягом 5 діб або до виписки зі стаціонару, або протягом 24 год після проведення ПТКА.
5.1.3. Фібринолітична терапія
Тромболітичну терапію не рекомендують пацієнтам з ГКС без стійкої елевації сегмента ST.
5.1.4. Антиішемічні засоби
Ці препарати зменшують споживання міокардом кисню через зменшення частоти ритму серця, зниження артеріального тиску чи послаблення скоротливості лівого шлуночка або викликають вазодилатацію.
5.1.4.1. Нітрати
Застосування нітратів при ГКС без елевації сегмента ST переважно базується на патофізіологічних міркуваннях та клінічному досвіді. Сприятливий ефект нітратів та сиднонімінів пов’язаний з їх впливом на периферійний та коронарний кровообіг. Передусім терапевтична дія нітратів визначається ефектом венодилатації, зменшенням переднавантаження та кінцево-діастолічного об’єму лівого шлуночка, що приводить до зменшення споживання кисню міокардом. Крім того, нітрати розширюють нормальні та атеросклеротично змінені вінцеві артерії, збільшують коронарний колатеральний кровоток та пригнічують агрегацію тромбоцитів.
У пацієнтів з ГКС за відсутності протипоказань необхідно застосовувати внутрішньовенне введення нітратів. Дозу потрібно титрувати до зникнення симптомів або до появи побічних ефектів (особливо головного болю або гіпотензії). Обмеженням для тривалої терапії нітратами є феномен толерантності, який залежить від призначеної дози та тривалості лікування. Слід зауважити зниження антикоагулянтного ефекту гепарину під час інфузії нітрогліцерину, у зв ’язку з чим внутрішньовенне введення ізосорбіду динітрату має перевагу.
Після досягнення клінічного ефекту внутрішньовенне введення нітратів можна замінити альтернативними методами непарентерального введення з достатніми інтервалами між прийомами препарату. Можливе застосування нітратоподібних засобів, таких як сидноніміни.
5.1.4.2. Бета-адреноблокатори
Бета-адреноблокатори – конкурентні інгібітори ефектів циркулюючих катехоламінів. При ГКС первинні ефекти β-адреноблокаторів зумовлені їх впливом на β1-рецептори та зменшенням споживання міокардом кисню.
Лікування β-адреноблокаторами асоціюється зі зменшенням ризику розвитку гострого інфаркту міокарда та смерті. Тому ці препарати повинні використовуватися при ГКС за відсутності протипоказань. Немає будь-яких переконливих даних про те, що певний препарат з групи β-адреноблокаторів більш ефективний. Якщо ймовірність виникнення побічних ефектів висока, зокрема при супутньому легеневому захворюванні або дисфункції лівого шлуночка, на початку лікування частіше призначають короткодіючий препарат. Протипоказаннями до призначення β-адреноблокаторів є тяжкі порушення атріовентрикулярної провідності, анамнестичні дані про наявність бронхіальної астми або гострої дисфункції лівого шлуночка.
5.1.4.3. Блокатори кальцієвих каналів
Блокатори кальцієвих каналів (БКК) – вазодилатуючі препарати, які безпосередньо впливають на атріовентрикулярне проведення імпульсів і частоту скорочень серця. У кількох рандомізованих клінічних дослідженнях встановлено, що БКК загалом ефективні щодо зменшення симптомів у пацієнтів з нестабільною стенокардією. Метааналіз ефектів БКК у пацієнтів з нестабільною стенокардією свідчить, що ці препарати не запобігають розвитку гострого інфаркту міокарда і не зменшують смертність. Зокрема, лікування короткодіючим ніфедипіном може асоціюватися з дозозалежним негативним впливом на смертність. Існують докази захисного ефекту дилтіазему і верапамілу при інфаркті міокарда без елевації сегмента ST при відсутності систолічної дисфункції лівого шлуночка. Призначення БКК доцільне у пацієнтів з протипоказаннями до β-адреноблокади, а також у підгрупі пацієнтів з варіантною стенокардією. Дигідропіридини не повинні застосовуватися без супутньої терапії β-адреноблокаторами.
5.2. Коронарна реваскуляризація
5.2.1. Коронарна ангіографія
Коронарна ангіографія – єдиний метод дослідження, який дозволяє оцінити наявність та ступінь вираженості ураження вінцевих артерій. Рішення про проведення втручання базуються на даних коронарної ангіографії. Проведення коронарної ангіографії у хворих ГКС не потребує особливих пересторог. Лише у випадках гемодинамічної нестабільності (набряку легень, гіпотензії, тяжких небезпечних для життя аритмій) інколи бажано здійснити дослідження із застосуванням внутрішньоаортальної балонної помпи, обмежити кількість коронарних ін’єкцій і не виконувати вентрикулографію, яка може дестабілізувати стан гемодинаміки. Результати досліджень свідчать про те, що у 30-38% пацієнтів з нестабільними коронарними синдромами діагностують ураження однієї, а в 44-59% – кількох вінцевих артерій. Частота гемодинамічно незначущого ураження вінцевих артерій становить від 14 до 19%. Стеноз стовбура лівої вінцевої артерії діагностують у 4-8%. Опис ”причинного” пошкодження є надзвичайно суттєвим фактором вибору відповідних втручань.
5.2.2. Черезшкірне коронарне втручання
Безпечність та ефективність ЧКВ при ГКС істотно поліпшилися завдяки застосуванню стентів і призначенню блокаторів рецепторів GP IIb/IIIa. Імплантація стента за нестабільних форм ІХС – безпечна процедура, яка дозволяє механічно стабілізувати розірвану атеросклеротичну бляшку в місці пошкодження. Така перевага стентування особливо важлива при пошкодженнях з високим ризиком. Усі пацієнти, яким проводять ЧКВ, повинні отримувати аспірин і гепарин. Паралельне введення блокаторів рецепторів GP IIb/IIIa рекомендують починати перед процедурою і продовжувати протягом 12 (абсиксимаб) або 24 год (інші препарати з цієї групи) після процедури.
У всіх дослідженнях у пацієнтів з ГКС, яким проводили ЧКВ, смертність, асоційована з перкутанним втручанням, дуже низька. Після імплантації стента пацієнта, як правило, можна швидко виписати з рекомендацією приймати клопідогрель і аспірин протягом мінімум 1 місяця. Результати дослідження РСІ-CURE дозволяють припускати, що тривале (в середньому 8 міс) застосування клопідогрелю після проведення перкутанної транслюмінальної ангіопластики асоціюється з меншою частотою смерті від серцево-судинних причин, інфаркту міокарда та реваскуляризації.
5.2.3. Хірургічне шунтування вінцевих артерій
Застосування сучасних хірургічних методів асоціюється з низькою операційною летальністю. З огляду на результати досліджень, попередня агресивна антитромбоцитарна терапія повинна розглядатися лише як відносне протипоказання до раннього АКШ. Застосування антитромбоцитарних засобів може вимагати специфічних хірургічних заходів для обмеження кровотечі, у деяких випадках – переливання тромбоцитарної маси. Втім, якщо немає показань для невідкладного хірургічного втручання, краще припинити прийом препарату (аспірин, клопідогрель) і виконати втручання через 5 днів.
5.2.4. Інтервенційна або медикаментозна стратегія лікування
Сучасна інвазивна стратегія, якій передує застосуванню сучасних антиішемічних і антитромботичних ліків, у пацієнтів з нестабільною стенокардією з високим ступенем ризику зменшує ризик смерті, інфаркту міокарда, кількість симптомів і повторних госпіталізацій порівняно з консервативною стратегією.
6. Стратегія ведення пацієнтів з гострим коронарним синдромом
6.1. Оцінка при госпіталізації
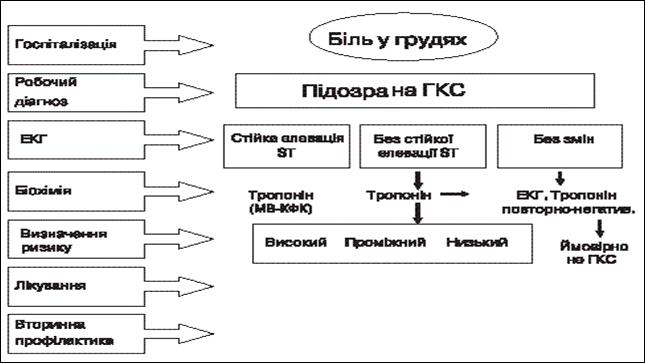
Більшість пацієнтів відчуває лише дискомфорт у грудній клітці (біль у грудній клітці), у такому випадку підозра на ГКС є робочим діагнозом. Початкове обстеження включає чотири кроки (рис. 2):
1) Докладне опитування із зазначенням симптомів. Фізикальне дослідження, під час якого особливу увагу звертають на можливу наявність захворювання клапанного апарату серця (аортальний стеноз), гіпертрофічної кардіоміопатії, серцевої недостатності та захворювання легень.
2) Реєстрація ЕКГ. Порівняння з попередньою ЕКГ є дуже корисним. ЕКГ дозволяє диференціювати пацієнтів з підозрою на ГКС на дві категорії, які потребують різних терапевтичних підходів:
- 1. пацієнти з елевацією сегмента ST, що свідчить про повну оклюзію великої вінцевої артерії; їм показана негайна реперфузійна терапія;
- 2. пацієнти зі змінами сегмента ST, але без стійкої елевації сегмента ST, або з нормальною ЕКГ.
У деяких випадках наявні невизначені зміни ЕКГ, такі як блокада ніжки пучка Гіса або ритм пейсмекера.
3) Для подальшої характеристики хворих необхідне проведення лабораторних досліджень, які включають аналіз рівня гемоглобіну (для виявлення анемії), маркерів пошкодження міокарда, бажано серцевого тропоніну Т або І. Підвищення їх концентрації свідчить про незворотне пошкодження клітин і повинно розглядатися як свідчення інфаркту міокарда.
4) Період спостереження, який включає моніторування ЕКГ. Якщо у пацієнта виникає новий епізод болю в грудній клітці, слід зареєструвати ЕКГ у 12 відведеннях і порівняти її із записом після спонтанного припинення симптомів або прийому нітратів. Додатково можна провести ехокардіографічне дослідження для оцінки функції лівого шлуночка та виключення інших причин болю в грудній клітці. Друге вимірювання рівня тропоніну потрібно зробити через 6-12 год.
Початкове обстеження дозволяє виставити діагноз ГКС, відрізнити інфаркт міокарда і нестабільну стенокардію від інших захворювань та невизначених причин симптомів.
Хворим з ГКС без стійкої елевації сегмента ST потрібно призначити ліжковий режим з моніторуванням ЕКГ для виявлення ішемії міокарда або аритмій. Хворим з лівошлуночковою недостатністю та зниженням парціального тиску кисню у крові нижче 90% необхідно застосовувати оксигенотерапію. Хворі повинні отримувати початкове лікування, яке включає аспірин у дозі 80-150 мг на добу, клопідогрель, фондапаринукс чи НМГ або НФГ, бета-адреноблокатор, а також пероральні або внутрішньовенні нітрати у випадку стійкого або повторного болю у грудній клітці. У разі неефективності внутрішньовенної інфузії нітратів, при наявності лівошлуночкової недостатності чи збудженні хворого показано внутрішньовенне введення морфіну. Пацієнтам із гіперчутливістю або іншими шлунково-кишковими проявами непереносності аспірину призначають клопідогрель. Антагоністи кальцію можна призначати замість бета-адреноблокаторів пацієнтам, які мають протипоказання або не переносять бета-адреноблокатори. Протягом подальшого періоду спостереження (6-12 год) потрібно звертати особливу увагу на повторні епізоди болю в грудній клітці, під час яких потрібно записати ЕКГ. Ретельно відстежують та коригують ознаки гемодинамічної нестабільності (гіпотензія, хрипи в легенях). У хворих з гострою дисфункцією лівого шлуночка, застійною серцевою недостатністю, цукровим діабетом та артеріальною гіпертензією, яка не контролюється прийомом нітратів та бета-адреноблокаторів, показано застосування інгібіторів ангіотензинперетворюючого ферменту (АПФ).
Протягом початкового періоду на основі клінічних, електрокардіографічних та біохімічних даних оцінюють ризик та вибирають подальшу стратегію лікування.
Рис. 2. Початковий етап допомоги хворим з підозрою на ГКС.
6.2. Стратегії ведення хворих відповідно до стратифікації ризику
У хворих з ГКС ступінь ризику оцінюють на підставі клінічних, біологічних та ангіографічних показників.
До факторів несприятливого прогнозу належать:
1) повторна ішемія міокарда (повторні епізоди болю в грудній клітці або динамічні зміни сегмента ST, особливо депресія сегмента ST або минуща елевація сегмента ST) на фоні проведення антиангінальної терапії;
2) рання постінфарктна нестабільна стенокардія;
3) підвищений рівень тропоніну;
4) нестабільність гемодинаміки протягом періоду спостереження;
5) тяжкі порушення ритму (повторні епізоди шлуночкової тахікардії, фібриляція шлуночків);
6) цукровий діабет;
7) графіка ЕКГ, яка не дозволяє оцінити зміни сегмента ST.
Пацієнти з кількома (двома або більше) факторами несприятливого прогнозу можуть бути віднесені до групи високого ризику розвитку інфаркту міокарда та кардіальної смерті. У цих пацієнтів рекомендують проводити ранню інвазивну стратегію лікування (рис. 3).
Під час очікування та підготовки до ангіографії продовжити застосування НМГ (еноксапарин). Навантажувальна доза клопідогрелю може бути збільшена до 600 мг. Почати введення блокатора рецепторів GP IIb/IIIa. Коронарну ангіографію слід планувати якомога раніше, але без невиправданої ургентності. У відносно невеликої групи пацієнтів коронарну ангіографію потрібно проводити протягом першої години. До них відносять пацієнтів з вираженою рефрактерною ішемією міокарда, тяжкими аритміями, гемодинамічною нестабільністю. У більшості випадків коронарну ангіографію слід проводити протягом 48 год або принаймні протягом періоду госпіталізації.
Якщо під час ангіографії не знаходять уражень, при яких потрібна реваскуляризація, що зумовлене вираженим ступенем пошкодження судин і/або недостатнім дистальним відтоком, або не знаходять виражених коронарних стенозів, пацієнтам призначають медикаментозну терапію. Можливо, діагноз ГКС потрібно переглянути, а особливу увагу звернути на можливі інші причини симптомів. Проте, відсутність тяжкого стенозу не виключає діагнозу ГКС.
До групи з низьким ступенем ризику належать пацієнти:
-а. без повторних епізодів болю в грудній клітці протягом періоду спостереження;
-б. без депресії або елевації сегмента ST, але з негативними зубцями Т, плоскими зубцями Т або нормальною картиною ЕКГ;
-в. без елевації рівня тропоніну або інших біохімічних маркерів пошкодження міокарда при початковому та повторному вимірюванні (проведеному в період 6-12 год).
Цих пацієнтів слід лікувати із застосуванням пероральних форм препаратів, зокрема аспірину, клопідогрелю (навантажувальна доза 300 мг, далі 75 мг на день), β-адреноблокаторів, можливо, нітратів і антагоністів кальцію. Слід почати заходи з вторинної профілактики, описані нижче. Лікування із застосуванням фодапаринуксу/НМГ можна припинити, коли після закінчення періоду спостереження немає змін на ЕКГ і в другому підряд аналізі не виявлено підвищення активності тропоніну.
Рекомендують проводити стрес-тест. Мета цього тестування – по-перше, підтвердити чи встановити діагноз ІХС і, по-друге, у невизначених випадках, оцінити ризик подальших подій у пацієнтів з ІХС.
У пацієнтів з вираженою ішемією під час стрес-тесту доцільно оцінити необхідність коронарної ангіографії з подальшою реваскуляризацією, особливо якщо ішемія виникає при малих навантаженнях. У деяких випадках проводять стрес-ехокардіографію або перфузійну сцинтиграфію міокарда під час навантаження.
У деяких пацієнтів діагноз може залишатися нез’ясованим, особливо якщо протягом періоду спостереження зберігається нормальна картина ЕКГ, не виявлено маркерів некрозу міокарда, порушень під час виконання стрес-тесту та змін толерантності до фізичного навантаження. Симптоми, які зумовили госпіталізацію, напевно, не були викликані ішемією міокарда, і тому потрібне додаткове обстеження інших систем органів. У будь-якому випадку ризик серцевих подій у таких пацієнтів дуже низький. Тому додаткове обстеження можна провести пізніше, в амбулаторних умовах.
Пацієнти, які не входять до цих двох груп (високого та низького ризику), належать до групи проміжного ризику (основна частина хворих) (схема). Цим пацієнтам слід рекомендувати лікування аспірином, клопідогрелем (навантажувальна доза – 300 мг, далі 75 мг на день), β-адреноблокаторами, нітратами і, можливо, антагоністами кальцію. Як антикоагулянтну терапію рекомендовано використовувати фондапаринукс або еноксапарин (низький ризик кровотеч). Спостереження та лікування цієї категорії хворих проводять у стаціонарних умовах. У разі виявлення під час спостереження додаткових факторів ризику або у разі неефективності антиангінальної терапії стратегія ведення хворих така ж, як у пацієнтів з високим ризиком розвитку ускладнень.
Стрес-тест рекомендовано проводити у разі стабілізації стану хворих перед випискою із стаціонару. У пацієнтів з вираженою ішемією під час стрес-тесту доцільно проводити коронарну ангіографію з подальшою реваскуляризацією, особливо якщо ішемія виникає при малих навантаженнях. Якщо результати проби з навантаженням непереконливі, рекомендовано провести стрес-ехокардіографію або перфузійну сцинтиграфію міокарда під час навантаження.
Рис. 3. Ведення хворих з ГКС залежно від ступеня ризику розвитку гострого інфаркту міокарда і смерті.

Тривале ведення хворих
Більшість серцевих подій реєструють протягом кількох місяців після перших клінічних проявів ГКС. Початкова стабілізація стану пацієнта не означає стабілізації базисного патологічного процесу. Даних щодо тривалості процесу заживлення розірваної атеросклеротичної бляшки небагато. Деякі дослідження свідчать про можливість швидкого прогресування ”причинних” уражень при ГКС, незважаючи на початкову клінічну стабілізацію на фоні медикаментозної терапії. Підвищення утворення тромбіну спостерігали протягом 6 міс після епізоду нестабільної стенокардії або інфаркту міокарда. Незважаючи на це, довготривала терапія НМГ (дальтепарин) є безпечною і ефективною лише у пацієнтів, які очікують інвазивного втручання. Наполеглива модифікація факторів ризику показана всім пацієнтам, яким діагностовано ГКС.
Пацієнти повинні припинити курити. Їх потрібно проінформувати про шкідливість куріння як важливого фактора ризику. Слід оптимізувати контроль рівня артеріального тиску. Потрібно призначити аспірин у дозі 75-150 мг. Згідно з даними метааналізу призначення більших доз аспірину не має переваг. У пацієнтів, які раніше перенесли інфаркт міокарда, призначення аспірину у середньому протягом 27 міс дозволяє зменшити кількість судинних подій на 36 на 1000 пацієнтів, включаючи на 18 менше випадків нефатального інфаркту міокарда і на 14 менше випадків смерті.
Клопідогрель у дозі 75 мг потрібно призначати протягом, принаймні, 9 міс, можливо 12 міс. У цьому випадку дозу аспірину слід зменшити до 80-100 мг. Бета-адреноблокатори покращують прогноз у пацієнтів, які перенесли інфаркт міокарда, і після перенесеного ГКС лікування цими препаратами потрібно продовжувати. Ліпідознижувальну терапію потрібно розпочати без затримки (на 1-4-ту добу після госпіталізації) всім хворим (за відсутності протипоказань) незважаючи на рівень холестерину. Застосування інгібіторів HMG-CoA-редуктази приводить до істотного зниження смертності та ймовірності розвитку коронарних подій у пацієнтів з високим, проміжним або навіть низьким (менше 3 ммоль/л) рівнем холестерину ліпопротеїдів низької щільності. Поліпшення клінічного виходу не обов’язково супроводжується регресом атеросклерозу, а пов’язано з протизапальною дією, нормалізацією функції ендотелію, зменшенням активності протромботичних факторів. Цільовий рівень холестерину ліпопротеїдів низької щільності – менше 2,6 ммоль/л. Самостійне значення у вторинній профілактиці коронарних синдромів можуть відігравати інгібітори АПФ. Корисна дія інгібіторів АПФ не обмежується тільки контролем рівня артеріального тиску, а пов’язана також зі стабілізацією атеросклеротичної бляшки. Зменшення розвитку несприятливих коронарних подій було показано при тривалому застосуванні раміприлу та периндоприлу.
З огляду на те, що коронарний атеросклероз та його ускладнення зумовлені багатьма причинами, слід приділяти велику увагу корекції всіх факторів ризику, які модифікуються, для того щоб зменшити частоту розвитку нових серцевих подій.
7. Підсумки
ГКС є важливою проблемою медицини. Незважаючи на сучасні методи лікування, показники смертності, частоти виникнення інфаркту міокарда та повторної госпіталізації внаслідок ГКС протягом 6 міс спостереження залишаються дуже високими.
Після клінічного обстеження необхідно зареєструвати ЕКГ, після чого почати тривале моніторування сегмента ST-T у множинних відведеннях, якщо це можливо. Слід отримати зразки крові для визначення рівня тропоніну Т або І, а також МВ-КФК.
Виділяють напрямки ведення хворих в залежності від типу ГКС:
* Пацієнти з елевацією сегмента ST потребують невідкладної коронарної реканалізації шляхом ЧКВ або тромболізису.
* Пацієнти без стійкої елевації сегмента ST повинні отримувати базисне лікування, в тому числі аспірин, фондапаринукс/НМГ, клопідогрель, β-адреноблокатори (якщо не протипоказані) та нітрати. На основі клінічних даних, ЕКГ та визначення рівня тропоніну потрібно здійснити стратифікацію ризику.
Розрізняють три категорії пацієнтів з ГКС:
1) До категорії пацієнтів з високим ступенем ризику розвитку ускладнень належать пацієнти з наявністю кількох (двох або більше) факторів несприятливого прогнозу (стійка або зворотна ішемія, депресія сегмента ST, цукровий діабет, підвищений рівень тропоніну, гемодинамічна або аритмічна нестабільність). Ці пацієнти потребують протягом періоду госпіталізації, додатково до базисного лікування, інфузії інгібітора рецепторів GP IIb/IIIa, після чого їм здійснюють коронарну ангіографію. Це дослідження виконують невідкладно у пацієнтів з гемодинамічною нестабільністю або рецидивуючими небезпечними для життя аритміями. Пацієнти з ураженням судин, у яких можна виконати ЧКВ, отримують клопідогрель. Цей препарат призначають також пацієнтам з пошкодженнями вінцевих судин, які не підлягають будь-якій формі реваскуляризації. У пацієнтів, яким планують проведення АКШ, слід призупинити терапію клопідогрелем принаймні за 5 днів до операції, якщо строки операції не змінені. Прийом клопідогрелю потрібно також припинити у випадку нормальної картини ангіограми.
2) До категорії пацієнтів з низьким ступенем ризику розвитку ускладнень належать пацієнти без зворотного болю в грудній клітці, з інверсією зубця Т, сплощеними зубцями Т або нормальною ЕКГ, а також негативним результатом аналізу тропонінів. У цих випадках аналіз тропонінів слід повторити через 6-12 год. Якщо це дослідження двічі дає негативний результат, терапію гепарином можна поступово припинити. Слід продовжити прийом аспірину, β-адреноблокаторів і нітратів і призначити клопідогрель. Перед випискою або протягом наступних днів потрібно здійснити стрес-тест для оцінки ймовірності та тяжкості ІХС. Після цього дослідження можна провести коронарну ангіографію.
3) До категорії пацієнтів з проміжним ризиком розвитку ускладнень належить основна частина хворих. Цим пацієнтам призначають аспірин, клопідогрель, β-адреноблокатори, нітрати і, можливо, антагоністи кальцію, а також фондапаринукс або еноксапарин (при низькому ризику кровотеч). Спостереження та лікування цієї категорії хворих проводиться у стаціонарних умовах. У разі виявлення під час спостереження додаткових факторів ризику або у разі неефективності антиангінальної терапії ведення хворих таке ж, як у пацієнтів з високим ризиком розвитку ускладнень. Після стабілізації стану хворим проводять стрес-тест, мета якого – оцінити ризик подальших коронарних подій, а також доцільність проведення коронарної ангіографії. За результатами ангіографії приймається рішення стосовно необхідності реваскуляризації міокарда, яка проводиться у плановому порядку.
У всіх випадках слід продовжувати агресивну корекцію факторів ризику: відмова від куріння, регулярні навантаження, прийом аспірину і клопідогрелю протягом принаймні 12 місяців, терапія β-адреноблокаторами (якщо немає протипоказань) і статинами.
#. Додатки
Додаток 1. Перелік скорочень.
| Скорочення | Значення |
| АКШ | – аорто-коронарне шунтування |
| АМН | – академія медичних наук |
| АПФ | – ангіотензинперетворюючий фермент |
| ББК | – блокатори кальцієвих каналів |
| ГКС | – гострий коронарний синдром |
| ЕКГ | – електрокардіограма |
| КФК | – креатинфосфокіназа |
| МНС | – міжнародне нормалізаційне співвідношення |
| НМГ | – низькомолекулярний гепарин |
| НФГ | – нефракційований гепарин |
| ПТКА | – перкутанна коронарна ангіопластика |
| СРП | – С-реактивний протеїн |
| ЧКВ | – черезшкірне коронарне втручання |
| ІХС | – ішемічна хвороба серця |






