Титрование проводят следующим образом. В бюретку помещают стандартный раствор (раствор известной концентрации 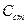 ). Бюретка - это тонкая градуированная стеклянная трубка с краном на конце для измерения объема жидкости, позволяющая приливать стандартный раствор отдельными каплями.
). Бюретка - это тонкая градуированная стеклянная трубка с краном на конце для измерения объема жидкости, позволяющая приливать стандартный раствор отдельными каплями.
В колбу помещают точно измеренный объем анализируемого раствора ( ), добавляют индикатор. По каплям в колбу из бюретки приливают стандартный раствор. Между анализируемым и стандартным растворами происходит реакция. Стандартный раствор добавляют до окончания реакции, на что указывает изменения окраски индикатора. Объем стандартного раствора (
), добавляют индикатор. По каплям в колбу из бюретки приливают стандартный раствор. Между анализируемым и стандартным растворами происходит реакция. Стандартный раствор добавляют до окончания реакции, на что указывает изменения окраски индикатора. Объем стандартного раствора (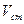 ), израсходованный на титрование, определяют по шкале бюретки.
), израсходованный на титрование, определяют по шкале бюретки.
Расчет концентрации анализируемого раствора проводят по формуле:
 ,
,
где  - молярная концентрация эквивалент, моль/л;
- молярная концентрация эквивалент, моль/л;
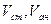 - мл.
- мл.
Задача.
Вычислить концентрацию щелочи в растворе, если на титрование 50 мл этого раствора потребовалось 4,6 мл раствора кислоты, молярная концентрация эквивалента которого 0,1 моль/л.
В данной задаче анализируемы раствор – это раствор щелочи, стандартный раствор – раствор кислоты.
Дано:

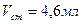
Решение:
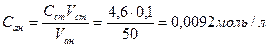
Приложение 4. Расчеты по уравнению химической реакции с участием растворов.
Если при проведении реакции используется раствор, необходимо учесть, что в химическом взаимодействии участвует только растворенное вещество, а не весь раствор.
Задача 1.
Какой объем раствора соляной кислоты, молярная концентрация которого 0,05 моль/л, взаимодействует с 4,8 г магния?
Дано:
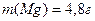



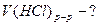
Решение:
По уравнению реакции находим массу чистой HCl, которая взаимодействует с 4,8 г магния.
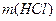
Mg + 2HCl = MgCl2 + H2

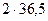
 ,
, 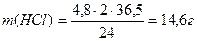
Находим, в каком объеме раствора соляной кислоты, молярная концентрация которого 0,05 моль/л, содержится 14,6 г HCl.
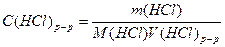 , тогда
, тогда

Задача 2.
Какая масса BaSO4 образуется при взаимодействии нитрата бария с 5 г раствора серной кислоты, в котором массовая доля H2SO4 2%?
Дано:


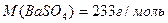

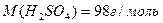
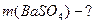
Решение:
Находим массу чистой H2SO4, которая содержится в 5 г раствора:
 , тогда
, тогда
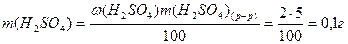
Зная массу чистой H2SO4, по уравнению реакции находим массу BaSO4:
0,1 г 
Ba(NO3)2 + H2SO4 = BaSO4 + 2HNO3
98 233
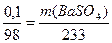 ,
, 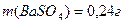
Приложение 5. Кривые растворимости некоторых веществ в воде
Приложение 6. Зависимость растворимости газов в воде от температуры при атмосферном давлении
Приложение 7. Экспериментальное определение молярной массы растворенного вещества
Задача.
Раствор, содержащий 60 мочевины в 500 г воды, кипит при температуре 101,040С. Определить молярную массу мочевины. Эбуллиоскопическая постоянная воды равна 0,52.
Дано:
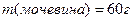
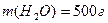


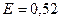

Решение:
Находим повышение температуры кипения раствора:
 .
.
Находим моляльную концентрацию раствора:
 ,
, 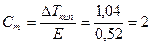 .
.
Находим молярную массу мочевины:
 ,
,

Задача.
При 200С осмотическое давление раствора, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина, равно 243,4 кПа. Определить молекулярную массу гематина.
Дано:
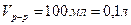



Решение:
Осмотическое давление раствора неэлектролита рассчитывается по формуле:
 .
.
Находим молярную концентрация раствора:
 .
.
Находим молярную массу гематина:
 ,
,







