Матеріали та обладнання: 1) стерильні чашки Петрі, 2) стерильні колби на 0,5 л, 3) стерильні пробірки і піпетки на 1 мл, 4) 100 г досліджуваного грунту, 5) терези і важки, б) пробірки з стерильним поживним середовищем, 7) водяна баня, 8) електрична плитка, 9) фільтрувальний папір, 10) стерильна вода, 11)воскові, олівці, 12) термостат, 13) апарат для підрахунку колоній бактерій, 14) стерильні мірні колби на 100 мл.
Основні відомості. Цей метод дослідження мікрофлори грунту за своєю точністю значно поступається перед методами прямого підрахунку бактерій під мікроскопом. Він дає тільки орієнтовні дані переважно про кількість аеробних мікробів у грунті. Проте внаслідок простоти і доступності його дуже часто застосовують у мікробіологічній практиці.
Найкращим поживним середовищем для аеробних гнильних мікроорганізмів грунту є м'ясо-пептонний агар (МПА) і бобово-
1 Трафарет виготовляють так: заштриховують тушшю 4 см.2 на міліметровому папері. Його приклеюють до предметного скла.
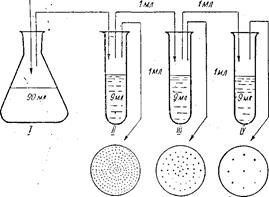
Рис. 34. Схема посіву з розбавлень ґрунтової суспензії.
пептонний агар (БПА), що мають слабколужну реакцію. Ці середовища при застиганні утворюють агарові пластинки, на яких зручно робити кількісний і якісний аналіз колоній. Ще краще застосовувати для цієї мети ґрунтовий агар.
Проведення роботи. Беруть певний ґрунтовий зразок, відважують з нього 1 г грунту і роблять серію розведень в стерильній воді для одержання ґрунтової витяжки.
Розведення роблять так: у стерильну мірну колбу на 100 мл вносять 1 г грунту, додають 99 мл. стерильної води і збовтують протягом 3 хв. Потім відстоюють 1,5 хв і роблять наступне розведення (схему розведень див. на рис. 34).
Для виготовлення кожної нової концентрації еруть стерильну піпетку.
У три стерильні чашки Петрі обережно виливають по 1 мл ґрунтової суспензії (розведення 1: 100 000) і розподіляють рівномірне по дну. Далі беруть пробірку з розплавленим поживним середовищем (температура 40—45° С), виливають у чашку і, обережно похитуючи чашкою, перемішують поживне середовище з ґрунтовою суспензією.
Засіяні чашки Петрі позначають і ставлять у термостат при температурі 28° С на три доби. Після цього підраховують (без відкривання кришки чашки) кількість колоній, що виросли на агарових пластинках. Якщо на площі чашки Петрі виросло дуже багато колоній, то для полегшення підрахунку її ділять на сектори, або ще краще використовують спеціальний прилад для підрахунку кількості колоній.
Після цього визначають середнє з 3-ох чашок і множать на розведення, взяте для аналізу. Таким способом одержують кількість
1До 1 л грунтової витяжки додають 0.5 г К2НРО4 і 20,2г агару. Середовище стерилізують протягом зохв під тиском 0,5атм. аеробних мікробів в 1 г досліджуваного сирого грунту. Оскільки підрахунки робляться на абсолютно сухий грунт, то для цього треба визначити вологість ґрунтової проби. І тільки після цього одержаний результат, на сирий грунт можна перерахувати на абсолютно сухий, поділивши його на наважку абсолютно сухого грунту, що міститься в 1 г сирого грунту.
Приклад. У першій чашці виросло 180 колоній, в другій 190,
а в третій — 230. Тоді в 1 г грунту буде  X 100 000 =
X 100 000 =
= 20 000 000 мікроорганізмів.
Після кількісного аналізу роблять опис культуральних (форма колоній, країв, вигляд центру, поверхні колоній тощо) і морфологічних (форма бактерій, здатність до руху, характер розміщення джгутиків, чутливість до фарбування за Грамом тощо) ознак досліджуваних мікробів. Студентам, рекомендується описати 3—4 найхарактерніші колонії. Всі записи і зарисовки заносять у протоколи робіт.
Дослідження мікрофлори грунту методом пластинок обростання (за М. Г. Холодним)
»
Матеріали та обладнання: 1) мікроскопи, 2) предметні стекла, 3) гострий ніж, 4) спиртівки, 5) стакани на 200 мл, 6) 1%-ний розчин; еритрозину в 5%-ному фенолі, 7) кедрова олія, 8) фільтрувальний папір, 9) ганчірка, 10) вода.
Основні відомості. На відміну від попередніх методів дослідження мікрофлори грунту, які основані на використанні штучних поживних середовищ, метод пластинок обростання (за М. Г. Холодним) дає можливість вивчати цілі мікробні асоціації безпосередньо в грунті, тобто в природному середовищі. За допомогою цього методу можна одержати дані не тільки про склад мікробних асоціацій певного грунту, а й уявлення про відносне багатство грунту мікроорганізмами (при порівнянні даних про різні грунти).
Крім методу пластинок обростання М. Г. Холодний розробив і інші методи дослідження мікрофлори грунту, наприклад метод ґрунтових камер і метод пророщування ґрунтового пилу. Ці методи ефективніші, ніж метод пластинок обростання, і знайшли широке застосування в мікробіологічній практиці. Студентам можна рекомендувати проводити вивчення мікрофлори грунту методом пророщування ґрунтового пилу, оскільки для методу-ґрунтових камер не завжди можна знайти спеціальну, апаратуру для виготовлення пластинок пресованого грунту.
Проведення роботи. Метод пластинок обростання. На рівній поверхні грунту роблять гострим ножем розріз, глибина якого залежить від досліджуваного ґрунтового горизонту. До вертикальної стінки зрізу щільно прикладають стерильне знежирене предметне скло. Скло повинно знаходитися в грунті на 2— Зсм нижче від його поверхні. Зверху зріз закривають грунтом. Місце, де встановлено скло, позначають. Витримують скло у грунті залежно від мети досліду 10—15 днів, а інколи й кілька місяців. Після цього обережно ножем знімають землю її виймають скло.
Поверхню скла, що була притулена до стінки ґрунтового розрізу, висушують на повітрі і фіксують на полум'ї спиртівки. Протилежну сторону витирають сухою ганчіркою. Після фіксації предметне скло занурюють в банку з водою верхньою стороною донизу. При цьому великі частинки грунту відмокають і падають на дно, а мікроби та дрібні частинки залишаються на склі. Закінчивши промивання, препарат фарбують еритрозином протягом 30 хв, висушують і вивчають під мікроскопом з імерсійною системою.






