Адсорбція на межі поділу фаз.
Ізотерми поверхневого натягу та адсорбції.
Сорбція – це процес поглинання якою-небудь речовиною інших речовин.
Адсорбція – це процес сорбції, який іде тільки на поверхні і призводить до збільшення концентрації речовини на поверхні поділу фаз (наприклад: тверде тіло – газ, тверде тіло – рідина).
Абсорбція – це процес сорбції, коли речовина, що поглинається, дифундує в глибину поглинача та розподіляється по об’єму.
Адсорбент – це речовина, на поверхні якої відбувається адсорбція.
Адсорбат – це речовина, яка адсорбується.
 |






 |


адсорбат
 |
адсорбент
Адсорбція абсорбція
Причина сорбції полягає в зменшенні поверхневої енергії частинок, що беруть участь в розділі фаз, тому що зменшується поверхня розділу фаз.
Формули розрахунку адсорбції:
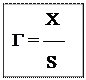
Г – величина адсорбції
 Х – кількість адсорбата, кмоль
Х – кількість адсорбата, кмоль
кмоль/м2 S – площа поверхні адсорбента, м2
Якщо поверхня пориста, то загальну площу поверхні визначити неможливо:
|

кмоль/кг m – маса адсорбента, кг
· Адсорбція на межі тверда речовина – розчин:
|
Г – величина адсорбції
Со – початкова концентрація адсорбата, кмоль/м3
Cрівн – рівноважна концентрація адсорбата, кмоль/м3
m – маса адсорбента, кг
V – об’єм розчину, з якого відбувається адсорбція
Ступінь адсорбції (h) – це відношення кількості адсорбованої речовини до початкової кількості речовини:
|
h – ступінь адсорбції
Со – початкова концентрація адсорбата
Cрівн – рівноважна концентрація адсорбата
· Адсорбція на межі розчин – пара:
|
C – концентрація розчину
R – універсальна газова стала (8,314 Дж/(моль · К)
T – температура, оК
∆C – зміна концентрації (∆C = Со – 0);
вважаємо, що ∆C = Свих
∆σ – зміна поверхневого натягу
∆σ = σр-ну – σрозчинника
Ізотерма адсорбції:
· адсорбція залежить від концентрації;
· адсорбція залежить від температури;
· адсорбція залежить від тиску (для газів).
Якщо Т = const – ізотерма
 Г Висновки: 1. При малих концентраціях адсорбція
Г Висновки: 1. При малих концентраціях адсорбція

 Гмакс – – – – – – пропорційна концентрації.
Гмакс – – – – – – пропорційна концентрації.
2. При великих концентраціях адсорбція
підходить до межі Гмакс (принцип насичуваності).
С
ізотерма адсорбції Ленгмюра
Поняття про поверхневий натяг:
На молекулу А діють інші молекули з однаковою
пара Б силою, тому сили міжмолекулярної взаємодії




 врівноважені. Якщо це молекула на поверхні поділу фаз рідина – газ (молекула Б), то взаємодія з
врівноважені. Якщо це молекула на поверхні поділу фаз рідина – газ (молекула Б), то взаємодія з


 рідина молекулами газу менше і молекула намагається втягнутися в середину рідини (в такому стані вона
рідина молекулами газу менше і молекула намагається втягнутися в середину рідини (в такому стані вона
 буде мати меншу Е). Це в свою чергу призводить
буде мати меншу Е). Це в свою чергу призводить



 до зменшення площі поверхні (крапля має форму
до зменшення площі поверхні (крапля має форму
кульки). Для того, щоб повернути молекулу на
А поверхню, треба здійснити роботу:
F = nσ1 F – поверхнева енергія
n – кількість повернутих молекул
σ1 – робота
σ = F/S σ – поверхневий натяг, Дж/м2
S – площа поверхні
Поверхневий натяг – це сила, що діє на поверхні і намагається скоротити вільну поверхню до найменших розмірів при даному об’ємі.
|
V – об’єм рідини
ρ – густина рідини
R – радіус капіляра
g – прискорення вільного падіння
Ізотерми поверхневого натягу:
σ 
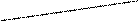

 1 – поверхнево-активні речовини (ПАР) – це речовини,
1 – поверхнево-активні речовини (ПАР) – це речовини,
які зменшують поверхневий натяг (речовини, що
3 містять полярні групи – спирти, жирні кислоти,
2 аміни, мила та інші);
2 – речовини, що не змінюють поверхневого натягу;
3 – поверхнево-неактивні речовини – це речовини, що
1 підвищують поверхневий натяг (неорганічні
кислоти, луги, солі).
С
Молекули багатьох поверхнево-активних речовин мають дифільну будову (хвіст – гідрофобний, а головка – гідрофільна).








 пара при збільшенні
пара при збільшенні















 рідина концентрації ПАР Гмакс
рідина концентрації ПАР Гмакс
енергетично більш вигідно
Актуальність знань про поверхневі явища:
1. Механізм дії порошків, пігулок, емульсій, мазей.
2. Виробництво лікарських препаратів (адсорбція).
3. Стабілізація, зберігання, підвищення ефективності терапевтичної дії ліків.
Адсорбція електролітів.






