ƒодаток ј Ѕ”ƒќ¬ј –≈„ќ¬»Ќ»
ј1.Ѕ”ƒќ¬ј ј“ќћј
”€вленн€ про будову матер≥њ та њњ властивост≥ базуютьс€ на пон€тт€х атом-но-молекул€рного вченн€, зг≥дно з €ким, ус≥ речовини складаютьс€ з атом≥в.
јтоми Ч реально ≥снуюч≥ матер≥альн≥ об'Їкти, що характеризуютьс€ певни-ми масою, розм≥рами, складом, зар€дом €дра, будовою електронноњ оболонки та ≥ншими властивост€ми.
ћаси атом≥в мають дуже мал≥ значенн€ (в межах 10-27 Ч 10-25 кг). ¬ х≥м≥њ част≥ше њх виражають в атомних одиниц€х маси (1 а.о.м. = 1, 661Ј10-27 кг). –ад≥-уси атом≥в становл€ть близько 10-10 м.
јтом складаЇтьс€ з позитивно зар€дженого €дра ≥ негативно зар€джених електрон≥в, що утворюють електронну оболонку, розм≥ри €коњ обумовлюють розм≥ри атома. ¬ €др≥ вм≥щуЇтьс€ основна маса атома (приблизно 10-26 Ч 10-25 кг), хоча рад≥ус його становить 10-15 Ч 10-14 м, тобто в 105 раз≥в менший за рад≥ус атома.
ядро складаЇтьс€ з нуклон≥в Ч протон≥в ≥ нейтрон≥в.
ѕротон (р) Ч це елементарна часточка з масою 1,672Ј10-27 кг (1,00730 а.о.м.) ≥ позитивним зар€дом, €кий дор≥внюЇ 1,602Ј10-19 л або +1 у в≥дносних одиниц€х.
Ќейтрон (n) Ч це електронейтральна елементарна часточка з масою
1, 674Ј10 -27 кг (1, 0087 а.о.м.).
≈лектрон (е) Ч це елементарна часточка з масою 9, 109Ј10-31 кг (у 1836 ра-зи менша за масу протону). «ар€д електрона дор≥внюЇ 1, 602Ј10-19 л. —аме зар€д електрона був прийн€тий за одиницю елементарного електричного зар€ду. ” цих одиниц€х зар€д електрона (-1).
ќск≥льки атом електронейтральний, то число електрон≥в в атом≥ дор≥внюЇ числу протон≥в у його €др≥.
ядра атом≥в будь-€кого х≥м≥чного елемента завжди м≥ст€ть однакове число протон≥в Z, €ке визначаЇтьс€ пор€дковим номером елемента в пер≥одичн≥й систем≥ елемент≥в ƒ.≤.ћенделЇЇва, число нейтрон≥в може бути р≥зним.
«агальне число протон≥в Z ≥ нейтрон≥в N, €к≥ м≥ст€тьс€ в €др≥ атома, називають €дерним масовим числом ј, або просто масовим числом:
ј = Z + N.
—укупн≥сть атом≥в одного виду, €к≥ мають однаковий зар€д, але р≥зне число нейтрон≥в, а тому р≥зн≥ атомн≥ маси, називають ≥зотопами. ¬они позначаютьс€ символом х≥м≥чного елемента з двома ≥ндексами л≥воруч: верхн≥й показуЇ масо-ве число, нижн≥й Ч значенн€ зар€ду €дра. Ќаприклад, у водню Ї три ≥зотопи: прот≥й 11Ќ, дейтер≥й 21Ќ або D, трит≥й 31Ќ або “. Ќа€вн≥сть дек≥лькох ≥зотоп≥в у елемент≥в Ї причиною дробових значень њхн≥х атомних мас.
јтоми, що м≥ст€ть р≥зне число протон≥в Z ≥ нейтрон≥в N, але мають однакове масове число ј, називають ≥зобарами (4018 Ar, 4019 , 4020 —а).
Ѕудова електронних оболонок атом≥в. ”с≥ електрони атома утворюють його електронну оболонку. ¬они розташовуютьс€ навколо €дра шарами ≥ мають р≥зн≥ енерг≥њ €к при переход≥ в≥д шару до шару (р≥зн≥ енергетичн≥ р≥вн≥), так ≥ в межах одного шару (р≥зн≥ енергетичн≥ п≥др≥вн≥).
¬ основ≥ сучасноњ теор≥њ будови атома лежить у€вленн€ про двоњсту корпускул€рно-хвильову природу електрона Ч властивост≥ часточки (маса) та хвил≥ (≥нтерференц≥€, дифракц≥€, фотоелектричний ефект, тощо). ƒл€ електрон≥в справедливе р≥вн€нн€ де Ѕройл€, €ке пов'€зуЇ масу (m) рухомоњ частки з в≥дпов≥дною довжиною хвил≥ (l):
|
|
|
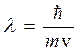 ,
,
де  - стала ѕланка; v Ц швидк≥сть руху частки.
- стала ѕланка; v Ц швидк≥сть руху частки.
≈лектрон в атом≥ можна у€вити €к хмару з певною густиною негативного електричного зар€ду в певному об'Їм≥ простору навколо €дра. ќб'Їм простору навколо €дра, в €кому знаходженн€ електрона найб≥льш ймов≥рне, називаЇтьс€ орб≥таллю (рис.1).
 Z
Z
’
”
–ис.1. ≈лектронна хмара атома √≥дрогену.
ќрб≥тал≥ можуть в≥др≥зн€тис€ своњми розм≥рами, формою та ор≥Їнтац≥Їю у простор≥.
вантов≥ числа. ƒл€ описанн€ стану електрона в атом≥ користуютьс€ квантовими числами: n,  , ml, ms, €к≥ одержан≥ при р≥шенн≥ хвильового р≥вн€нн€ Ўред≥нгера.
, ml, ms, €к≥ одержан≥ при р≥шенн≥ хвильового р≥вн€нн€ Ўред≥нгера.
√оловне квантове число n характеризуЇ в≥ддален≥сть електронноњ хмари в≥д €дра ≥ набуваЇ ц≥лочисельних значень 1, 2, 3, 4Е„им б≥льше n, тим б≥льша енерг≥€ електрона. “ому головне квантове число визначаЇ енерг≥ю електрона ≥ показуЇ енергетичний р≥вень, на €кому знаходитьс€ електрон. ≈нергетичн≥ р≥вн≥ позначаютьс€ також великими л≥терами:
«наченн€ n 1 2 3 4 5
ѕозначенн€ K L M N Q
ќрб≥тальне або поб≥чне квантове число  характеризуЇ форму електронноњ хмари. ¬оно може набувати значень в≥д 0 до (n -1). «наченн€
характеризуЇ форму електронноњ хмари. ¬оно може набувати значень в≥д 0 до (n -1). «наченн€  = 0 в≥дпов≥даЇ електронн≥й хмар≥ з≥ сферичною симетр≥Їю;
= 0 в≥дпов≥даЇ електронн≥й хмар≥ з≥ сферичною симетр≥Їю;  = 1 Ч гантелепод≥бна форма електронноњ хмари;
= 1 Ч гантелепод≥бна форма електронноњ хмари;  = 2 Ч дв≥ перекрит≥ гантел≥.
= 2 Ч дв≥ перекрит≥ гантел≥.
–≥зна форма електронних хмар обумовлюЇ зм≥ну енерг≥њ електрона в межах одного енергетичного р≥вн€, тобто розщепленн€ р≥вн€ на енергетичн≥ п≥др≥вн≥. ≈нергетичн≥ п≥др≥вн≥ позначаютьс€ буквами:
«наченн€  0 1 2 3 4 5
0 1 2 3 4 5
ѕозначенн€ s p d f g h
 |
‘орма ≥ просторова ор≥Їнтац≥€ де€ких електронних хмар наведена на рис.2.
–ис.2. ‘орми ≥ просторов≥ ор≥Їнтац≥њ електронних хмар 1s-,2р- ≥ 3d-електрон≥в.
 ћагн≥тне квантове число ml визначаЇ просторову ор≥Їнтац≥ю електронних хмар ≥ набуваЇ значень в≥д (-
ћагн≥тне квантове число ml визначаЇ просторову ор≥Їнтац≥ю електронних хмар ≥ набуваЇ значень в≥д (-  ) до (+
) до (+  ), всього 2
), всього 2  +1 значень. „исло значень магн≥тного квантового числа вказуЇ на число орб≥талей даноњ форми:
+1 значень. „исло значень магн≥тного квантового числа вказуЇ на число орб≥талей даноњ форми:
s-орб≥таль Ч одна, тому що при  = 0 m = 0;
= 0 m = 0;
p-орб≥таль Ч три, тому що при  = 1 m = -1, 0, +1;
= 1 m = -1, 0, +1;
d-орб≥таль Ч п'€ть, тому що при  = 2 m = -2, -1, 0, +1, +2;
= 2 m = -2, -1, 0, +1, +2;
f-орб≥таль Ч с≥м, тому що при  = 3 m = -3, -2, -1, 0, +1, +2, +3.
= 3 m = -3, -2, -1, 0, +1, +2, +3.
«агальне число орб≥талей на даному енергетичному р≥вн≥ визначаЇтьс€ його головним квантовим числом n ≥ дор≥внюЇ n2. “ак, на I енергетичному р≥вн≥ n = 1, загальне число орб≥талей Ч одна ( = 0, s-орб≥таль); на II енергетичному р≥вн≥ n = 2, загальне число орб≥талей Ч чотири (
= 0, s-орб≥таль); на II енергетичному р≥вн≥ n = 2, загальне число орб≥талей Ч чотири ( = 0, s-орб≥таль ≥
= 0, s-орб≥таль ≥  = 1, три р-орб≥тал≥) ≥ т.≥н.
= 1, три р-орб≥тал≥) ≥ т.≥н.
јтомна електронна орб≥таль Ч це стан електрона в атом≥, що харак-теризуЇтьс€ певними значенн€ми квантових чисел n,  ≥ m, тобто певними розм≥рами, формою та ор≥Їнтац≥Їю в простор≥ електронноњ хмари.
≥ m, тобто певними розм≥рами, формою та ор≥Їнтац≥Їю в простор≥ електронноњ хмари.
—п≥нове квантове число ms обумовлене обертанн€м електрона навколо своЇњ ос≥. —п≥нове квантове число набуваЇ два значенн€: + 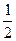 ≥ -
≥ - 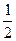 .
.
” багатоелектронних атомах орб≥тал≥ заповнюютьс€ електронами в м≥ру зростанн€ њхньоњ енерг≥њ, доки не розм≥ст€тьс€ вс≥ електрони. ≈лектронн≥ оболонки формуютьс€ з обов'€зковим дотриманн€м таких правил:
1) принципу найменшоњ енерг≥њ;
2) принципу ѕаул≥;
3) правил √унда ≥ лечковського.
ѕринцип найменшоњ енерг≥њ: електрони насамперед займають орб≥тал≥ з найнижчими р≥вн€ми енерг≥њ.
ѕринцип ѕаул≥: в атом≥ не може бути двох електрон≥в з однаковими значенн€ми вс≥х чотирьох квантових чисел. “обто на одн≥й орб≥тал≥ знаходитьс€ не б≥льше двох електрон≥в, €к≥ мають протилежн≥ (антипаралельн≥) сп≥ни (ms = ± 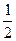 ). «а цим принципом можна розрахувати максимальне число електрон≥в на р≥зних енергетичних р≥вн€х ≥ п≥др≥вн€х.
). «а цим принципом можна розрахувати максимальне число електрон≥в на р≥зних енергетичних р≥вн€х ≥ п≥др≥вн€х.
|
|
|
ќск≥льки на даному р≥вн≥ n може бути n п≥др≥вн≥в, а дл€ кожного п≥др≥вн€ ≥снуЇ 2  +1 орб≥талей, можна п≥драхувати, що максимальна електронна Їмн≥сть п≥др≥вн€ Ч 2(2
+1 орб≥талей, можна п≥драхувати, що максимальна електронна Їмн≥сть п≥др≥вн€ Ч 2(2  +1) електрон≥в. ћаксимальне число електрон≥в Nе на енергетичному р≥вн≥ Ч 2n2.
+1) електрон≥в. ћаксимальне число електрон≥в Nе на енергетичному р≥вн≥ Ч 2n2.
ѕравило √унда: ст≥йкому стану атома в≥дпов≥даЇ такий розпод≥л електрон≥в у межах енергетичного п≥др≥вн€, при €кому абсолютне значенн€ сумарного сп≥на атома Ї максимальним. “обто п≥д час заповненн€ п≥др≥вн€ електрони пос≥дають р≥зн≥ орб≥тал≥ (доти, доки це можливо) та сп≥ни поодиноких електрон≥в, що знаход€тьс€ на р≥зних орб≥тал€х, паралельн≥.
ѕравило лечковського: з≥ зб≥льшенн€м зар€ду €дра атома посл≥довне заповненн€ електронних орб≥талей в≥дбуваЇтьс€ в≥д орб≥талей з меншим значенн€м суми головного й орб≥тального квантових чисел (n +  ) до орб≥талей з б≥льшим значенн€м ц≥Їњ суми. «а однакових значень суми (n + l) заповненн€ орб≥талей в≥дбуваЇтьс€ посл≥довно в напр€мку зростанн€ головного квантового числа.
) до орб≥талей з б≥льшим значенн€м ц≥Їњ суми. «а однакових значень суми (n + l) заповненн€ орб≥талей в≥дбуваЇтьс€ посл≥довно в напр€мку зростанн€ головного квантового числа.
якщо розрахувати суми (n +  ) дл€ n = 1Е7 ≥ записати значенн€ сум у по-р€дку њх зростанн€, то можна одержати посл≥довн≥сть заповненн€ енергетичних р≥вней ≥ п≥др≥вней:
) дл€ n = 1Е7 ≥ записати значенн€ сум у по-р€дку њх зростанн€, то можна одержати посл≥довн≥сть заповненн€ енергетичних р≥вней ≥ п≥др≥вней:
1sЃ2sЃ2pЃ3sЃ3pЃ4sЃ3dЃ4рЃ5sЃ4dЃ5pЃ6sЃ4fЃ5dЃ6pЃ7sЃ5fЃ6d...
«а приведеними правилами можна дл€ будь-€кого атома скласти елект-ронну формулу, тобто записати розпод≥л електрон≥в по орб≥тал€х на енер-гетичних р≥вн€х ≥ п≥др≥вн€х. “ак, наприклад, електронна формула атома √≥дрогену 1Ќ маЇ вигл€д 1s1, атома арбону (6—) Ч 1s22s22p2, атома кал≥ю (19 ) Ч 1s22s22p63s23p63d04s1, атома титану (22“≥)Ч 1s22s22p63s23p63d24s2.
як видно з формул, велика цифра вказуЇ на номер енергетичного р≥вн€, л≥тери s, p, d, f Ч енергетичний п≥др≥вень, маленька цифра над л≥терою праворуч Ч число електрон≥в на цьому п≥др≥вн≥.
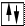
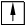
 ƒл€ наочного зображенн€ розпод≥лу електрон≥в в атом≥ використовують електронограф≥чн≥ формули. ѕри цьому атомну орб≥таль зображують у вигл€д≥ кл≥тинки (енергетичноњ ком≥рки), електрон на орб≥тал≥ позначають стр≥лкою в енергетичн≥й ком≥рц≥. якщо ж на одн≥й орб≥тал≥ перебувають два
ƒл€ наочного зображенн€ розпод≥лу електрон≥в в атом≥ використовують електронограф≥чн≥ формули. ѕри цьому атомну орб≥таль зображують у вигл€д≥ кл≥тинки (енергетичноњ ком≥рки), електрон на орб≥тал≥ позначають стр≥лкою в енергетичн≥й ком≥рц≥. якщо ж на одн≥й орб≥тал≥ перебувають два
електрони, то вони зображуютьс€ так:. –≥вн≥ розташовують один над одним в≥дпов≥дно до зм≥ни енерг≥њ. Ќаприклад:
 |  | ||
 |
 |  | ||
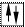 | |||
 | |||
ј2.ѕер≥одична система елемент≥в ƒ. ≤.ћенделЇЇва та






