3.2.1 Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и втором случаях?
Поскольку магний имеет меньшую величину электродного потенциала (–2,37 В), чем никель (– 0,25 В), то он будет играть роль анода, а никель – роль катода. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация), или ионов водорода, присутствующего в кислой среде (водородная деполяризация).
Электродные процессы, протекающие в нейтральной среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
K) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления.
Образующиеся ионы магния связываются с гидроксид-ионами, с образованием гидроксида магния:
Mg2+ + 2ОН– → Mg(ОН)2 – продукт коррозии в нейтральной среде.
Схема работы данного гальванического элемента:
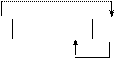 |
Mg H2O, О2 Ni
Электродные процессы, протекающие в кислой среде:
А) Mg0 – 2ē → Mg2+ – процесс окисления;
K) 2Н+ + 2ē → Н2 – процесс восстановления.
Поскольку не указана кислота, в которую погружена гальванопара магний – никель, то будем считать, что продуктом коррозии в кислой среде является соль мания (Mg2+).
Схема работы данного гальванического элемента:
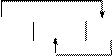 |
Mg H+ Ni
3.2.2 Каким покрытием по отношению к железу является никель? Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов, протекающих в растворе хлорида натрия и в растворе бромоводородной кислоты. Каков состав продуктов коррозии?
1 Раствор хлорида натрия имеет нейтральную реакцию среды. Функция NaCl заключается в ускорении процесса коррозии.
Поскольку железо имеет меньшую величину электродного потенциала (– 0,44 В), чем никель (– 0,25 В), то оно будет играть роль анода, а никель – роль катода. Следовательно, покрытие никелем будет являться катодным по отношению к железу.
При нарушении никелевого покрытия на железе самопроизвольно возникает гальванический элемент. Так как металл катода является восстановленной формой, то на нем будет протекать процесс восстановления молекул кислорода, присутствующего в нейтральной среде (кислородная деполяризация).
Электродные процессы:
А) Fe0 – 2ē → Fe2+ – процесс окисления;
K) 2Н2О + О2 + 4ē → 4ОН– – процесс восстановления;
Fe2+ + 2ОН– → Fe(ОН)2.
Гидроксид железа Fe(ОН)2 является неустойчивым соединением, поэтому в нейтральной среде протекает процесс его доокисления:
4Fe(ОН)2 + 2Н2О + О2 → 4Fe(ОН)3.
Далее происходит процесс отщепления молекул воды и образование оксид-гидроксида.
Fe(ОН)3 → FeООН + Н2О;
2FeООН → Fe2О3 + Н2О.
Состав продуктов коррозии будет следующим:
Fe(ОН)2, Fe(ОН)3, FeООН, Fe2О3.
Схема работы данного гальванического элемента:
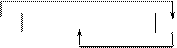 |
Fe H2O, О2, NаCl Ni
2 Бромоводородная кислота создает кислую среду. Как говорилось ранее, железо будет играть роль анода, а никель – роль катода. Так как металл катода является восстановленной формой, то на нём будет протекать процесс восстановления ионов водорода, образующихся при диссоциации бромоводородной кислоты.
Электродные процессы:
А) Fe0 – 2ē → Fe2+ – процесс окисления;
K) 2Н+ +2е → Н2 – процесс восстановления.
Образующиеся при окислении железа, его ионы будут взаимодействовать с образующимися при диссоциации кислоты ионами брома:
Fe2+ + 2Br– → FeBr2 – продукт коррозии.
Схема работы данного гальванического элемента:
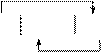 | |||||
 |  |
Fe HBr Ni
Следует отметить, что во всех схемах, касающихся работы гальванического элемента и процессов коррозии, нижняя стрелка всегда идет к ионам (молекулам), выполняющим роль деполяризатора, т. е. принимающим электроны и восстанавливающимся на катоде.
3.2.3 В чем сущность протекторной защиты металлов? Приведите пример протекторной защиты железа в электролите, содержащем щелочь. Составьте электронные уравнения анодного и катодного процессов.
Метод протектора (анодная электрохимическая защита) осуществляется присоединением к защищаемому металлу большого листа (старого металлического изделия), изготовленного из более активного металла с меньшей величиной электродного потенциала. В качестве протектора обычно используют цинк или сплавы на основе магния.
Рассмотрим в качестве примера протекторную защиту железа, соединенного с цинковой пластиной. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду СЭП (цинк имеет меньшую величину электродного потенциала, чем железо), железо поляризуется катодно, а цинк – анодно.
В результате этого на железе идет процесс восстановления кислорода, присутствующего в электролите (кислородная деполяризация так же характерна и для щелочной среды), а цинк окисляется и разрушается.
Электронные уравнения анодного и катодного процессов:
А) Zn0 – 2е → Zn2+ – процесс окисления;
K) 2Н2О + О2 + 4е → 4ОН– – процесс восстановления;
Zn2+ + 2ОН– → Zn(ОН)2.
Если бы на месте цинка был какой-либо металл, не проявляющий амфотерных свойств, то на этом процесс коррозии и остановился бы, т. е. гидроксид металла можно было бы считать продуктом коррозии. Но поскольку цинк может быть отнесен к металлам, проявляющим амфотерные свойства, то его гидроксид растворяется в щелочах (NaOH, KOH и т. д.) с образованием комплексных соединений:
2NaOH + Zn(OH)2 → Na2[Zn(OH)2] – продукт коррозии.
Следовательно, в щелочной среде нецелесообразно использовать в качестве протектора металл, проявляющий амфотерные свойства.
Схема работы данного гальванического элемента:
 |
Zn Н2О, О2, NaOH Fe
Контрольные вопросы и задачи
1 Рассчитайте электродный потенциал алюминиевого электрода, опущенного в 0,001м раствор соли Cr2(SO4)4.
2 Из каких солей металл может быть вытеснен и Zn и Ni? Только Zn?
a) FeCl2; б) Al2(SO4)3 ; в) CuBr2.
Запишите уравнения происходящих процессов.
3 При какой концентрации ионов Sn2+ в растворе потенциал оловянного электрода станет равным стандартному электродному потенциалу водородного электрода?
4 Что является окислителем и восстановителем в гальваническом элементе, составленном оловом и серебром, которые погружены в нормальные растворы их солей? Составьте схему соответствующего гальванического элемента.
5 Составьте схемы двух гальванических элементов, в одном из которых никель является анодом, а в другом – катодом. Запишите уравнения электродных процессов и суммарные уравнения реакций.
6 Составьте схему, запишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из магниевых электродов, опущенных: первый в 0,001Н, второй в 0,01Н растворы MgSO4.
7 ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с [Ni2+] = 0,0001 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определить концентрацию ионов Ag+ в растворе его соли.
8 Изменится ли ЭДС гальванических элементов при уменьшении концентрации растворов солей в 10 раз?
а) Cu ô Cu2+ ôô Zn2+ ô Zn;
б) Ag ô Ag+ ôô Zn2+ ô Zn.
Ответ подтвердить расчетами.
9 В каком направлении будут перемещаться электроны во внешней цепи следующих гальванических элементов:
а) Cu|Cu2+ и Ni|Ni2+
б) Zn|Zn(NO3)2 и Ag|AgNO3
в) Al|Al3+ и Mg|Mg2+
10 Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытий? Составьте электронные уравнения анодного и катодного процессов.
11 Какое покрытие металла называется анодным и какое - катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия марганца. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии марганца при нарушении анодного и катодного покрытий во влажном воздухе и в растворе серной кислоты.
12 Если опустить в соляную кислоту пластинку из чистого кадмия, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если хромовой палочкой прикоснутся к кадмиевой пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
Список литературы:
1 Ахметов, Н. С. Общая и неорганическая химия /Н. С. Ахметов. – М.: Высш. шк., 1981.
2 Глинка, Н.Л. Общая химия /Н. Л. Глинка – М.: Интеграл-Пресс, 2006.
3 Глинка, Н.Л. Задачи и упражнения по общей химии /Н. Л. Глинка – М.: Интеграл-Пресс, 2006.
4 Коровин, Н.В. Общая химия /Н. В. Коровин – М.: Высш. шк., 2002.






