3.1.1 В каких случаях будет протекать химическая реакция:
а) Мn + ZnSO4 →
б) Bi + Cu(NO3)2 →
в) Co +FeBr3 →
г) Sn +AgNO3 →
Как мы помним, металлы способны вытеснять друг друга из растворов солей только в том случае, если один из металлов, опускаемый в раствор соли второго металла, имеет более отрицательное значение стандартного электродного потенциала. Т. Е. он является более активным и стоит в ряду СЭП выше вытесняемого металла.
Следовательно, реакция не пойдет в случае (п. 3.1.1, в), поскольку кобальт в ряду СЭП стоит ниже железа:
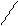 Co + FeBr3 →
Co + FeBr3 →
Запишем молекулярные уравнения возможных реакций
а) Мn + ZnSO4 → MnSO4 + Zn;
б) 2Bi + 3Cu(NO3)2 → 2Bi(NO3)3 + 3Cu;
г) Sn +2AgNO3 → Sn(NO3)2 + 2Ag.
При составлении формул образовавшихся солей, следует учитывать заряд образующегося иона металла (его можно посмотреть в ряду СЭП или в таблице растворимости) и заряд кислотного остатка (см. таблицу растворимости). Например, в реакции (п. 3.1.1, б) медь заменили в соли висмутом (количество групп NO3– при этом мы не учитываем) и получили BiNO3. Так как заряд иона висмута «3», а нитрат-иона «–», то формула нитрата висмута – Bi(NO3)3. Не забывайте уравнивать получившиеся уравнения.
Чтобы записать ионно-молекулярные уравнения возможных реакций, следует воспользоваться таблицей растворимости: помните, что растворимые соли относятся к сильным электролитам и записываются в виде ионов, а нерастворимые – в виде молекул.
а) Мn0 + Zn2+ + SO42– → Mn2+ + SO42– + Zn0;
б) 2Bi0 + 3Cu2+ + 6NO3– → 2Bi3+ + 6NO3– + 3Cu0;
г) Sn0 +2Ag+ + 2NO3– → Sn2+ + 2NO3– + 2Ag0.
или в сокращенной ионной форме:
а) Мn0 + Zn2+ → Mn2+ + Zn0;
б) 2Bi0 + 3Cu2+ → 2Bi3+ + 3Cu0;
г) Sn0 +2Ag+ → Sn2+ + 2Ag0.
Если не удается сократить ионы кислотного остатка, например, слева 3NO3–, а справа – 2NO3–, то это говорит о том, что или формулы полученных солей составлены неверно, или коэффициенты расставлены неправильно.
3.1.2 Добавлением каких из веществ:
а) Ag; б) Cr; в) Sn; г) Ni
можно освободить раствор сульфата никеля от примесей сульфата меди, чтобы получить раствор без примесей? Запишите ионно-молекулярное уравнение реакции.
Чтобы убрать примесь сульфата меди, необходимо опустить в раствор более активный металл, способный вытеснить ее. Поэтому нам не подходит серебро, поскольку в ряду СЭП Ag стоит ниже Cu. На первый взгляд можно использовать остальные металлы для очистки раствора сульфата никеля, но:
а) если помесить в раствор хром, то он вытеснит и никель, и медь, поскольку он стоит в ряду СЭП выше этих металлов;
б) если помесить в раствор олово, то оно вытеснит медь, но при этом мы получим примесь SnSO4, а нам нужен раствор без примесей.
Следовательно, в раствор, требующей очистки от примесей, необходимо опускать тот металл, который входит в состав основного раствора, т. Е. в данном случае – это никель. Запишем уравнение протекающей реакции:
Ni + CuSO4 → NiSO4 + Cu;
Ni0 + Cu2+ + SO42– → Ni2+ + SO42– + Cu0;
Ni0 + Cu2+ → Ni2+ + Cu0.
3.1.3 Рассчитайте электродный потенциал Bi в 0,01 м растворе его соли.
Значение электродного потенциала рассчитаем на основании уравнения Нернста:
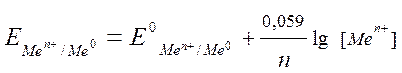 .
.
Значение стандартного электродного потенциала (Е0) висмута возьмем из ряда СЭП (+0,21 В), n – количество электронов, участвующих в процессе, равно заряду иона висмута («3+»), концентрация ионов металла указана в условии задачи – 0,01 моль/л. Подставляем данные в формулу и производим расчет:
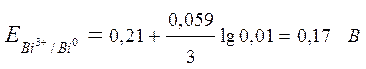 .
.
3.1.4 При какой концентрации ионов Cd2+ в моль/л потенциал кадмиевого электрода будет равен стандартному электродному потенциалу цинкового электрода?
Для решения задачи используем уравнение Нернста:
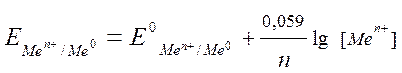
В данном случае согласно условию задачи 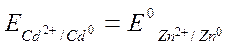
Значение стандартных электродных потенциалов (Е0) цинка и кадмия возьмем из ряда СЭП, n – количество электронов, участвующих в процессе, равно заряду иона кадмия («2+»), а концентрацию ионов кадмия необходимо найти. Подставляем данные в формулу и производим расчет:
 ;
;
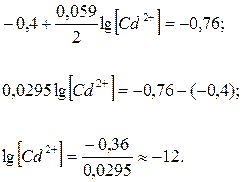
Отсюда концентрация ионов кадмия составит [Cd2+] = 10–12 моль/л.
3.1.5 Написать схему гальванического элемента, составленного из магниевой и железной пластинок, опущенных в растворы их сернокислых солей. Написать уравнения катодного и анодного процессов, вычислить ЭДС элемента при использовании 1М растворов сернокислых солей.
Поскольку EFe > EMg (железо является менее активным металом, так как характеризуется большим значением электродного потенциала), то на железном электроде будет протекать процесс восстановления, то есть он будет являться катодом, а на магниевом электроде – процесс окисления, так как магний будет являться анодом.
Запишем электродные процессы:
А) Mg0 – 2ē → Mg2+;
К) Fe2+ + 2ē → Fe0;
Схема рассматриваемого гальванического элемента:
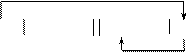 |
Mg MgSO4 FeSO4 Fe
Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы. Для этого находим значения стандартных электродных потенциалов систем Mg2+/Mg (–2,38 В) и Fe2+/Fe (–0,44 В), а затем рассчитываем значение электродного потенциала по уравнению Нернста. Но поскольку в условии задачи указаны концентрации растворов, равные 1 М (1 моль/л – стандартные условия), то 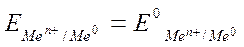 .
.
Подставляем известные данные и находим значения ЭДС:
ΔЕ = Екатода – Еанода = EFe – EMg = –0,44 – (–2,37) = 1,93 В
3.1.6 Предложите две схемы гальванических элементов, в одном из которых цинк играл бы роль анода, а во втором – роль катода. Запишите уравнения электродных процессов и уравнения токообразующих реакций (суммарных уравнений процессов), лежащих в основе работы этих гальванических элементов.
Мы помним, что роль анода играет более активный металл, т. е. стоящий ближе к началу ряда СЭП и имеющий меньшую величину электродного потенциала. Роль же катода – наоборот – менее активный металл, т. е. стоящий ближе к концу ряда СЭП и имеющий большую величину электродного потенциала.
1 Чтобы составить схему гальванического элемента, в котором цинк играл бы роль анода, необходимо в качестве катода взять металл, стоящий ниже цинка и имеющий большую величину электродного потенциала, например хром, кадмий, олово, медь, серебро и т. д. Остановимся на кадмии.
Поскольку в условии задачи не сказано, в растворы каких солей опущены металлы, то схему работы гальванического элемента составляем в ионной форме:
 |
Zn ô Zn2+ ôô Cd2+ ô Cd
Запишем уравнения электродных процессов:
А) Zn0 – 2ē → Zn2+ (окисление);
К) Cd2+ + 2ē → Cd0 (восстановление).
Если сложить процессы, протекающие на электродах, то получим суммарное уравнение реакции, или по-другому, уравнение реакции, лежащей в основе работы этого гальванического элемента (электроны при этом должны сократится):
Zn0 + Cd2+ → Zn2+ + Cd0.
Если по условию задачи требуется записать это же уравнение в молекулярной форме, то к положительным ионам необходимо добавить отрицательные, но с таким условием, чтобы получить сильный электролит:
Zn + Cd(NO3)2 → Zn(NO3)2 + Cd.
2 Чтобы составить схему гальванического элемента, в котором цинк играл бы роль катода, необходимо в качестве анода взять металл, стоящий выше цинка и имеющий меньшую величину электродного потенциала, например магний, алюминий, титан и т. д. Использовать в качестве анода щелочные и щелочно-земельные металлы (например, натрий, кальций и т. д.) использовать нельзя, поскольку при опускании в водный раствор они вступают с водой во взаимодействии. Остановимся на алюминии.
Составляем схему работы гальванического элемента в ионной форме:
 |
Al ô Al3+ ôô Zn2+ ô Zn
Запишем уравнения электродных процессов:
А) Al0 – 3ē → Al3+ (окисление);
К) Zn2+ + 2ē → Zn0 (восстановление).
Если сложить процессы, протекающие на электродах, то получаем суммарное уравнение реакции. Чтобы сократить электроны, необходимо первое уравнение умножить на 2, а второе – на 3. Тогда:
2Al0 + 3Zn2+ → 2Al3+ + 3Zn0.
В молекулярной форме, например:
2Al + 3ZnSO4 → Al2(SO4)3 + 3ZnSO4
или 2Al + 3Zn(NO3)2 → 2Al(NO3)3 + 3Zn.
3.1.7 Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3.
Гальванический элемент, составленный из одинаковых электродов, погруженных в растворы одного и того же электролита, различающихся только концентрацией, называется концентрационным. При этом электрод, помещенный в более разбавленный раствор (с меньшей концентрацией ионов в растворе), играет роль анода, а электрод в более концентрированном растворе (с большей концентрацией ионов металла в растворе) – роль катода.
Схема работы данного гальванического элемента:
 |
Ag AgNO3 (0,01 н) AgNO3 (0,1 н) Ag
Электродные процессы:
А) Ag0 – 1ē = Ag+ – процесс окисления;
K) Ag+ + 1ē = Ag0 – процесс восстановления.
Величина электродного потенциала отдельно взятого электрода рассчитывается по уравнению Нернста. Значение электродного потенциала серебра возьмем из ряда СЭП (+0, 8 В), количество электронов, участвующих в процессе, равно заряду иона серебра («+1»).
На уравнения Нернста найдем электродные потенциалы металла анода и катода.
| EК = 0,8 + | 0,059 | l g 0,1 = 0,741 В; |
| EА = 0,8 + | 0,059 | l g 0,01 = 0,682 В. |
В данном случае будем считать, что СН = [Men+], поскольку фактор эквивалентности нитрата серебра равен 1.
ЭДС гальванического элемента рассчитаем по формуле
ЭДС = ЕК – ЕА = 0,741 – 0,682 = 0,059 В.






