ХИМИЯ
Методические указания к практическим занятиям и самостоятельной работы студентов всех специальностей
Гальванические элементы
Коррозия металлов

Могилев 2008
УДК 54
ББК 24.1
Х 65
Рекомендовано к опубликованию
Учебно-методическим управлением
ГУ ВПО «Белорусско-Российский университет»
Одобрено кафедрой «Технологии металлов» «30» мая 2008 г., протокол № 10
Составитель: ст. преподаватель Н. Л. Николаева
Рецензент: канд. биол. наук, доцент Н.О. Мартусевич
В методических указаниях раскрыто содержание тем «Гальванические элементы» и «Коррозия металлов». Вниманию студентов предложены основные понятия и законы данных тем, приведены примеры написания электродных процессов, составления схем работы гальванических элементов. Так же рассмотрены примеры решения некоторых задач и даны контрольные вопросы и упражнения.
Учебное издание
ХИМИЯ
Ответственный за выпуск Г. Ф. Ловшенко
Технический редактор А. А. Подошевко
Компьютерная верстка
Подписано в печать. Формат 60х84 1/16. Бумага офсетная. Гарнитура Таймс.
Печать трафаретная. Усл. печ. л.. Уч.-изд. л.. Тираж 265 экз. Заказ № ________
Издатель и полиграфическое исполнение
Государственное учреждение высшего профессионального образования
«Белорусско-Российский университет»
ЛИ № 02330/375 от 29.6.2004 г.
212030, г.Могилев, пр.Мира, 43
ã ГУ ВПО Белорусско-Российский
университет, 2008
Гальванические элементы
Все химические реакции, в которых электроны переходят от одного вещества или его части (восстановителя) к другому веществу или к другой части одного и того же вещества (окислителю), называются окислительно-восстановительными, или редокспроцессами.
Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Устройства для получения электрической энергии за счет окислительно-восстановительных процессов, называют химическими источниками тока (ХИТ). Простейший ХИТ – гальванический элемент.
1.1 Механизм возникновения электродного потенциала.
Система, состоящая из металла, погруженного в раствор электролита, называется электродом. В узлах металлической кристаллической решетки располагаются положительно заряженные ионы, находящиеся в равновесии со свободными электронами. При погружении металла (Ме) в раствор начинается взаимодействие поверхностных ионов металла (Me n+), находящихся в узлах решетки, с полярными молекулами воды, ориентированными у поверхности электрода. При этом ионы металла переходят из металлической фазы в раствор.
В результате между металлом и раствором устанавливается равновесие:
 Me + mH2O Me n+ ∙m H2O + nē,
Me + mH2O Me n+ ∙m H2O + nē,
в растворе на металле
где n – число электронов, принимающих участие в процессе.
Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд (рисунок 1, а), а металлический электрод заряжается отрицательно. Если при установлении контакта металл – раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие, но в этом случае электрод заряжается положительно, а раствор – отрицательно (рисунок 1, б).
Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В любом случае появляется двойной электрический слой, характеризующийся определенным скачком потенциала.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. В настоящее время абсолютные значения электродных потенциалов на границе двух фаз разной природы металл│электролит экспериментально определить невозможно. Однако можно определить разность электродных потенциалов.
Поэтому для характеристики электродных процессов пользуются относительными значениями электродных потенциалов.
а) б) в)
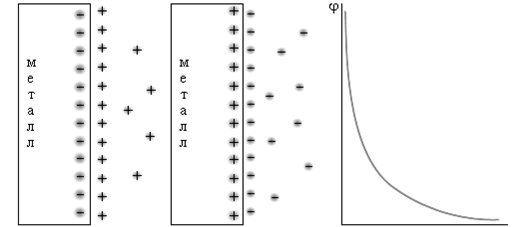
Рисунок 1 – Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в)
Стандартный водородный электрод. Измерение электродных потенциалов металлов. Уравнение Нернста.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н+ равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4 пропускают химически чистый газообразный водород под давлением 100 кПа при T = 298 K (рисунок 2).
Боковая трубка с краном также заполнена раствором серной кислоты и служит для соединения водородного электрода с другим электродом. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в пластине электроны.
При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде:
Н2 = 2Н+ + 2ē.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
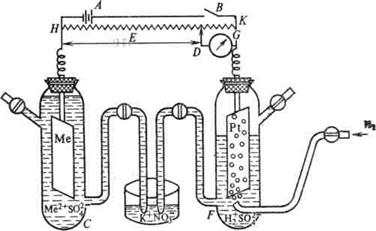
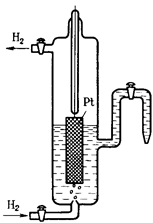
Рисунок 2 – Рисунок 3 – Установка для определения
Стандартный водородный электрод электродных потенциалов
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его напряжение (рисунок 3). Поскольку потенциал стандартного водородного электрода равен нулю, то измеренное напряжение будет представлять собою потенциал данного электродного процесса.
Таким образом, стандартным электродным потенциалом Е0 металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю.
Величина возникающего в результате этого процесса электродного потенциала определяется по уравнению Нернста:
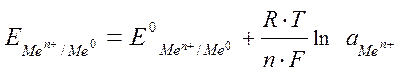 ,
,
где 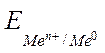 – электродный потенциал;
– электродный потенциал;
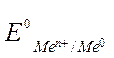 – стандартный электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
Т – температура;
F – число Фарадея;
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
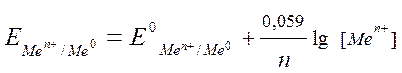 .
.






