Задача 1. Чему равна молярная концентрация частиц в растворе, содержащим 0,11 г CaCl2 в 200 мл раствора?
Решение.
CaCl2 D Ca+2 + 2 Cl-
молярная концентрация CaCl2
C М = 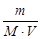 =
= 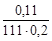 = 5×10-3 моль/л,
= 5×10-3 моль/л,
так как CaCl2 – соль (сильный электролит), а концентрация раствора мала, примем a = 1 (100 %).
Тогда
[CaCl2]расп. на ионы = [CaCl2]общей = 5×10-3 моль/л;
[CaCl2]недис. = 0 моль/л.
Из уравнения электролитической диссоциации следует, что
[Ca+2] = [CaCl2]расп. на ионы = 5×10-3 моль/л;
[C1-] = 2[CaCl2]расп. на ионы =2×5×10-3 = 10-2 моль/л.
Ответ. В растворе присутствуют ионы Ca+2 и C1-, молекулы CaCl2 – отсутствуют. [Ca+2] =5×10-3, [C1-] =10-2 моль/л.
Задача 2. Определить концентрации [Н+], [CН3СОО-] и [CН3СООН] в 0,1 M растворе CН3СООН, если a =1,34 %.
Решение. CН3СООН D Н+ + CН3СОО-]. Ионы CН3СОО- и Н+ образуются из молекул CН3СООН, участвующих в электролитической диссоциации. Из уравнения следует, что
[CН3СОО-] = [Н+]= [CН3СООН]расп. на ионы.
По определению a = С расп. на ионы / C общее кол-во, следовательно,
[CН3СОО-] расп. на ионы = [CН3СООН]общ.× a = 0,1× 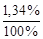 = 1,34 × 10-3 моль/л, отсюда [Н+]= [CН3СОО-] = 1,34× 10-3 моль/л.
= 1,34 × 10-3 моль/л, отсюда [Н+]= [CН3СОО-] = 1,34× 10-3 моль/л.
Не распалось на ионы
[CН3СООН] = [CН3СООН]общ. - [CН3СОО-] расп. на ионы = С - a С = С (1-a) = 0,1(1-0,00134) = 0,099866 моль/л.
Ответ. [CН3СООН]недис. = 0,099866 моль/л;
[Н+]= [CН3СОО-] = 1,34× 10-3 моль/л.
Задача 3. Определить [Н+] и рН в 10-2 M растворе азотистой кислоты. K дис. 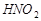 = 5,1×10-4.
= 5,1×10-4.
Решение.
HNO2 D H+ + NO-2
[H+] = [HNO2]расп. неполн. = a С (см. задачу 2).
По закону разведения Оствальда. K дис. = С M. a2, откуда
a =  =
= 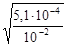 = 2,3×10-1.
= 2,3×10-1.
[H+] = a С общ. = 2,3×10-1×10-2 =2,3×10-3 моль/л;
рН = -lg [H+] = -lg(2,3×10-3)= 2,64.
Ответ. [H+] =2,3×10-3 моль/л; pH = 2,64.
Задача 4. Чему равны [ОH-], [H+] и рН в 0,2 %-ном растворе NaOH? Плотность раствора равна 1 г/см3.
Решение.
1. Определим С M раствора NaOH.
Примем V р-ра = 1л = 1000 см3,
m р-ра = V р-ра × r р-ра = 1000 × 1 = 1000 г,
m NaOH = m р-ра  = 1000
= 1000 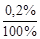 = 2 г,
= 2 г,
С M = 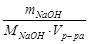 =
=  = 0,05 моль/л.
= 0,05 моль/л.
2. NaOH D Na+ + OH-, так как NaOH относится к сильным электролитам, то при С M = 0,05 моль/л примем a = 1.
Следовательно, С расп. на ионы = С общ. = 0,05 моль/л;
[Na+] = [OH-] =[NaOH]расп. на ионы = 0,05 моль/л.
3. Из ионного произведения воды [Н+] × [OH-] = 10-14
следует [Н+] = 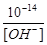 =
=  = 2×10-13 моль/л.
= 2×10-13 моль/л.
4. Водородный показатель рН = -lg[Н+] = lg2×10-13 = 12,7.
Ответ. [ОH-] = 5×10-2 моль/л, [H+] = 2×10-13 моль/л и рН = 12,7.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
Теоретические вопросы
1. Какой процесс называется электролитической диссоциацией?
2. Какие вещества называются электролитами и неэлектролитами? Приведите примеры.
3. Какова роль сольватации (гидратации) в процессах растворения и электролитической диссоциации?
4. Что называется степенью электролитической диссоциации? Какие электролиты относятся к сильным, средним и слабым? Приведите примеры для различных классов неорганических соединений.
5. От каких факторов зависит степень электролитической диссоциации a? Влияние природы растворенного вещества и растворителя, концентрации растворенного вещества, температуры, наличия в растворе веществ, содержащих одноименные ионы, на степень диссоциации.
6. Что называется константой электролитической диссоциации? (Определение). От каких факторов зависит константа электролитической диссоциации?
7. Используя вывод закона разведения (разбавления) Оствальда, приведите взаимосвязь K дис., a и молярной концентрации. Для каких электролитов применим закон Оствальда?
8. Ступенчатая диссоциация кислот и оснований. Приведите примеры и напишите K дис. для каждой ступени. Сравните a и K дис. Для каждой из ступеней электролитической диссоциации.
9. К каким электролитам относят соли? Приведите примеры электролитической диссоциации для средних, кислых основных солей.
10. Приведите примеры (не менее 5) наиболее распространенных кислот и оснований. Какие из них относят к сильным электролитам, а какие - к слабым?
11. Какие электролиты относятся к сильным? Приведите примеры для каждого класса неорганических соединений. Состояние сильных электролитов в растворах. Понятие об активности и коэффициенте активности.
12. К каким электролитам относится вода? Напишите уравнение электролитической диссоциации воды. Константа диссоциации воды. Ионное произведение воды.
13. Каково соотношение концентраций ионов водорода и гидроксильных ионов в воде, растворах кислот и оснований?
14. Водородный показатель рН (определение) и его значения в нейтральных, кислых и щелочных растворах.
Задачи
1. Вычислите концентрацию гидроксид-иона и рН в 0,1 молярном растворе азотной кислоты.
2. Вычислите молярную концентрацию ионов водорода и рН в 0,01 молярном растворе гидроксида калия.
3. Водородный показатель раствора рН = 3. Определите молярную концентрацию иона водорода и гидроксид-иона в этом растворе.
4. Молярная концентрация гидроксид-иона равна 10-3 моль/л. Вычислите рН и концентрацию иона водорода в растворе.
5. Вычислите рН и концентрацию гидроксид-иона в 0,1%-ном растворе соляной кислоты. Степень электролитической диссоциации и плотность раствора считать равными единице.
6. Вычислите молярную концентрацию гидроксид-иона и рН в 0,01 нормальном растворе азотной кислоты.
7. Чему равна концентрация гидроксид-иона в растворе, рН которого равен 11?
8. Определите рН и концентрацию ионов водорода в растворе, в 1 литре которого содержится 0,4 грамма гидроксида натрия.
9. Определите концентрацию ионов водорода и рН в 10-3 молярном растворе гидроксида калия.
10. В одном литре раствора содержится 0,056 граммов гидроксида калия. Определите концентрацию ионов водорода и гидроксида-иона в этом растворе.
11. Степень диссоциации уксусной кислоты СН3СООН в 10-3 молярном растворе равна 10 %. Определите концентрацию ионов водорода и рН раствора.
12. Вычислите константу диссоциации и концентрацию ионов гидроксида в 2×10-3 молярном растворе гидроксида аммония NH4OH, если степень его диссоциации a = 10 %.
13. Вычислите степень диссоциации, концентрацию ионов водорода и рН в 0,05 молярном растворе плавиковой кислоты. Константа диссоциации K дис.HF равна 7,4×10-4.
14. Вычислите концентрацию ионов водорода, степень диссоциации и рН в 0,1 молярном растворе перекиси водорода Н2О2. K дис. 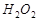 по первой ступени равна 2,4×10-12.
по первой ступени равна 2,4×10-12.
15. Степень диссоциации сероводородной кислоты в 5 %-ном (по массе) растворе равна 3 %. Вычислите константу диссоциации сероводородной кислоты по первой ступени диссоциации. Плотность раствора принять равной 1 г/см3.
16. Вычислите степень диссоциации гидроксида аммония и концентрацию гидроксид-иона в 0,1 молярном растворе. Константа диссоциации K дис. 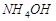 = 1,8×10-5.
= 1,8×10-5.
17. Вычислите концентрацию ионов водорода и степень диссоциации уксусной кислоты в 1%-ном растворе. Плотность раствора принять равной 1 г/см3. Константа диссоциации K дис. 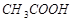 = 1,8×10-5.
= 1,8×10-5.
18. Вычислите молярную концентрацию раствора плавиковой кислоты, если степень диссоциации равна 8 %. Константа диссоциации K дис. НF =7,4×10-4.
19. Вычислите концентрацию ионов водорода, степень диссоциации и рН раствора угольной кислоты с массовой долей 3 %. Плотность раствора принять равной 1 г/см3. Константа диссоциации угольной кислоты по первой ступени K дис. 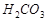 = 3,5×10-5.
= 3,5×10-5.
20. Вычислите степень диссоциации и рН раствора сероводородной кислоты с массовой долей 3 %. Плотность раствора принять равной 1 г/см3. Константа диссоциации по первой ступени K дис. 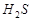 = 1,02×10-7.
= 1,02×10-7.
Домашние задания по теме «Растворы»
| Вариант | |||||||||||||||
| Теоретический вопрос | |||||||||||||||
| Задачи |
Домашние задания по теме «Электролитическая диссоциация»
| Вариант | |||||||||||||||
| Теоретический вопрос | |||||||||||||||
| Задачи |






