ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
С ИСПОЛЬЗОВАНИЕМ
КОНЦЕНТРАЦИИ РАСТВОРОВ
Задача 1. Сколько граммов КОН надо растворить в 100 г воды, чтобы получить раствор с массовой долей 6 %?
Решение. По определению массовой доли (w) известно, что в 100 г раствора будет содержаться 6 г КОН.
m раствора = m растворенного в-ва + m  ;
;
следовательно, m  = 100 г раствора – 6 г = 94 г,
= 100 г раствора – 6 г = 94 г,
тогда в 94 г Н2О содержится 6 г КОН, а
в 100 г Н2О» х г КОН; х = 6,38 г КОН.
Задача 2. Какой объем 96 %-ной (по массе) серной кислоты (плотность раствора, r = 1,84 г/см3) и какую массу воды надо взять для приготовления 100 мл 15%-ного (по массе) раствора серной кислоты (плотность раствора, r = 1,10 г/см3).
Решение. Найдем массу 100 мл 15%-ного (по массе) раствора Н2SO4.
m раствора = r× V = 1,10×100 = 110 г
Массу Н2SO4, содержащуюся в 110 г этого раствора, найдем из пропорции
100 г раствора содержат 15 г Н2SO4
110 г раствора» х г Н2SO4,
х =16,5 г Н2SO4
или m 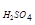 = 110×
= 110×  = 16,5 г.
= 16,5 г.
Далее найдем массу 96 %-ного (по массе) раствора Н2SO4, в котором содержится 16,5 г Н2SO4,
в 100 г раствора содержится 96 г Н2SO4
х г»» 16,5 г Н2SO4;
х = 17,2 г раствора или m 96%-ного р-ра =  = 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
= 17,2 г. Найдем объем 96 %-ного раствора, масса которого 17,2 г:
 ; V = 17,2/1,84 = 9,34 мл.
; V = 17,2/1,84 = 9,34 мл.
Итак, для приготовления 100 мл 15%-ного раствора Н2SO4 потребуется 9,34 мл 96%-ного раствора и 110 г - 16,5 г = 93,5 г Н2О.
Задача 3. Определите молярную концентрацию раствора NaOH, если в 200 мл раствора содержится 1,6 г растворенного вещества.
Решение. Молярная масса NaOH равна 40 г/моль. Определим количество молей NaOH, содержащихся в 200 мл раствора:
n = 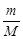 = 1,6: 40 = 0,04 моля.
= 1,6: 40 = 0,04 моля.
Исходя из определения молярной концентрации, найдем количество молей NaOH, содержащихся в 1 л раствора:
СM = n / V
СM = 0,04: 0,2 = 0,2 моль/л.
Задача 4. Какова нормальность раствора хлорида железа (III), в 0,3 л которого содержится 32,44 г соли?
Решение. Молярная масса хлорида железа равна 162,5 г/моль. Эквивалентная масса FeCl3 = 162,5: 3 = 54,17 г/моль-экв.
Определим количество моль-эквивалентов растворенного вещества (FeCl3), содержащихся в 0,3 л раствора:
n = 32,44: 54,17 = 0,6 моль-эквивалентов (эквивалентов).
Нормальность определяется количеством моль-эквивалентов растворенного вещества в 1 л раствора. Следовательно, 0,3 л содержит 0,6 моль-эквивалента
1 л» х моль-эквивалентов;
х = 2 моль-эквивалента (эквивалента).
С Н = 2 (2н раствор) или С Н =  экв./л.
экв./л.
Задача 5. Определите молярность, нормальность и титр 15%-ного раствора серной кислоты. Плотность раствора r =1,10 г/см3.
Решение. 1. Примем объем раствора, равным 1 л. Определяем массу (г) серной кислоты, содержащуюся в 1 л ее раствора, из пропорции
в 100 г раствора содержится 15 г Н2SO4
в 1,10 × 1000 г»» х г Н2SO4,
отсюда следует, что в 1л раствора массой 1,10 × 1000 г содержится х =165 г Н2SO4;
2. Молярная масса Н2SO4 равна 98 г/моль, в 1л раствора содержится Н2SO4 165: 98 = 1,68 моль. Таким образом С М = 1,68 моль/л;
3. Эквивалент Н2SO4 равен 98: 2 = 49 г/моль-экв. или 49 г/экв. Количество моль-эквивалентов в165 г Н2SO4 равно 165: 49 = 3,36 моль-эквивалентов. Следовательно, в 1л раствора содержится 3,36 моль-эквивалентов
С Н = 3,36 моль-экв./л (экв./л);
4. Определим титр раствора. Т = m / V; Т = 165: 1000 = 0,165 г/мл.
Задача 6. В каком объеме 0,5 нормального раствора карбоната натрия содержится 10 г соли? Какова молярность и титр этого раствора?
Решение. 1. Исходя из определения нормальности, в 1 литре раствора содержится 0,5 моль-эквивалентов Na2CO3.
Эквивалентная масса Na2CO3 = 106: 2 = 53 г/моль-экв. Следовательно, в 1 л 0,5 н раствора содержится 0,5 × 53 = 26,5 г Na2CO3,
тогда в 1л 0,5н раствора содержится 26,5 г Na2CO3
в х л» 10 г Na2CO3
х = 0,38 л;
2. Определим С М раствора. В 1 л 0,5н раствора содержится 26,5 г Na2CO3. Находим количество молей Na2CO3
n = 26,5:106=0,25 молей, следовательно, С М = 0,25 моль/л.
3. Определим титр раствора.
В 1000 мл раствора содержится 26,5 г Na2CO3
в 1мл раствора» х г
х = 0,0265 г, Т = 0,0265 г/мл.
Задача 7. Для нейтрализации 42 мл серной кислоты потребовалось 14 мл 0,3 н раствора щелочи. Определите молярность раствора Н2SO4.
Решение. Поскольку вещества реагируют между собой в эквивалентных количествах (закон эквивалентов), то можно написать
C Н кислоты× V кислоты = C Н щелочи× V щелочи
Следовательно, C Н кислоты × 42 = 14 × 0,3; C Н кислоты = 0,1.
C Н кислоты = 0,1 моль-эквивалентов/л. Молярная масса Н2SO4 = 98 г/моль; эквивалентная масса Н2SO4 =98: 2 = 49 г/моль-экв., или эквивалентная масса составляет 0,5 моля Н2SO4.
Отсюда молярность раствора Н2SO4 составит 0,1 × 0,5 = 0,05 моль/л, C М = 0,05 моль/л.
Или примем Vх раствора = 1 л, тогда m  = C Н × Э × V;
= C Н × Э × V;
 = 0,1×49×1 = 4,9 г; C М =
= 0,1×49×1 = 4,9 г; C М = 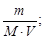
 = 0,05 моль/л.
= 0,05 моль/л.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
Теоретические вопросы
1. Растворы (определение). Почему для характеристики растворов, в отличие от индивидуальных веществ, необходимо указывать их состав?
2. Назовите известные Вам способы выражения состава растворов (концентрации). Укажите единицы их измерения.
3. Приведите формулы для расчета концентраций растворов (w, С М, С Н, Т).
4. Приведите примеры жидких, твердых и газообразных (газовых смесей) растворов. Какой из компонентов раствора обычно выбирают в качестве растворителя?
5. Какие растворы называются ненасыщенными, насыщенными и пересыщенными? Концентрация какого из этих растворов называется растворимостью?
6. Какова зависимость растворимости газов в жидкостях от температуры и давления (закон Генри)? Что такое парциальное давление?
7. Какова зависимость растворимости кристаллического вещества от температуры? Перекристаллизация и ее практическое применение.
8. Сольватация (гидратация) и ее роль в процессе образования растворов. Сольватная (гидратная) оболочка.
9. Энтальпия растворения как результат соотношения энтальпии разрушения кристаллической решетки и энтальпии сольватации (гидратации).
10. Дайте определения понятиям «массовая доля растворенного вещества в растворе» и «молярная концентрация раствора». Укажите расчетные формулы, единицы измерения.
11. Дайте определения понятиям «нормальная концентрация раствора» и «титр раствора». Укажите расчетные формулы, единицы измерения.
12. Применение принципа Ле-Шателье к обратимой системе «газ + растворитель D раствор»; rН < 0. Как влияет изменение давления газа и температуры на растворимость газа в жидкости?
13. Применение принципа Ле-Шателье к обратимой системе «кристаллическое вещество + растворитель D раствор»; rН > 0. Как влияет изменение температуры и внешнего давления на растворимость твердого вещества в жидкости?
14. Одинаковы ли энтальпии растворения Na2SO4 и Na2SO4 × 10 Н2О? Почему?
Задачи
1. Сколько граммов сульфата натрия следует растворить в 400 мл воды для получения 8%-ного (по массе) раствора?
2. Вычислите массовую долю (w %) раствора, содержащего 50 г хлорида натрия в 650 г воды.
3. Какова массовая доля (w %) раствора, если в 750 мл воды содержится 60 г нитрата серебра?
4. В каком количестве молей воды следует растворить 40 г иодида калия для получения 4%-ного (по массе) раствора?
5. В каком объеме воды следует растворить 50 г хлорида калия для получения 10%-ного (по массе) раствора?
6. Сколько граммов хлористого водорода надо растворить в 250 мл воды для получения 10%-ного (по массе) раствора соляной кислоты?
7. В 150 граммах воды растворили 15 л хлористого водорода (н.у.). Определите массовую долю (w %) образовавшегося раствора соляной кислоты.
8. Какой объем газообразного аммиака (н.у.) надо растворить в воде, чтобы получить 500 г 6%-ного (по массе) раствора аммиака?
9. Сколько граммов гидроксида калия надо растворить в 100 г воды, чтобы получить раствор с массовой долей 6 %.
10. Сколько граммов соли и воды содержится в 800 г 12%-ного (по массе) раствора нитрата натрия?
11. К 300 мл раствора с массовой долей серной кислоты 30 % (плотность раствора r = 1,22 г/мл) добавим 1 литр воды. Рассчитайте массовую долю (w %) полученного раствора.
12. В каком объеме воды следует растворить 100 граммов сульфата калия для получения раствора с массовой долей растворенного вещества 5 %?
13. Сколько граммов хлорида натрия и воды потребуется для приготовления 3 л раствора с массовой долей растворенного вещества 5 % (плотность раствора r = 1,03 г/мл)?
14. В каком объеме воды следует растворить 60 г хлорида магния для получения 10%-ного (по массе) раствора?
15. Вычислите массовую долю (w %) раствора, содержащего 50 г сульфата натрия в 750 г воды.
16. Вычислите массовую долю (w %) азотной кислоты в растворе, в 0,5 л которого содержится 120 г кислоты (плотность раствора ρ = 1,14 г/см3).
17. Какой объем 96%-ной (по массе) серной кислоты (плотность раствора r = 1,84 г/мл) потребуется для приготовления 3 л 0,5 М раствора? Какова нормальность полученного раствора?
18. Рассчитайте молярность, нормальность и титр 2 % -ного раствора сульфата магния (плотность раствора r = 1,02 г/мл).
19. Рассчитайте молярную и нормальную концентрацию 8%-ного (по массе) раствора серной кислоты (плотность раствора r = 1,05 г/мл).
20. В 282 мл воды растворим 18 г фосфорной кислоты. Рассчитайте масссовую долю (w %), молярность и нормальность этого раствора (плотность раствора r = 1,03 г/мл).
21. Сколько граммов сульфата калия необходимо для приготовления 5 л раствора с массовой долей 5 % (плотность раствора r = 1,04 г/мл)? Рассчитайте молярность и нормальность приготовленного раствора.
22. В каком объеме 0,5 молярного раствора карбоната натрия содержится 7 граммов соли? Какова нормальность и титр этого раствора?
23. К раствору серной кислоты объемом 300 мл с массовой долей 30 % (плотность раствора r = 1,22 г/мл) добавили 1 л воды. Рассчитайте массовую долю (w %) и молярность полученного раствора. Плотность полученного раствора r = 1,055 г/мл.
24. Сколько миллилитров 96%-ного раствора серной кислоты (плотность раствора r = 1,84 г/мл) необходимо для приготовления 2 л 0,5 нормального раствора серной кислоты?
25. В 33,3 мл воды растворили 16,7 грамма серной кислоты. Рассчитайте массовую долю (w %), молярность, нормальность и титр полученного раствора (плотность раствора r = 1,28 г/мл).
26. Сколько граммов нитрата калия потребуется для приготовления 500 мл 0,23 молярного раствора? Какова молярность и титр полученного раствора?
27. Титр раствора хлорида кальция равен 0,022 г/мл. Рассчитайте молярность и нормальность этого раствора.
28. Сколько граммов соли содержится в 200 мл 0,3 нормального раствора хлорида алюминия? Какова молярность и титр этого раствора?
29. Сколько литров 0,5 молярного раствора серной кислоты можно приготовить из 70 мл 50%-ного (по массе) раствора серной кислоты (плотность раствора r = 1,40 г/мл)?
30. Вычислите массовую долю (w %) раствора азотной кислоты в 0,3 л которого содержится 100 г кислоты (плотность раствора r = 1,28 г/мл). Какова молярность и нормальность этого раствора?
31. Сколько граммов раствора с массовой долей хлорида бария 4 % потребуется для взаимодействия с 30 мл 0,5 нормального раствора серной кислоты?
32. Сколько миллилитров 0,5 нормального раствора серной кислоты потребуется для нейтрализации 20 граммов гидроксида натрия?
33. Какой объем водорода (н.у.) выделится при растворении цинка в 100 мл 20%-ного (по массе) раствора соляной кислоты (плотность раствора r = 1,10 г/мл)?
34. Какой объем 0,2 молярного раствора серной кислоты потребуется для нейтрализации гидроксида калия, содержащегося в 300 г 17%-ного (по массе) раствора?
35. Сколько граммов раствора с массовой долей нитрата серебра 2% потребуется для взаимодействия с 30 мл 0,5 нормального раствора соляной кислоты?
36. Сколько миллилитров 0,5 нормального раствора соляной кислоты необходимо добавить к раствору нитрата серебра для получения 0,3 грамма осадка?
37. Сколько миллилитров 23%-ного (по массе) раствора аммиака (плотность раствора r = 0,916 г/мл) потребуется для взаимодействия с 250 мл 2 нормального раствора соляной кислоты?
38. Сколько литров 0,1 нормального раствора нитрата серебра потребуется для взаимодействия с 0,5 л 0,3 нормального раствора хлорида алюминия?
39. Какой объем 0,25 нормального раствора серной кислоты потребуется добавить к раствору карбоната натрия, чтобы выделилось 8 л диоксида углерода (н.у.)?
40. Сколько граммов 5%-ного раствора нитрата серебра потребуется для взаимодействия со 120 мл 0,5 нормального раствора хлорида магния?






